






化学鲁科版 (2019)第2节 电解质的电离 离子反应授课ppt课件
展开视频中误喝了泉水的将士们个个说不出话来,原因是因为他们喝的水中含有较多量的CuSO4,造成了重金属中毒。
后经一老叟指点,喝了万安溪安乐泉水后转危为安。因该泉水中含有较多的碱,碱与CuSO4发生离子反应Cu2++2OH-====Cu(OH)2↓使原来可溶性铜盐变成不溶性的Cu(OH)2沉淀而不会被人体吸收,从而达到解毒之目的。
1.通过实验事实认识离子反应及其发生的条件。2.结合实例学习掌握离子方程式书写的方法。3.了解常见离子的检验方法。
1.了解电离、电解质、非电解质的概念。(宏观辨识微观探析)2.了解电解质导电的原因。(宏观辨识微观探析)3.学会书写电离方程式。(变化观念与平衡思想)4.能够运用所学的电离知识分析和探讨电解质对人类健康的影响(科学态度与社会责任)
1.将滴有酚酞的0.01ml·L-1氢氧化钡溶液放入一个洁净的烧杯中;2.如图把电极放入烧杯,观察现象;3.向氢氧化钡溶液中慢慢滴入0.2ml·L-1的H2SO4溶液;4.记录实验现象并分析产生现象的原因。
稀硫酸与Ba(OH)2溶液的反应
1.电流计指针读数由大到小偏向零,再滴加时,又不断偏大,说明了什么?
2.溶液颜色为什么会由红色变成无色?
3.白色沉淀的成分是什么?
【提示】溶液中离子浓度减小,
【提示】 OH- 浓度减小,
H+ + OH- ==== H2O
【提示】Ba2+ + SO42- ==== BaSO4↓
硫酸过量后离子浓度又增加。
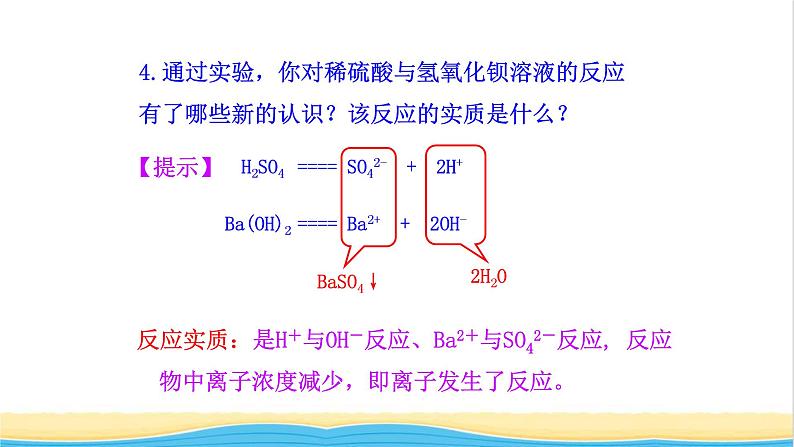
4.通过实验,你对稀硫酸与氢氧化钡溶液的反应有了哪些新的认识?该反应的实质是什么?
H2SO4 ==== SO42- + 2H+
Ba(OH)2 ==== Ba2+ + 2OH-
反应实质:是H+与OH-反应、Ba2+与SO42-反应, 反应物中离子浓度减少,即离子发生了反应。
电解质溶液之间发生的反应都是离子反应,都能使溶液中的离子浓度降低。
在溶液中有离子参加的化学反应叫做离子反应。
常见难溶物:BaSO4、 AgCl、CaCO3、BaCO3、Cu(OH)2 等
有难溶的物质生成有难电离的物质(如:水)生成有挥发性的气体生成
判断下列电解质溶液间能否发生离子反应?
①NaCl与AgNO3
能发生。生成了难溶的物质AgCl
②盐酸与NaOH溶液反应
能发生。生成了难电离的物质H2O
能发生。生成了难电离的物质H2O和挥发性物质CO2
③Na2CO3和盐酸反应
用实际参加反应的离子的符号表示离子反应的式子。
2.离子方程式的书写步骤:
一写 ——写出化学方程式;
二拆 ——将完全以离子形式存在的拆成离子;
四查 ——电荷守恒,原子守恒。
以Ba(OH)2溶液和盐酸反应为例:
Ba(OH)2+2HCl====BaCl2+ 2H2O
三删 ——删去不参与反应的离子;
Ba2+ + 2OH- +2H+ +2Cl- ====Ba2+ + 2Cl- + 2H2O
Ba2++2OH- +2H+ + 2Cl- ===== Ba2+ + 2Cl- + 2H2O
OH- + H+ ==== H2O
3.书写离子方程式方法归纳
酸、碱、盐在离子方程式中哪些该拆、哪些不该拆?
(1)能拆的有:强酸、强碱、可溶性的盐
(2)单质、氧化物、气体、沉淀、难电离的物质都写成化学式,不能拆
(3)不在溶液中进行的反应一般不能写离子方程式
【特别提醒】书写离子方程式应注意的问题
(1)凡不是在溶液中进行的反应一般不能写离子方程式。如:NH4Cl固体与Ca(OH)2固体混合加热,只能写化学方程式。即:2NH4Cl(固)+Ca(OH)2(固)====CaCl2+2NH3↑+2H2O
(2)对于微溶物的处理:①在生成物中有微溶物,微溶物用化学式。②当反应物里有微溶物处于溶液状态(稀溶液),应写成离子形式。③当反应物里有微溶物处于浊液或固态,应写化学式。
1.碳酸钙与醋酸反应CaCO3+2H+====Ca2++CO2↑+H2O2.铜片加入硝酸银Cu+Ag+====Cu2++Ag3.硫酸与氢氧化钡Ba2++H++SO42-+OH-====BaSO4↓+H2O4.饱和石灰水与稀硝酸Ca(OH)2+2H+====Ca2++2H2O
【思考交流】判断下列离子反应方程式是否正确,如果不正确,错在哪里?
错误:醋酸是弱酸,不能拆
错误:违背物质固定组成
书写下列反应的离子方程式:
①NaOH溶液和H2SO4溶液的反应
②KOH溶液和盐酸的反应
③BaCl2溶液和Na2SO4溶液的反应
④Ba(NO3)2溶液和Na2SO4溶液的反应
H+ +OH- ==== H2O
Ba2+ +SO42- ==== BaSO4↓
比较上述各反应的离子方程式,你发现了什么?你能说出离子方程式和化学方程式有哪些区别吗?
【提示】离子方程式不仅可以表示一定物质间的某个反应,还可表示所有同一类型的离子反应。
揭示了溶液中化学反应的实质
【例题】判断下列各组离子能否大量共存① Ca2+ Na+ CO32- NO3-② Ba2+ Na+ SO42- NO3-③ H+ K+ Cl- OH-④ H+ K+ CO32- SO42-⑤ Na+ H+ ClO- NO3-
三、判断离子能否大量共存
离子间不发生化学反应就可以大量共存
(1)生成难溶物或微溶物:
如:Ba2+与CO32-、Ag+与Cl-、Ca2+与SO42- 、Ba2+与SO42-
(2)生成气体或挥发性物质:
如:NH4+与OH-、H+与CO32-
(3) 生成难电离物质(即弱电解质):
如:H+与CH3COO-、ClO- 生成弱酸;H+与OH-生成水
离子不能大量共存的归纳
常见的四种有色离子:Cu2+ 、Fe2+ 、Fe3+ 、MnO4-
在某酸性无色溶液中可以大量共存的离子组是 ( ) A.K+ SO42- OH- Na+ B.Fe3+ Ca2+ Cl- NO3- C.Cu2+ MnO4- Na+ H+ D.K+ Na+ Cl- NO3-
如溶液的酸性、碱性、颜色
离子方程式的正误判断:
如:铁与稀盐酸反应2Fe + 6H+ ==== 2Fe3+ + 3H2↑
(2)符合质量守恒(原子守恒):
如:铝与稀盐酸反应 Al+ 3H+ ==== Al3++ H2↑
Fe + 2H+ ==== Fe2+ + H2↑
2Al+ 6H+ ==== 2Al3++ 3H2↑
如:Fe + Ag+ ==== Fe2+ + Ag
如:碳酸钡和稀硝酸反应
CO32- + 2H+ ==== H2O+ CO2↑
BaCO3 + 2H+ ==== Ba2++ H2O+ CO2↑
Fe + 2Ag+ ==== Fe2+ + 2Ag
(5)以物质的组成为依据:
Ba2++ OH- + H++SO42-====BaSO4↓+ H2O
(6)注意物质的状态及是否漏写:
如:碳酸钾固体和稀盐酸
Ba2++2OH-+2H++SO42-====BaSO4↓+2H2O
指出下列离子方程式属于哪种错误,并改正:
1.氢氧化铁与盐酸反应:H++OH- ==== H2O
2.碳酸钠与醋酸反应:CO32- + 2H+ ==== CO2↑+ H2O
Fe(OH)3+3H+====Fe3++3H2O
CO32- + 2CH3COOH ==== 2CH3COO- + CO2↑+ H2O
3.硫酸与氢氧化钡溶液的反应 : H+ + SO42-+ OH- + Ba2+ ==== BaSO4↓+ H2O
2H+ + SO42- + 2OH-+ Ba2+ ==== BaSO4↓+ 2H2O
4.氧化铜和稀硫酸反应:O2-+2H+====H2O↑
CuO + 2H+ ==== Cu2+ + H2O
5.过量二氧化碳通入澄清石灰水反应 : CO2 + Ca2+ + 2OH-====CaCO3↓+ H2O
CO2 + OH- ==== HCO3-
检验待测液中Cl-存在的步骤。
【提示】1.取少量待测液于一洁净试管中;2.加入AgNO3溶液;3.观察到产生白色沉淀;4.得出结论:待测液中有Cl-。
再加稀硝酸,白色沉淀不溶。
(1)发生复分解反应的离子不能大量共存①生成沉淀:例如Ag+与Cl-,Ba2+和SO42-不能共存;②生成气体:例如CO32-、HCO3-等酸根离子不能与H+大量共存;③生成H2O:如H+和OH-生成H2O而不能共存。
(2)审题时应注意题中给出的附加条件①无色溶液中不存在有色离子:如Cu2+、Fe3+、Fe2+、MnO4-等都有颜色。②注意挖掘某些隐含离子:酸性溶液(或pH﹤7)中隐含有H+,碱性溶液(或pH﹥7)中隐含有OH-。
表示一个反应;表示一类反应
1.下列说法正确的一组是( )①不溶于水的盐(CaCO3、BaSO4等)都是非电解质②易溶于水的物质都是电解质 ③熔融状态能导电的纯净物都是电解质④电解质溶液导电是因为溶液中有自由移动的阴、阳离子A.①③ B.②③④ C.只有④ D.只有③
2.下列反应的离子方程式不正确的是 ( )A.锌与硫酸铜溶液反应:Zn+Cu2+===Zn2++CuB.碳酸钠与盐酸反应:CO32-+2H+====CO2↑+H2O C.铜与稀盐酸反应:Cu+2H+===Cu2++H2↑D.氯化钡与硫酸反应:Ba2++SO42-===BaSO4↓
3.在碱性溶液中能大量共存且溶液为无色透明的离子组是( )A.K+ 、MnO4-、Na+、Cl-B.K+、Na+、NO3-、CO32-C.Na+、H+、NO3-、SO42-D.Fe3+、Na+、Cl-、SO42-
4.某酸性溶液中含有Ba2+、Fe3+,则下述离子组中能与上述离子大量共存的是( )A.CO32-、Cl- B.NO3-、Cl- C.NO3-、SO42- D.OH -、NO3-
5.铁、稀盐酸、澄清石灰水、氯化铜溶液是初中化学中常见的物质,四种物质间的反应关系如图所示。图中两圆相交部分(A、B、C、D)表示物质间的反应,其中对应反应的离子方程式书写正确的是( )
A.OH-+HCl====H2O+Cl-
B.Ca(OH)2+Cu2+=====Ca2++Cu(OH)2↓
C.Fe+Cu2+====Cu+Fe2+
D.2Fe+6H+====2Fe3++3H2↑
6.(双选)下列离子方程式能用来解释相应实验现象的是( )
鲁科版 (2019)必修 第一册第2节 电解质的电离 离子反应习题课件ppt: 这是一份鲁科版 (2019)必修 第一册第2节 电解质的电离 离子反应习题课件ppt,文件包含鲁科版高中化学必修第一册第2章元素与物质世界第2节电解质的电离离子反应第2课时离子反应课件ppt、鲁科版高中化学必修第一册第2章元素与物质世界第2节电解质的电离离子反应第2课时离子反应课后习题含答案doc等2份课件配套教学资源,其中PPT共60页, 欢迎下载使用。
化学鲁科版 (2019)第2节 电解质的电离 离子反应说课ppt课件: 这是一份化学鲁科版 (2019)第2节 电解质的电离 离子反应说课ppt课件,共51页。PPT课件主要包含了NO1,白色沉淀,H+与,OH-,易溶于水且易电离,未参与反应,NO2,学习任务1学习任务2,离子共存,NO3等内容,欢迎下载使用。
高中化学鲁科版 (2019)必修 第一册第2章 元素与物质世界第2节 电解质的电离 离子反应课堂教学ppt课件: 这是一份高中化学鲁科版 (2019)必修 第一册第2章 元素与物质世界第2节 电解质的电离 离子反应课堂教学ppt课件,共60页。PPT课件主要包含了分点突破1,离子反应,分点突破2,离子方程式,分点突破3,分点突破4,离子反应的应用等内容,欢迎下载使用。













