




还剩8页未读,
继续阅读
成套系列资料,整套一键下载
人教版高中化学选择性必修第一册第一章化学反应的热效应章末总结课件
展开
这是一份人教版高中化学选择性必修第一册第一章化学反应的热效应章末总结课件,共15页。
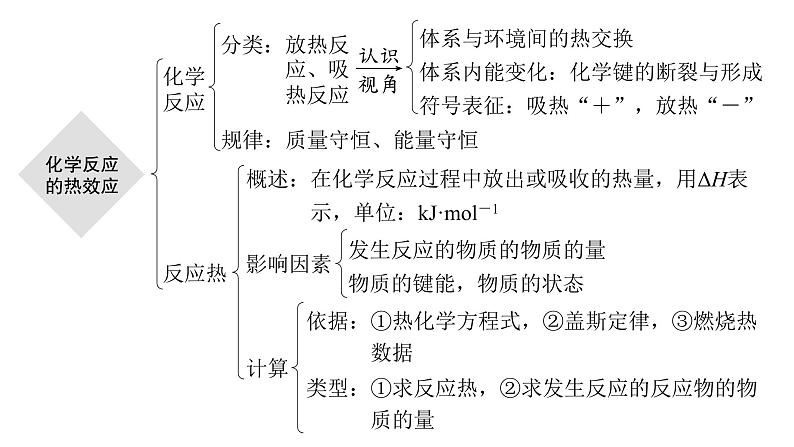
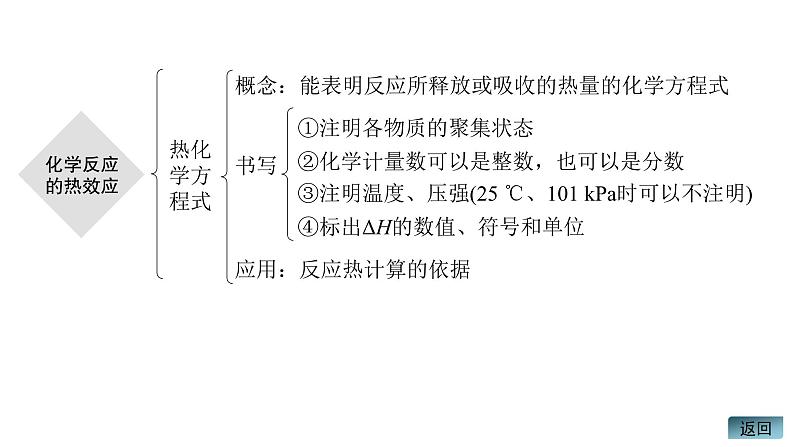
第一章 化学反应的热效应章末总结知识体系构建 核心素养提升内容索引体系构建 理清脉络素养提升 理念渗透体系构建 理清脉络化学反应分类:放热反 应、吸 热反应体系与环境间的热交换体系内能变化:化学键的断裂与形成符号表征:吸热“+”,放热“-”规律:质量守恒、能量守恒反应热概述:在化学反应过程中放出或吸收的热量,用ΔH表 示,单位:kJ·mol-1影响因素发生反应的物质的物质的量物质的键能,物质的状态计算依据:①热化学方程式,②盖斯定律,③燃烧热 数据类型:①求反应热,②求发生反应的反应物的物 质的量热化学方程式概念:能表明反应所释放或吸收的热量的化学方程式书写①注明各物质的聚集状态②化学计量数可以是整数,也可以是分数③注明温度、压强(25 ℃、101 kPa时可以不注明)④标出ΔH的数值、符号和单位应用:反应热计算的依据返回素养提升 理念渗透研究热化学反应,不仅能从宏观上认识新物质的生成和能量的变化,还要从微观上分析其变化的本质,并能形成能量可以相互转化的变化观念和能量守恒的思想。通过建立相关的思维模型,能正确书写热化学方程式,理解盖斯定律及其应用。认识能源与日常生活、工农业生产及科学技术有着千丝万缕的联系,形成科学合理利用化学反应中能量变化的意识和能源节约的意识。由此可见,通过本章内容的学习,可促进“宏观辨识与微观探析”“变化观念与平衡思想”“证据推理与模型认知”“科学态度与社会责任”等化学核心素养的发展。1.关于下列ΔH的判断正确的是OH-(aq)+H+(aq)===H2O(l) ΔH3OH-(aq)+CH3COOH(aq)===CH3COO-(aq)+H2O(l) ΔH4A.ΔH1<0 ΔH2<0 B.ΔH1<ΔH2C.ΔH3<0 ΔH4>0 D.ΔH3>ΔH41234√解析 将题给四个热化学方程式依次编号为①②③④,反应①可看作Na2CO3溶液和少量稀盐酸反应,为放热反应,ΔH1<0;反应②是 的水解反应,为吸热反应,ΔH2>0,从而推知:ΔH1<ΔH2,A错误、B正确;反应③是中和反应,ΔH3<0,反应④是CH3COOH和强碱的中和反应,ΔH4<0,由于CH3COOH电离要吸收热量,等量的OH-分别发生反应③和④时,反应③放出的热量比④多,则有ΔH3<ΔH4,C、D均错误。12342.已知:SO2(g)+ SO3(g) ΔH=-98 kJ·mol-1。钒催化剂参与反应的能量变化如图所示,V2O5(s)与SO2(g)反应生成VOSO4(s)和V2O4(s)的热化学方程式为:___________________________________________________________。2V2O5(s)+2SO2(g)===2VOSO4(s)+V2O4(s) ΔH=-351 kJ·mol-11234解析 据图写出热化学方程式:①V2O4(s)+2SO3(g)===2VOSO4(s) ΔH1=-399 kJ·mol-1;②V2O4(s)+SO3(g)===V2O5(s)+SO2(g) ΔH2=-24 kJ·mol-1,由①-②×2可得:2V2O5(s)+2SO2(g)===2VOSO4(s)+V2O4(s) ΔH=ΔH1-2ΔH2=(-399 kJ·mol-1)-(-24 kJ·mol-1)×2=-351 kJ·mol-1。12343.探究CH3OH合成反应化学平衡的影响因素,有利于提高CH3OH的产率。以CO2、H2为原料合成CH3OH涉及的主要反应如下:回答下列问题:ΔH3=________ kJ·mol-1。+40.9解析 由盖斯定律可知,Ⅲ式=Ⅰ式-Ⅱ式,即ΔH3=-49.5 kJ·mol-1-(-90.4 kJ·mol-1)=+40.9 kJ·mol-1。12344.100 mL 0.200 mol·L-1 CuSO4溶液与1.95 g锌粉在量热计中充分反应。测得反应前温度为20.1 ℃,反应后最高温度为30.1 ℃。已知:反应前后,溶液的比热容均近似为4.18 J·g-1·℃-1、溶液的密度均近似为1.00 g·cm-3,忽略溶液体积、质量变化和金属吸收的热量。请计算:(1)反应放出的热量Q=__________ J。4.18×103解析 根据题意,Q=cmΔt=4.18 J·g-1·℃-1×100 g×(30.1-20.1) ℃=4.18×103 J。1234(2)反应Zn(s)+CuSO4(aq)===ZnSO4(aq)+Cu(s)的ΔH=______________________________ kJ·mol-1(列式计算)。返回1234本课结束
第一章 化学反应的热效应章末总结知识体系构建 核心素养提升内容索引体系构建 理清脉络素养提升 理念渗透体系构建 理清脉络化学反应分类:放热反 应、吸 热反应体系与环境间的热交换体系内能变化:化学键的断裂与形成符号表征:吸热“+”,放热“-”规律:质量守恒、能量守恒反应热概述:在化学反应过程中放出或吸收的热量,用ΔH表 示,单位:kJ·mol-1影响因素发生反应的物质的物质的量物质的键能,物质的状态计算依据:①热化学方程式,②盖斯定律,③燃烧热 数据类型:①求反应热,②求发生反应的反应物的物 质的量热化学方程式概念:能表明反应所释放或吸收的热量的化学方程式书写①注明各物质的聚集状态②化学计量数可以是整数,也可以是分数③注明温度、压强(25 ℃、101 kPa时可以不注明)④标出ΔH的数值、符号和单位应用:反应热计算的依据返回素养提升 理念渗透研究热化学反应,不仅能从宏观上认识新物质的生成和能量的变化,还要从微观上分析其变化的本质,并能形成能量可以相互转化的变化观念和能量守恒的思想。通过建立相关的思维模型,能正确书写热化学方程式,理解盖斯定律及其应用。认识能源与日常生活、工农业生产及科学技术有着千丝万缕的联系,形成科学合理利用化学反应中能量变化的意识和能源节约的意识。由此可见,通过本章内容的学习,可促进“宏观辨识与微观探析”“变化观念与平衡思想”“证据推理与模型认知”“科学态度与社会责任”等化学核心素养的发展。1.关于下列ΔH的判断正确的是OH-(aq)+H+(aq)===H2O(l) ΔH3OH-(aq)+CH3COOH(aq)===CH3COO-(aq)+H2O(l) ΔH4A.ΔH1<0 ΔH2<0 B.ΔH1<ΔH2C.ΔH3<0 ΔH4>0 D.ΔH3>ΔH41234√解析 将题给四个热化学方程式依次编号为①②③④,反应①可看作Na2CO3溶液和少量稀盐酸反应,为放热反应,ΔH1<0;反应②是 的水解反应,为吸热反应,ΔH2>0,从而推知:ΔH1<ΔH2,A错误、B正确;反应③是中和反应,ΔH3<0,反应④是CH3COOH和强碱的中和反应,ΔH4<0,由于CH3COOH电离要吸收热量,等量的OH-分别发生反应③和④时,反应③放出的热量比④多,则有ΔH3<ΔH4,C、D均错误。12342.已知:SO2(g)+ SO3(g) ΔH=-98 kJ·mol-1。钒催化剂参与反应的能量变化如图所示,V2O5(s)与SO2(g)反应生成VOSO4(s)和V2O4(s)的热化学方程式为:___________________________________________________________。2V2O5(s)+2SO2(g)===2VOSO4(s)+V2O4(s) ΔH=-351 kJ·mol-11234解析 据图写出热化学方程式:①V2O4(s)+2SO3(g)===2VOSO4(s) ΔH1=-399 kJ·mol-1;②V2O4(s)+SO3(g)===V2O5(s)+SO2(g) ΔH2=-24 kJ·mol-1,由①-②×2可得:2V2O5(s)+2SO2(g)===2VOSO4(s)+V2O4(s) ΔH=ΔH1-2ΔH2=(-399 kJ·mol-1)-(-24 kJ·mol-1)×2=-351 kJ·mol-1。12343.探究CH3OH合成反应化学平衡的影响因素,有利于提高CH3OH的产率。以CO2、H2为原料合成CH3OH涉及的主要反应如下:回答下列问题:ΔH3=________ kJ·mol-1。+40.9解析 由盖斯定律可知,Ⅲ式=Ⅰ式-Ⅱ式,即ΔH3=-49.5 kJ·mol-1-(-90.4 kJ·mol-1)=+40.9 kJ·mol-1。12344.100 mL 0.200 mol·L-1 CuSO4溶液与1.95 g锌粉在量热计中充分反应。测得反应前温度为20.1 ℃,反应后最高温度为30.1 ℃。已知:反应前后,溶液的比热容均近似为4.18 J·g-1·℃-1、溶液的密度均近似为1.00 g·cm-3,忽略溶液体积、质量变化和金属吸收的热量。请计算:(1)反应放出的热量Q=__________ J。4.18×103解析 根据题意,Q=cmΔt=4.18 J·g-1·℃-1×100 g×(30.1-20.1) ℃=4.18×103 J。1234(2)反应Zn(s)+CuSO4(aq)===ZnSO4(aq)+Cu(s)的ΔH=______________________________ kJ·mol-1(列式计算)。返回1234本课结束
相关资料
更多









