




人教版 (2019)选择性必修1第一节 化学反应速率授课ppt课件
展开1.掌握外界条件(浓度、压强、温度、催化剂)对化学反应速率的影响规律及实质,并会用相应规律解决有关问题。2.了解活化能的含义,会用活化能理论解释化学反应速率的影响因素。
1. 在通常情况下,Na和Mg与水反应哪个剧烈?2. 将等质量的碳酸钠与碳酸氢钠放入等体积等浓度的盐酸中,产生CO2的速率哪个较快?3. 石油的形成要多少年?炸药的爆炸呢?
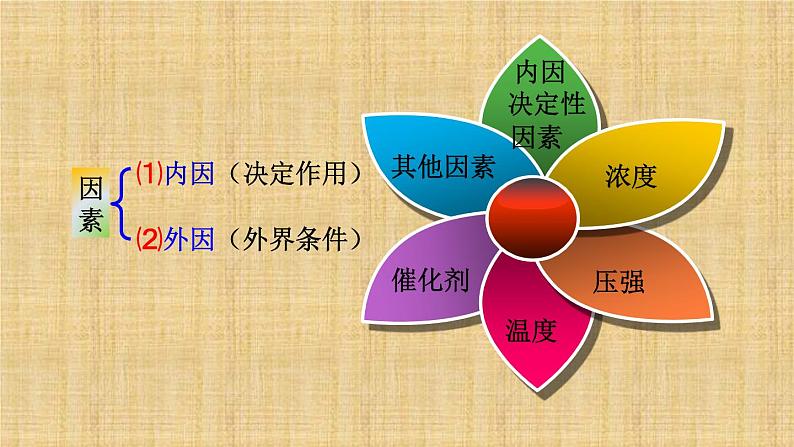
以上说明决定化学反应速率的因素是什么?
决定化学反应速率的主要因素是参加反应的物质本身的结构和性质。
不同的化学反应具有不同的反应速率。
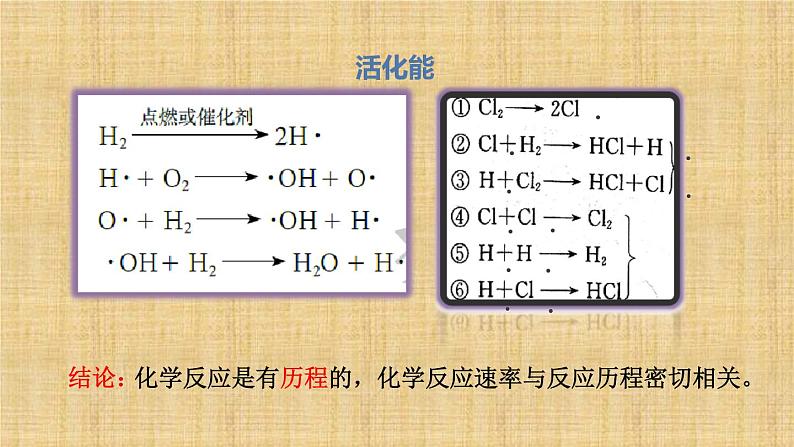
研究表明,大多数化学反应并不是经过简单碰撞就能完成的,而往往经过多个反应步骤才能实现。例如,2HI=H2+I2实际上是经过下列两步反应完成的:2HI H2+2I·2I· I2每一步反应都称为基元反应,这两个先后进行的基元反应反映了2HI==H2+I2的反应历程。反应历程又称反应机理。
化学反应是有历程的,化学反应速率与反应历程密切相关。
基元反应发生的先决条件是反应物的分子必须发生碰撞。以气体的反应为例,任何气体中分子间的碰撞次数都是非常巨大的。通常情况下,当气体的浓度为1 ml/L时,在每立方厘米、每秒内反应物分子间的碰撞次数达到1028次。如果反应物分子间的任何一次碰撞都能发生反应的话,反应只需10-5s就可以完成。但实际并非如此。
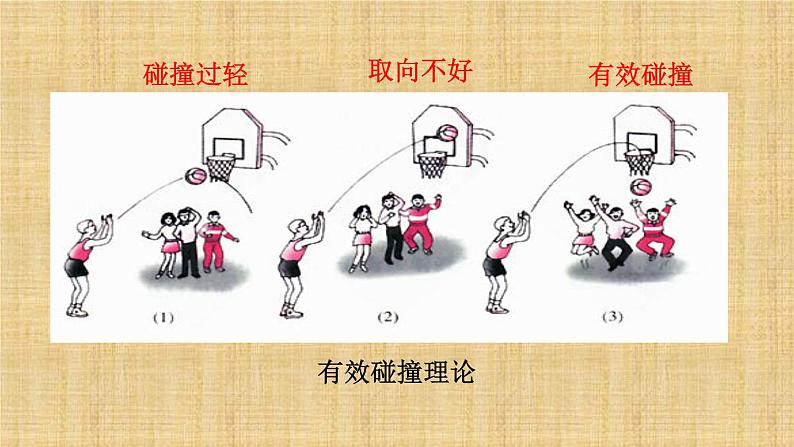
并不是反应物分子的每一次碰撞都能发生反应,我们把能够发生化学反应的碰撞叫做有效碰撞。
普通分子+活化能 活化分子
普通分子变成活化分子所需的能量
生成新物质所释放的能量
活化分子百分数越大,单位体积内 越多,单位时间内 越多,化学反应速率 。
3.化学反应速率与活化分子、有效碰撞的关系:
一、浓度对反应速率的影响
其反应物浓度化学反应速率他条件相同时,增大反应物浓度反应速率增大;减小反应物浓度反应速率减小。
1. 此规律只适用于有气体参加或在溶液中进行的反应,对于固体或纯液体反应物,一般情况下其浓度视为常数,因此改变它们的量不会改变化学反应速率。2. 气体或溶液浓度的改变与反应速率的关系并不是一概如此,若随着浓度的改变,物质的本质发生了变化,那么反应速率的含义也不同了。
例如:铁或铝与硫酸的反应
单位体积内活化分子数增多
单位体积内反应物分子总数增多
二、压强对反应速率的影响
对于气体来说,在一定温度下,一定质量的气体所占的体积与压强成反比。
结论:对于有气体参加的反应来说,增大压强,化学反应速率加快。减小压强,化学反应速率减慢。
压强对化学反应速率的影响实质上是通过改变气体反应物的浓度来实现的。
仅适用于反应体系中有气体物质参加的反应。
如果反应物是固体、液体或溶液时,改变压强对它们有什么影响吗?
恒容条件下,往合成氨的反应N2+3H2 2NH3中充入He气,体系的压强如何改变?反应速率是否改变?
对于压强的改变,只有引起反应体系中物质浓度的变化,才对反应速率产生影响。
对于气体有下列几种情况:
⑴恒温时:增大压强→体积减小→C增大→反应速率增大
⑵恒温时,恒容密闭容器中:
⑶恒压时:充入“无关气体”(如He)→引起体积增大,→各反应物浓度减小→反应速率减慢。
①充入气体反应物→反应物浓度增大→总压增大→反应速率增大;
②充入“无关气体”(如He)→引起总压增大,但各反应物的分压不变,各物质的浓度不变→反应速率不变
N2 + 3H2 2NH3
1. 压强影响,仅适用于反应体系中有气体物质参加的反应,当然并不一定全部是气体参加的反应。
2. 压强对反应速率的影响是通过对浓度的影响实现的。当用不同方法改变反应的压强时,应从本质出发,具体分析。 若气体反应物浓度增大,则反应速率增大。若浓度不变,则反应速率不变;浓度减小,反应速率减小。
三、温度对反应速率的影响
※ 其他条件相同时,升高温度反应速率增大,降低温度反应速率减小。
分子运动速率加快,碰撞频率增加
T↑→普通分子变为活化分子→活%↑
温度>65℃时,I2分子与淀粉的作用大大削弱,溶液呈无色。
KI溶液→淀粉溶液→稀H2SO4
4H+ + 4I- + O2== 2I2 + 2H2O,在不加酸的情况下,O2不能氧化碘离子,所以,要先向KI溶液中滴加淀粉溶液,然后再加入稀硫酸。
2. 温度对反应速率的影响,无论固体、液体、气体都适用。
一般,温度每升高10℃,化学反应速率通常增大到原来的2~4倍。
1. 温度对化学反应速率的影响对放热反应和吸热反应都适用。
四、催化剂对反应速率的影响
※ 其他条件相同时,催化剂通常可以加快化学反应速率。
活化分子百分数增大、N总不变
对于一个化学反应,不同的催化剂,催化作用不同。实验时应选用合适的催化剂。
1. 使用催化剂能改变反应的路径,降低反应所需的活化能,从而改变反应速率,但反应热不变。
2. 使用适当的催化剂能减少过程中的能耗。
催化剂在生产和化学实验上的意义
3. 理想的催化剂还可以大幅度提高目标产物在最终产物中的比率。
4. 催化剂有一定的选择性和活化温度。
5. 催化剂只能催化可能发生的反应,对不发生的反应无作用。
1. 温度越低,化学反应速率越小,低温下食物腐败速率大大降低,不易变质。
2. 固体研细后,固体表面积增加,增大了反应物之间的接触面积,可以加快化学反应速率。
烧火煮饭,先将木柴劈小。
3. 溶液中溶质以分子或离子形式存在,且分布均匀,使反应物分子或离子间直接接触的机会极大地增加,可以大大提高反应速率。
4. 增大反应物的浓度,使反应物之间接触的机会增大,加快化学反应速率。
从上面的实验和事例可以看出:除了浓度、压强、温度、催化剂对化学反应的速率产生影响外,固体颗粒表面积的大小、反应物的状态等也会对化学反应速率产生影响。
在各种外界条件中,温度对反应速率的影响能适应所有的反应。
要想反应快加速,增浓加压升温度;催化增大表面积,反应也可加速度。
温度、固体反应物表面积的大小、反应物的状态、溶液的浓度、催化剂、压强、光照、电磁波、超声波、溶剂的性质、放射性辐照、激光、电弧、强磁场、高速研磨、扩散速率等都可以对化学反应的速率产生影响。
五、其他因素对反应速率的影响
单位体积内分子总数增多,活化分子百分数不变
单位体积内分子总数不变,活化分子百分数增大
练习1:对于在溶液间进行的反应,对反应速率影响最小的因素是( ) A. 温度 B. 浓度 C. 压强 D. 催化剂
练习2:下列条件的变化,是因为降低反应所需的能量而增加单位体积内的反应物活化分子百分数致使反应速率加快的是( ) A. 增大浓度 B. 增大压强 C. 升高温度 D. 使用催化剂
练习3: 设NO+CO2 2CO(正反应吸热)反应速率为v1;N2+3H2 2NH3(正反应放热)反应速率为v2。对于前述反应,当温度升高时,v1和v2变化情况为( ) A. 同时增大 B. 同时减小 C. v1减少,v2增大 D. v1增大,v2减小
练习4:在密闭容器里,通入x ml H2和y ml I2(g),改变下列条件,反应速率将如何改变? (1)升高温度 ;(2)加入催化剂 ;(3)充入更多的H2 ;(4)扩大容器的体积 ;(5)容器容积不变,通入氖气 。
练习5:KClO3和NaHSO3间的反应生成Cl-和H+、SO42-离子的速度与时间关系如图所示,已知反应速率随c(H+)的增加而加快,试说明:(1)为什么反应开始时,反应速率增大? (2)反应后期速率降低的主要原因是什么?
(1)该反应为放热反应,温度升高反应速率增加。
(2)反应物浓度减小,反应速率降低。
增大反应物的浓度使反应速率加快的主要原因( )对于气体参与体系增大压强使反应速率加快的主要原因是( )升高温度使反应速率加快的主要原因是( )使用催化剂使反应速率加快的主要原因是( )A. 活化分子百分数不变,但提高单位体积内活化分子的总数B. 增大分子的运动速率而使有效碰撞增加C. 升高反应物分子的能量,使活化分子的百分数增加D. 降低反应所需的能量,使活化分子百分数增加
人教版 (2019)选择性必修1第一节 化学反应速率优秀课件ppt: 这是一份人教版 (2019)选择性必修1第一节 化学反应速率优秀课件ppt,共24页。PPT课件主要包含了学习目标,内因主要因素,注意以下两种情况,产生气泡速率较慢,产生气泡速率较快,产生气泡速率很慢,△HE-E,活化能,基元反应等内容,欢迎下载使用。
高中化学人教版 (2019)选择性必修1第二章 化学反应速率与化学平衡第一节 化学反应速率精品ppt课件: 这是一份高中化学人教版 (2019)选择性必修1第二章 化学反应速率与化学平衡第一节 化学反应速率精品ppt课件,共21页。PPT课件主要包含了∶1∶2,化学计量数之比,物质的量变化量之比,均取正直等内容,欢迎下载使用。
人教版 (2019)选择性必修1第二章 化学反应速率与化学平衡第一节 化学反应速率课文内容ppt课件: 这是一份人教版 (2019)选择性必修1第二章 化学反应速率与化学平衡第一节 化学反应速率课文内容ppt课件,共30页。PPT课件主要包含了学习目标,情景导学,问题导学,知识回顾,浓度对反应速率的影响,实验探究,实验结论,注意事项,温馨提醒,压强对反应速率的影响等内容,欢迎下载使用。













