


高中化学人教版 (2019)选择性必修1第二节 水的电离和溶液的pH教案配套ppt课件
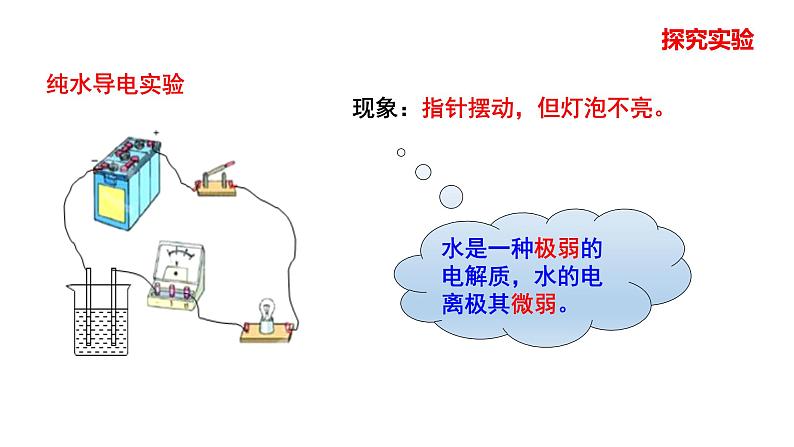
展开现象:指针摆动,但灯泡不亮。
水是一种极弱的电解质,水的电离极其微弱。
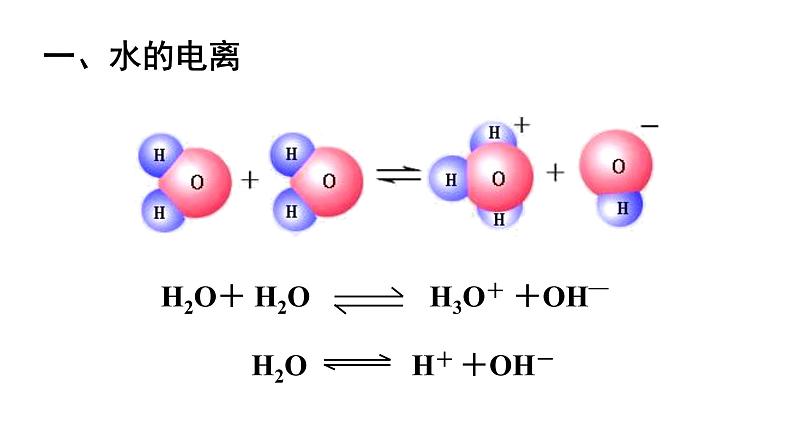
【思考1】在25℃时,1L纯水(即55.6ml)中测得只有1×10-7ml/L的H2O发生电离。分析该水中c(H+)等于多少? c(OH-)等于多少? c(H+)和c(OH-)有什么关系?
不同温度下水的离子积常数
(1)从以上数据中发现什么递变规律? (2)从中能得出什么结论?
■注意:(1)Kw是温度函数,只随温度的升高而增大, 与C(H+) 、 C(OH-) 无关。(2)Kw适用于一定温度下任何稀的电解质溶液, 不管是哪种溶液均有:c(H+)H2O = c (OH―)H2O KW=c (H+)溶液·c (OH―)溶液(3)在任何水溶液中,均存在水的电离平衡,也就是任何水溶液中都是H+、OH-共存的。
3. 影响水的电离因素
Kw=c(H+)·c(OH-)=1×10-14ml/L
实验证明,在稀溶液中:
碱性溶液:c(H+) c(OH-)
中性溶液:c(H+) c(OH-)
酸性溶液:c(H+) c(OH-)
= 1.0×10-7ml/L
c(H+) >1.0×10-7ml/L
c(H+) <1.0×10-7ml/L
二、溶液的酸碱性与PH
2、在酸碱溶液中,水电离出来的C(H+)和C(OH-)是否相等?
1、100℃时,水的离子积为10-12,求C(H+)为多少?溶液呈酸性、碱性还是中性?
化学选择性必修1第二节 水的电离和溶液的pH课前预习课件ppt: 这是一份化学选择性必修1第二节 水的电离和溶液的pH课前预习课件ppt
2021学年第二节 水的电离和溶液的pH示范课课件ppt: 这是一份2021学年第二节 水的电离和溶液的pH示范课课件ppt
高中化学人教版 (2019)选择性必修1第三章 水溶液中的离子反应与平衡第二节 水的电离和溶液的pH备课ppt课件: 这是一份高中化学人教版 (2019)选择性必修1第三章 水溶液中的离子反应与平衡第二节 水的电离和溶液的pH备课ppt课件,共15页。PPT课件主要包含了物质的量,待测定,酸碱中和滴定实验,酸碱中和滴定实验仪器,主要仪器,待测NaOH溶液,盐酸的体积,pH=7,碱过量,酸过量等内容,欢迎下载使用。













