



高中化学人教版 (2019)必修 第一册第二节 离子反应课文ppt课件
展开1.了解电离、电解质、离子反应和离子方程式的含义;2.能从电离角度认识酸、碱、盐。
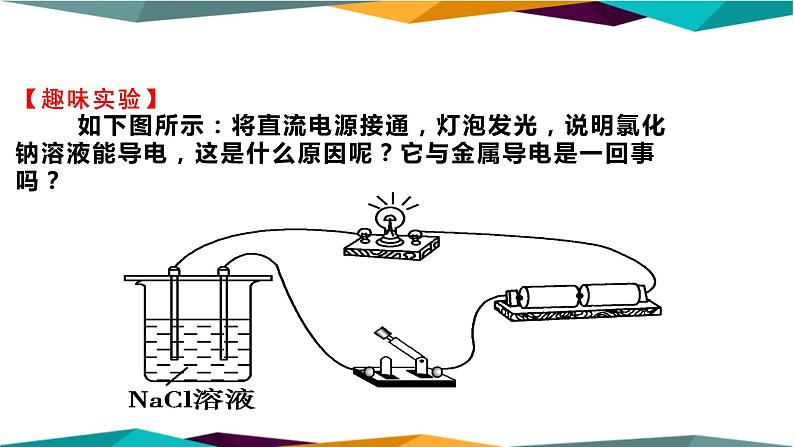
【趣味实验】 如下图所示:将直流电源接通,灯泡发光,说明氯化钠溶液能导电,这是什么原因呢?它与金属导电是一回事吗?
NaCl溶液、KNO3溶液
金属导电:有自由移动的电子。
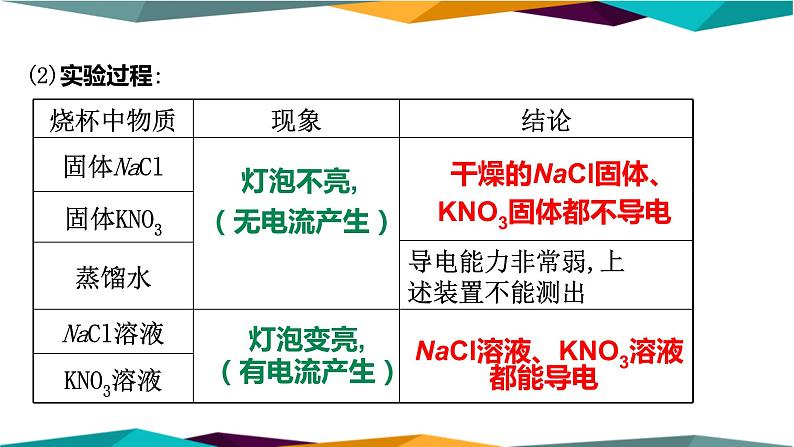
【氯化钠在水溶液里导电】
一 电解质和非电解质 的比较
二、电解质和非电解质的四个“不一定”1.溶于水能导电的化合物不一定是电解质,如SO3。看实质:电解质水溶液导电,其原因是电解质本身在水溶液中电离为自由移动的阴、阳离子。而SO3溶于水所形成的溶液能导电,原因是SO3与H2O反应生成了H2SO4, H2SO4是电解质,是水溶液中电离出了自由移动的阴、阳离子。2.导电的物质不一定是电解质,如Cu和NaCl溶液。看概念:电解质首先属于化合物,化合物又属于纯净物,而Cu是单质,NaCl溶液是混合物。3.电解质不一定易溶于水,易溶于水的化合物不一定是电解质,如BaSO4不溶于水,却是电解质。看概念:电解质是在水溶液中或熔融状态下能够导电的化合物。这里对化合物提出了两个选择性条件,溶于水时能够导电的可以,不溶于水而熔融时能够导电的也可以。4.不是电解质的物质也不一定是非电解质。看概念:在水溶液中和熔融状态下都不能导电的化合物是非电解质。非电解质首先属于化合物。
三、几种“特殊电解质”在水中的电离1.NaHCO3NaHCO3的组成是Na+和HCO3-, HCO3-在水中很难再发生电离,故NaHCO3在水中的电离方程式,应写为NaHCO3== Na++HCO3-不写为NaHCO3== Na++H++CO32-2.NaHSO4NaHSO4的组成是Na+和HSO4-, HSO4-在水中易电离为H+和SO42-,故NaHSO4在水中的电离方程式,应写为NaHSO4== Na++H++SO42-
3.CH3COOH每个CH3COOH有4个H,但CH3COOH是一元酸,在水中电离为H+的H只有OH中的这1个。 CH3COOH在水中的电离是可逆的。综合上述, CH3COOH在水中的电离方程式,应写为CH3COOH CH3COO-+H+4.BaSO4 BaSO4 难溶于水,其意思是溶解度很小,但不是不溶解。 BaSO4 溶于水的部分会全部电离为Ba2+和SO42-,故BaSO4在水中的电离方程式,应写为BaSO4 == Ba2++SO42-。5.H2O在液态水中, H2O与H2O相互作用,使少量H2O可逆性地电离为H+和OH-,故 H2O的电离方程式,应写为H2O H++OH-。6. NH3·H2ONH3·H2O是一种一元碱,但该化学式在形式上与一般的碱不同。 NH3·H2O在水中可逆性地电离为NH4+和OH-,故 NH3·H2O的电离方程式,应写为NH3·H2O NH4++OH- 。
用电离方程式表示电离的过程
书写下列物质的电离方程式:
HClH2SO4NaOHCa(OH)2NaClNa2SO4NH4Cl
= H + + Cl-
= 2H + + SO42-
= Na + + OH-
= Ca2+ + 2OH-
= Na + + Cl-
= 2Na+ + SO42-
电离时生成的阳离子全部是氢离子的化合物。
电离时生成的阴离子全部是氢氧根离子的化合物。
电离时生成金属离子(或铵根离子)和酸根离子的化合物。
= NH4+ + Cl-
酸根离子:除OH-之外的阴离子
书写电离方程式时的注意事项:
1、阴阳离子拆开写,但原子团不能拆, 如:NO3-、SO42-、OH-、NH4+、CO32-等 2、阴、阳离子的个数由化学式决定, 带电荷数由化合价决定。3、强酸的酸式根(HSO4-)要拆开写,而弱酸的酸式根(HCO3-、HSO3-等)不能拆。
酸:强酸:HCl、H2SO4、HNO3 弱酸:H2CO3、CH3COOH 碱:强碱:Ba(OH)2、KOH、Ca(OH)2、NaOH 弱碱:NH3・H2O
高中第2节 电解质的电离 离子反应课文配套课件ppt: 这是一份高中<a href="/hx/tb_c4002542_t3/?tag_id=26" target="_blank">第2节 电解质的电离 离子反应课文配套课件ppt</a>,共35页。PPT课件主要包含了不导电,完全电离,部分电离,强电解质和弱电解质,完成课后相关练习等内容,欢迎下载使用。
人教版 (2019)第二章 海水中的重要元素——钠和氯第二节 氯及其化合物教案配套课件ppt: 这是一份人教版 (2019)第二章 海水中的重要元素——钠和氯第二节 氯及其化合物教案配套课件ppt,共17页。PPT课件主要包含了学习目标,黄绿色,刺激性,浅黄绿,一氯气的物理性质,问题探究一,问题探究二,与非金属反应,苍白色,HCl等内容,欢迎下载使用。
高中化学人教版 (2019)必修 第一册第二节 离子反应图文ppt课件: 这是一份高中化学人教版 (2019)必修 第一册第二节 离子反应图文ppt课件,共32页。













