






高中化学人教版 (2019)选择性必修1第四节 沉淀溶解平衡课文内容ppt课件
展开1.认识难溶电解质在水溶液中存在沉淀溶解平衡。2.了解离子积与Ksp的相对大小跟沉淀溶解平衡的关系。3.了解沉淀的生成、溶解与转化。能结合实例说明pH调控的沉淀生成、溶解与转化等在工农业生产和科学研究中的重要作用。4.能综合运用离子反应和沉淀溶解平衡理论,分析和解决生产、生活中有关沉淀溶解平衡的实际问题
云水洞洞口有赵朴初先生亲笔所题写的"云水洞"三个大字。走进洞来,便见洞内石钟乳,石笋目不暇接。
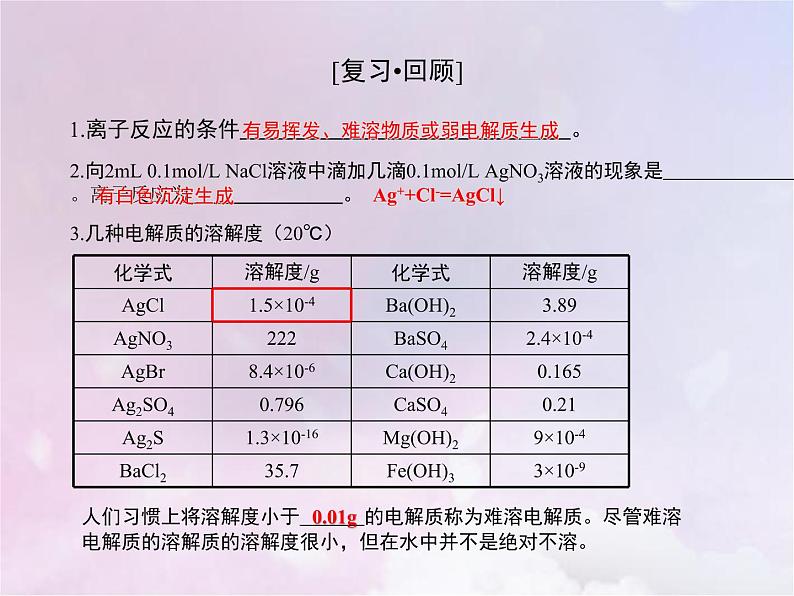
1.离子反应的条件 。
2.向2mL 0.1ml/L NaCl溶液中滴加几滴0.1ml/L AgNO3溶液的现象是 。离子反应为 。
有易挥发、难溶物质或弱电解质生成
Ag++Cl-=AgCl↓
3.几种电解质的溶解度(20℃)
人们习惯上将溶解度小于 的电解质称为难溶电解质。尽管难溶电解质的溶解质的溶解度很小,但在水中并不是绝对不溶。
一、难溶电解质的沉淀溶解平衡
1.沉淀溶解平衡的建立
从固体溶解和沉淀生成的角度,AgCl在溶液中存在两个过程:一方面,在水分子作用下,少量Ag+和Cl-脱离AgCl的表面进入水中—— ;另一方面,溶液中的Ag+和Cl-受AgCl表面阴、阳离子的吸引,回到AgCl的表面析出—— 。
v溶解 v沉淀 ,固体溶解;v溶解 v沉淀 ,溶解平衡;v溶解 v沉淀 ,析出晶体。
在一定温度下,当沉淀溶解和生成的速率 时,即达到了沉淀溶解平衡。
难溶电解质用“s”标明状态,溶液中的离子用“ ”标明状态,并用“ ”连接。
(4)生成难溶电解质的离子反应的限度
①25 ℃时,溶解性与溶解度的关系
②反应完全的标志对于常量的化学反应来说,化学上通常认为残留在溶液中的离子浓度小于 时,沉淀就达完全。
(5)沉淀溶解平衡的影响因素
沉淀溶解平衡属于化学平衡,外界因素对其的影响,同样遵守勒夏特列原理。①内因难溶电解质本身的性质,这是决定因素。②外因温度——绝大多数难溶盐的溶解是吸热过程,升高温度,平衡向 方向移动;少量平衡向生成沉淀的方向移动,如 的沉淀溶解平衡。浓度——加水稀释,平衡向 的方向移动同离子效应——向平衡体系中加入难溶物相应的离子,平衡向 的方向移动其他——向平衡体系中加入可与体系中某些离子反应生成更难溶或更难电离或气体的离子时,平衡向 的方向移动
在一定温度下,沉淀达溶解平衡后的溶液为 溶液,其离子浓度 ,溶液中各离子浓度幂之积为常数,叫做溶度积常数(简称溶度积),用 表示。
Ksp只与难溶电解质的 和 有关。溶液中离子浓度的改变只能使平衡移动,不能改变溶度积。
溶度积的大小反映了难溶电解质在水中的溶解能力。对同类型的难溶电解质,如AgCl、AgBr、AgI,在相同温度下,Ksp(AgCl)>Ksp(AgBr)>Ksp(AgI),则溶解度 。
通过比较溶度积与溶液中有关离子浓度幂的乘积——离子积Qc的相对大小,可以判断难溶电解质在给定条件下沉淀能否生成或溶解:①Qc>Ksp,溶液过饱和,有 析出,直至溶液饱和,达到新的平衡。②Qc=Ksp,溶液饱和,沉淀与溶解处于 。③Qc
二、沉淀溶解平衡的应用
在无机物的制备和提纯、废水处理等领域,常利用生成沉淀来达到分离或除去某些离子的目的。(1)调pH:工业原料氯化铵中含杂质氯化铁,将含杂质的氯化铵溶解于水,再加入 调节pH,可使Fe3+生成 而除去。离子反应方程式为: 。(2)加沉淀剂:在工业废水处理过程中,以Na2S作沉淀剂,使废水中的某些金属离子如Cu2+、Hg2+等,生成极难溶的 、 等沉淀而除去。离子反应方程式: 。
原理:不断减少溶解平衡体系中的相应离子,使平衡向沉淀溶解的方向移动,就达到使沉淀溶解的目的。
例如:CaCO3为什么能溶于稀盐酸?
CO2气体的生成和逸出,使CaCO3溶解平衡体系中的CO32-浓度不断 ,溶液中CO32-与Ca2+的离子积——Q(CaCO3) Ksp(CaCO3),导致平衡向 的方向移动。
Ag2S<AgI<AgCl
结论解释:以AgCl沉淀转化为AgI沉淀为例。
Ksp(AgCl)<Ksp(AgI),即AgI在水中的溶解度远比AgCl的溶解度小,当向AgCl沉淀中滴加KI溶液中,溶液中Ag+和I-的离子积Q(AgI) Ksp(AgI),因此,Ag+和I-结合成AgI沉淀,导致AgCl的沉淀溶解平衡向 的方向移动,直至建立新的沉淀溶解平衡。
Fe(OH)3<Mg(OH)2
白色沉淀转化为红褐色沉淀
☂名师点拨根据Ksp比较物质的溶解度大小时,要注意物质的类型相同且化学式中阴阳离子的个数比相同,溶度积越小,其溶解度也越小。如果不同,则不能直接利用溶度积的大小来比较其溶解性,需转化为溶解度进行比较,否则容易误判。
沉淀转化的实质与规律①实质:沉淀的转化是指由种沉淀转化为另一种沉淀的过程,其实质是沉淀溶解平衡的移动。②规律a.一般来说,溶解度小的沉淀转化为溶解度更小的沉淀容易实现。两者的溶解度差别越大,转化越容易。b.当一种试剂能沉淀溶液中的几种离子时,生成沉淀所需要试剂离子浓度越小的越先沉淀。c.如果生成各种沉淀所需要试剂离子的浓度相差较大,就能分步沉淀,从而达到分离离子的目的。
(1)除锅炉水垢(含有CaSO4):可先用Na2CO3溶液处理,使CaSO4转化为疏松、易溶于酸的CaCO3(CaCO3、CaSO4的Ksp分别为3.4×10-9、4.9×10-5),然后用酸除去。离子反应方程式为: 、 。
(2)自然界中矿物的转化:
离子反应方程式为: 、 。
人教版 (2019)选择性必修1第三章 水溶液中的离子反应与平衡第四节 沉淀溶解平衡备课ppt课件: 这是一份人教版 (2019)选择性必修1第三章 水溶液中的离子反应与平衡第四节 沉淀溶解平衡备课ppt课件,共4页。PPT课件主要包含了第四节沉淀溶解平衡,新课情景呈现,课前素能奠基,溶度积常数,课堂素能探究,7×10-3,2~62,名师博客呈现,课堂达标验收,7×10-7等内容,欢迎下载使用。
高中化学人教版 (2019)选择性必修1第四节 沉淀溶解平衡说课课件ppt: 这是一份高中化学人教版 (2019)选择性必修1第四节 沉淀溶解平衡说课课件ppt,共46页。PPT课件主要包含了课前·基础认知,课堂·重难突破,随堂训练,典例剖析等内容,欢迎下载使用。
高中第四节 沉淀溶解平衡图文ppt课件: 这是一份高中第四节 沉淀溶解平衡图文ppt课件,共48页。PPT课件主要包含了新课情境呈现,课前素能奠基,沉淀溶解,无明显现象,固体逐渐溶解,白色沉淀,黄色沉淀,黑色沉淀,红褐色沉淀,沉淀溶解平衡的移动等内容,欢迎下载使用。













