





高中化学人教版 (2019)必修 第一册第一节 钠及其化合物教课ppt课件
展开1.通过实验探究,了解钠、氧化钠、过氧化钠、碳酸钠、碳酸氢钠等物质的性质,建构物质间的转化关系,初步认识元素化合物的学习思路,培养变化观念和证据推理与模型认知的化学核心素养。2.通过实验探究和真实事例,了解钠及其化合物在生产、生活中的应用,提高实验方案设计能力和知识应用能力,培养科学探究与创新意识的学科核心素养。
3.学会焰色试验的基本操作,了解金属的焰色在物质鉴别和生活中的应用。
2.钠的化学性质。(1)钠的原子结构。
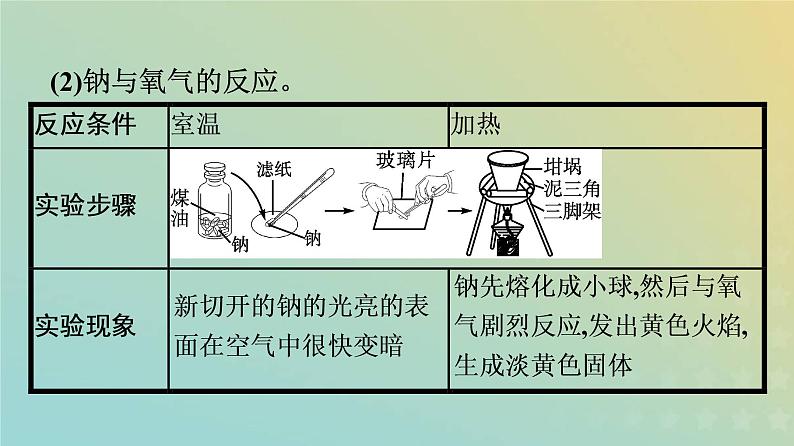
(2)钠与氧气的反应。
微判断1(1)常温下,钠与氧气反应生成淡黄色固体。( )(2)钠与氧气反应时,条件不同,产物也不同。( )(3)钠元素在自然界中都以化合物的形式存在。( )(4)单质钠在氧化还原反应中既可做还原剂,又可做氧化剂。( )(5)常温下,钠与过量氧气反应生成Na2O2。( )
(3)钠与水的反应。从物质组成和氧化还原反应的角度,预测钠与水反应的产物应为 氢气 和 氢氧化钠 。
3.钠的保存。实验室里金属钠要保存在 石蜡油 或煤油中,隔绝空气和水。
微判断2(1)金属与水反应时,都生成氢氧化物和氢气。( )(2)钠与酸反应比与水反应剧烈。( )(3)钠着火后,能用水灭火。( )(4)钠与水反应的离子方程式为Na+2H2O══Na++OH-+H2↑。( )(5)用流程图示的方法可以清楚反映物质之间的转化关系。如Na→乙→NaOH→NaCl,则在常温下,上述转化关系内的物质乙是Na2O。( )
钠的性质重难归纳1.钠与氧气反应的有关判断。(1)反应产物的判断。钠与氧气的反应产物只受反应条件的影响,不受氧气量的影响。即钠不论是与少量氧气反应还是与过量氧气反应,在常温下均生成氧化钠,在点燃或加热条件下则生成过氧化钠。
(2)转移电子数目的判断。钠元素化合价:0价→+1价。
(3)金属钠长期露置于空气中最终完全转变为Na2CO3粉末,此过程中的主要变化与现象有:
发生的主要变化的化学方程式为:①4Na+O2══2Na2O②Na2O+H2O══2NaOH④2NaOH+CO2══Na2CO3+H2O,Na2CO3+xH2O══Na2CO3·xH2O⑤Na2CO3·xH2O══Na2CO3+xH2O
2.钠与酸、盐的水溶液反应的规律。(1)钠与酸溶液的反应。
(2)钠与碱溶液反应时,其实质就是钠与水的反应。(3)钠与盐溶液的反应:
钠与硫酸铜溶液反应的总化学方程式为2Na+2H2O+CuSO4 ══Cu(OH)2↓+H2↑+Na2SO4。
(1)向一只小烧杯中加入等体积的水和煤油,片刻后再向该烧杯中轻缓地加入一绿豆大小的金属钠,可能观察到什么现象?并解释原因。(2)钠可与TiCl4反应制备金属钛(Ti),反应条件是怎样的?写出反应的化学方程式。
提示:(1)可观察到Na在水与煤油的界面处上下跳动,原因是Na的密度比煤油的大,但比水的小,并且Na与H2O反应能产生H2,有气泡产生。(2)TiCl4应在熔融状态下与钠反应,不能是水溶液。反应的化学方程式为4Na+TiCl4(熔融) Ti+4NaCl。
典例剖析下列关于钠的叙述正确的是( )。A.钠单质与氯化亚铁溶液反应生成氯化钠和铁单质B.钠与水反应的现象说明钠的熔点低,且与水反应放出热量C.钠与酸溶液反应产生氢气,实质是钠与H2O反应D.将4.6 g金属钠投入95.4 g水中,所得溶液中溶质的质量分数为8%
答案:B解析:钠单质与氯化亚铁溶液反应时,钠先与水反应生成氢氧化钠,然后氢氧化钠与氯化亚铁反应生成氢氧化亚铁,不能置换出铁,A项错误。钠与水反应放出大量热,由于钠的熔点低,所以钠会熔化为小球,B项正确。 钠与酸溶液反应的实质是钠与H+反应,C项错误。4.6 g金属钠投入95.4 g水中,生成氢氧化钠的质量为8 g,但反应放出氢气,所得溶液的质量小于100 g,所以溶质的质量分数大于8%,D项错误。
学以致用1.关于钠的叙述中,正确的是( )。A.钠是银白色金属,硬度很大B.将金属钠放在坩埚中用酒精灯加热后,金属钠剧烈燃烧,发出黄色火焰,生成过氧化钠C.金属钠在空气中燃烧,生成氧化钠D.金属钠的熔点很高
答案:B解析:钠是具有银白色金属光泽的固体,硬度小,密度也小,熔点很低,分析各选项,只有B项正确。
2.如图所示,在烧杯中加入水和苯(苯的密度为0.88 g·cm-3,与水互不相溶,且不与钠反应)各50 mL,将一小粒金属钠(密度为0.97 g·cm-3)投入烧杯中,观察到的现象为( )。A.钠在水层中反应并四处游动B.钠停留在苯层中不发生反应C.钠在苯的液面上反应并四处游动D.钠在苯与水的界面处反应并不断上浮、下沉
答案:D解析:苯不溶于水,密度比水小,在上层,钠不溶于苯,Na的密度比水的小、比苯的大,在苯和水的界面处,钠与水反应产生气体,使钠上浮,气体脱离后钠又下沉到苯和水的界面处,反复进行,直到Na完全消失。
A.银白色变暗是因为生成了过氧化钠B.出现液滴是因为NaOH易潮解C.过程④只发生了物理变化D.最后得到的白色固体是NaOH
答案:B解析:银白色变暗是因为生成了氧化钠,过氧化钠呈淡黄色,A项错误。过程②生成的是NaOH,NaOH固体易潮解,在空气中潮解形成NaOH溶液,B项正确。过程④中碳酸钠晶体(Na2CO3·xH2O)在干燥的空气中放置逐渐失去结晶水是化学变化,过程④既有物理变化,又有化学变化,C项错误。过程④中最后得到的白色固体是Na2CO3,D项错误。
1.下列关于钠的说法不正确的是( )。A.金属钠与氧气反应,条件不同,产物不同B.钠长期露置于空气中,表面不能形成致密氧化膜C.金属钠着火,不能用水灭火,应用干燥的沙土进行灭火D.由于钠比较活泼,所以它能从溶液中置换出金属活动性顺序中钠后面的金属答案:D解析:钠不能从盐溶液中置换出金属单质。
2.钠与水反应的实验过程如图①、②、③所示,下列有关说法不正确的是( )。A.图②中钠熔成小球,说明钠与水反应放热且钠的熔点低B.图②中钠四处游动并“嘶嘶”作响,说明反应产生了气体C.图③中滴加酚酞溶液后溶液变红,说明有碱性物质生成D.钠与水反应的离子方程式是2Na+2H+══2Na++H2↑
答案:D解析:水是氧化物,也是难电离物质,不能拆写,应写成2Na+2H2O══2Na++2OH-+H2↑,D项错误。
3.金属钠与下列溶液反应时,既有气体产生又有白色沉淀产生的是( )。A.MgCl2溶液B.KCl溶液C.Na2SO4溶液D.CuSO4溶液
答案:A解析:钠首先与水反应生成氢氧化钠和氢气,然后看生成的氢氧化钠能否与盐反应。A项中,氢氧化钠与氯化镁反应可生成氢氧化镁白色沉淀,A项符合题意;B项中,氢氧化钠与氯化钾不反应,没有沉淀生成,B项不符合题意;C项中,氢氧化钠与硫酸钠不反应,没有沉淀生成,C项不符合题意;D项中,氢氧化钠与硫酸铜反应生成不溶性的氢氧化铜蓝色沉淀,D项不符合题意。
4.钛和钛的合金大量用于航空工业,有“空间金属”之称;钛还可以用来制造潜艇——钛潜艇,由于钛非常结实,能承受很高的压力,这种潜艇可以在深达4 500米的深海中航行。金属钛可由反应TiCl4+4Na══4NaCl+Ti制得。对于该反应,下列说法正确的是( )。A.该反应说明钠是强还原剂,可用于冶炼金属B.该反应条件是TiCl4在熔融状态或水溶液中C.Ti是氧化剂D.TiCl4是还原剂
答案:A解析:由TiCl4+4Na══4NaCl+Ti知,钠是强还原剂,可用于冶炼金属,A项正确。钠性质非常活泼,能将熔融状态的TiCl4还原为Ti,但不能在水溶液中进行,B项错误。该反应中,钛元素化合价降低,TiCl4是氧化剂,C、D项错误。
5.在实验室里为了研究钠的性质,做了如下实验:(1)取用浸没在煤油中的金属钠的操作方法是 。 (2)取一块金属钠放在燃烧匙里加热,观察到下列实验现象:①金属钠先熔化;②在空气中燃烧,放出黄色火花;③燃烧后得到白色固体;④燃烧时火焰为黄色;⑤燃烧后生成淡黄色固体。其中描述正确的是 。 A.①②⑤B.①②③C.②③④D.①④⑤
高中化学人教版 (2019)必修 第一册第一节 钠及其化合物课文课件ppt: 这是一份高中化学人教版 (2019)必修 第一册第一节 钠及其化合物课文课件ppt,共32页。
人教版 (2019)必修 第一册第二章 海水中的重要元素——钠和氯第一节 钠及其化合物教课内容ppt课件: 这是一份人教版 (2019)必修 第一册第二章 海水中的重要元素——钠和氯第一节 钠及其化合物教课内容ppt课件,共32页。
化学必修 第一册第一节 钠及其化合物课文配套ppt课件: 这是一份化学必修 第一册第一节 钠及其化合物课文配套ppt课件,共25页。PPT课件主要包含了分点突破,钠的性质等内容,欢迎下载使用。













