



浙教版九年级上册第6节 几种重要的盐备课ppt课件
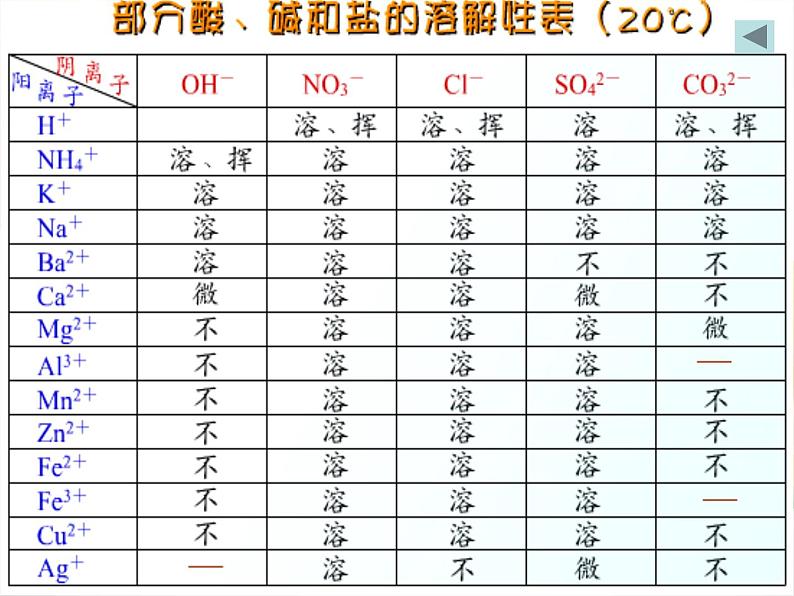
展开(1).根据盐的溶解性的不同可将盐分为_________盐和_______盐。
(2).常见盐的溶解性表:
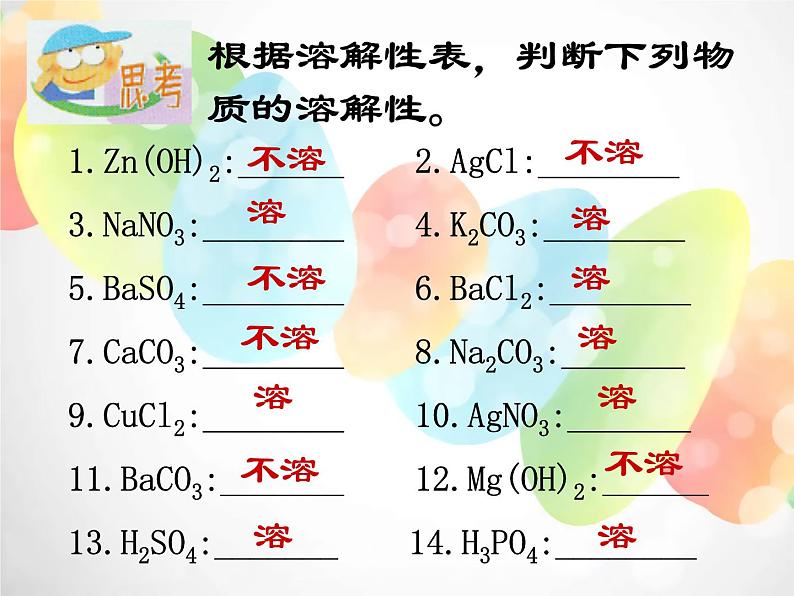
根据溶解性表,判断下列物质的溶解性。
1.Zn(OH)2:______ 2.AgCl:________3.NaNO3:________ 4.K2CO3:________5.BaSO4:________ 6.BaCl2:________7.CaCO3:________ 8.Na2CO3:_______9.CuCl2:________ 10.AgNO3:_______11.BaCO3:_______ 12.Mg(OH)2:______13.H2SO4:_______ 14.H3PO4:________
讨论:参照酸和碱性质的推断方法,推测盐的性质
(1)酸+盐=新盐+新酸
条件:除碳酸盐外,盐要可溶,生成物中有沉淀或气体
(2)碱+盐=新碱+新盐
条件:盐和碱都要可溶,生成物中有沉淀
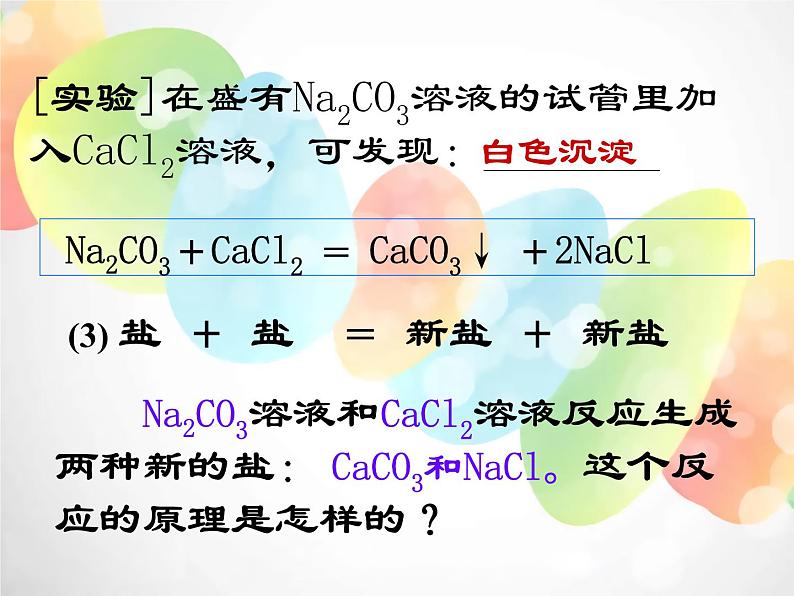
[实验]在盛有Na2CO3溶液的试管里加入CaCl2溶液,可发现:________
Na2CO3+CaCl2 = CaCO3↓ +2NaCl
Na2CO3溶液和CaCl2溶液反应生成两种新的盐: CaCO3和NaCl。这个反应的原理是怎样的?
(3) 盐 + 盐 = 新盐 + 新盐
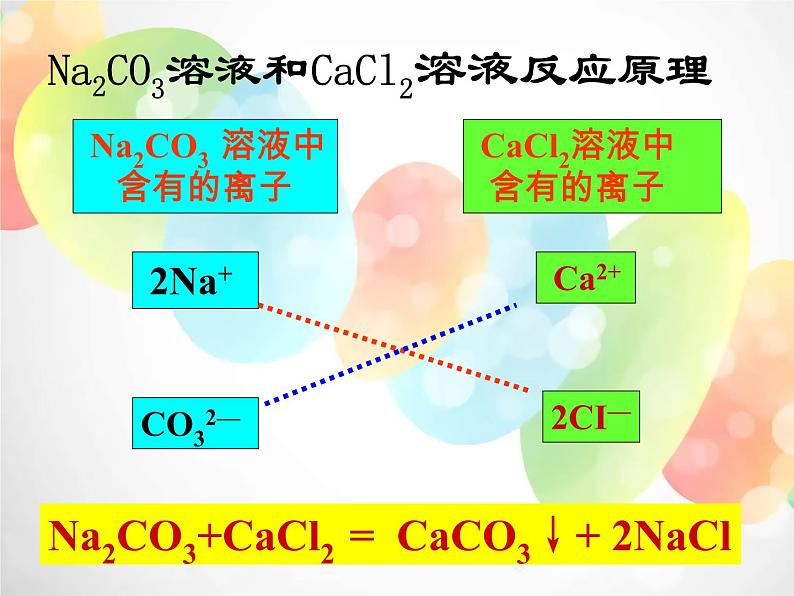
Na2CO3溶液和CaCl2溶液反应原理
Na2CO3 溶液中 含有的离子
CaCl2溶液中 含有的离子
Na2CO3+CaCl2 = CaCO3↓+ 2NaCl
你能找出这个反应类型有什么特点?
这种反应类型的特点是:两种化合物互相交换成分生成新的化合物。
(2) 定义:由于化合物互相交换成分生成新化合物的反应叫复分解反应。
这种反应类型叫复分解反应。
(3)复分解反应的条件:
生成物中有沉淀或气体或水。
2NaOH + H2SO4 = Na2SO4 + 2H2O
Na2CO3+Ca(OH)2 = CaCO3↓ +2NaOH
2HCl + CaCO3 = CaCl2 + H2O + CO2↑
下列4个反应是复分解反应吗?看看它们的生成物有什么规律?
NaOH+BaCl2= Ba(OH)2+NaCl
下列物质能发生化学反应吗?为什么?
1、CuO+Ba(OH)2= Cu(OH)2 ↓ +BaO 2、SO2+HNO3=NO2 + H2SO33、2Fe(OH)3+3MgCl2=2FeCl3+3Mg (OH)2 ↓4、Na2CO3+CaCl2 = CaCO3 ↓ +2NaCl
上述物质能发生化学反应的是: ___________________________
因为---1:碱不能与金属氧化物反应。2:酸不能与非金属氧化物反应。3:Fe(OH)3难溶
5、Na2CO3+2HCl= 2Na Cl +H2O+ CO2↑6、 Ba(OH)2+H2SO4= BaSO4 ↓ +2H2 O7、NaOH+BaCl2= Ba(OH)2+NaCl8、2NaCl+Cu(NO 3) 2= 2Na NO3+CuCl2
上述物质能发生化学反应的是: ____________________________
因为---7和8:不符合复分解反应的条件。
根据酸的共性和碱的共性,以及盐的有关性质,你知道可以用哪些方法制取盐?
(1)有些盐是天然存在的。如:食盐、纯碱等,但有些是用化学方法制取。
1、酸+金属=盐+氢气
7、盐+盐=新盐+新盐
8、金属+盐=新金属+新盐(下节学习)
6、碱+酸性氧化物=盐+水
5、碱+盐=新碱+新盐
4、酸+盐=新酸+新盐
2、酸+金属氧化物=盐+水
化学肥料是用矿物质、空气、水等作原料,经过化学加工精制而成的肥料。
氮肥:化肥主要含有氮元素的称氮肥。
磷肥:化肥主要含有磷元素的称磷肥。
钾肥:化肥主要含有钾元素的称钾肥。
复合肥:化肥中含有两种或两种以上 主要营养元素的称复合肥。
以上物质分别属于哪一类化肥?用线条连接。
能促使农作物的茎叶生长茂盛,含有组成叶绿素的重要元素
(2)氮肥(铵盐)的制取:
NH3+H2O+CO2=NH4HCO3(碳铵)
2NH3+H2SO4=(NH4)2SO4(硫铵)
因此:盐的组成中,所含的阳离子不一定都是金属阳离子,也可以是复杂阳离子(带电原子团)
实验1、向硫酸铵浓溶液中滴加氢氧化钠溶液,发生了什么变化?写出化学方程式。
(NH4)2SO4+2NaOH= Na2SO4+2H2O+2NH3↑
产生一种刺激性气味的气体
实验2、把湿润的红色石蕊试纸放在试管口,试纸颜色是否发生变化?
使湿润的红色石蕊试纸变蓝
产生氨气,氨气溶于水是碱性的。
铵盐能与碱反应,生成氨气
加NaOH等碱溶液。如果产生使湿润的红色石蕊试纸变蓝的气体,则含有NH4+
因此,使用铵盐作肥料时,不能跟熟石灰等碱混施。
(NH4)2SO4+2NaOH= Na2SO4+2H2O+2NH3↑
NH4HCO3+Ca(OH)2 = CaCO3↓+2H2O+NH3↑
比较下列两个反应,你能否说出能检验铵根离子的试剂?
在农村,人们常取少量白色粉末状的化肥和消石灰一起放在手掌心搓,通过闻气味来检验是否是氮肥,这是根据什么原理?
铵盐与碱(强碱)混合加热,都会产生有刺激性气味的氨气放出。
(4) 氮肥的种类:除铵盐外还有
最常用的氮肥:是含氮有机物即人的尿液
化 肥:尿素 CO(NH2)2
促进农作物要根系发达,增强吸收养份和抗寒抗旱能力,促进作物穗数增多,籽粒饱满等。
过磷酸钙:------- CaSO4和Ca (H2PO4)2的混合物
科学九年级上册第6节 几种重要的盐课文内容ppt课件: 这是一份科学九年级上册第6节 几种重要的盐课文内容ppt课件,共39页。PPT课件主要包含了盐的概念,美丽的盐晶体,KCrO4,橄榄石,绿柱石,重铬酸钾,碳酸钠,几种盐的性质,易风化,风化属化学变化等内容,欢迎下载使用。
初中科学浙教版九年级上册第6节 几种重要的盐优秀课件ppt: 这是一份初中科学浙教版九年级上册第6节 几种重要的盐优秀课件ppt,共17页。PPT课件主要包含了碳酸钙,CaCO3,CaOH2,H2CO3,H2O,性质与存在,1与酸反应,HCl,CaCl2,CO2等内容,欢迎下载使用。
初中科学浙教版九年级上册第6节 几种重要的盐教课内容ppt课件: 这是一份初中科学浙教版九年级上册第6节 几种重要的盐教课内容ppt课件,共10页。PPT课件主要包含了制取盐的途径,酸+碱盐+水,NH42SO4,NH4HCO3,NaNO3,NH4Cl,CaH2PO42,K3PO4,K2SO4,KCl等内容,欢迎下载使用。













