



沪教版 (上海)九年级第一学期第三单元 走进溶液世界3.2 溶液集体备课课件ppt
展开喝过纯净水吗?啥味道?
结论:生活中的液体多数是混合 物、不是纯净物。
下面我们再现两个生活中的实验。
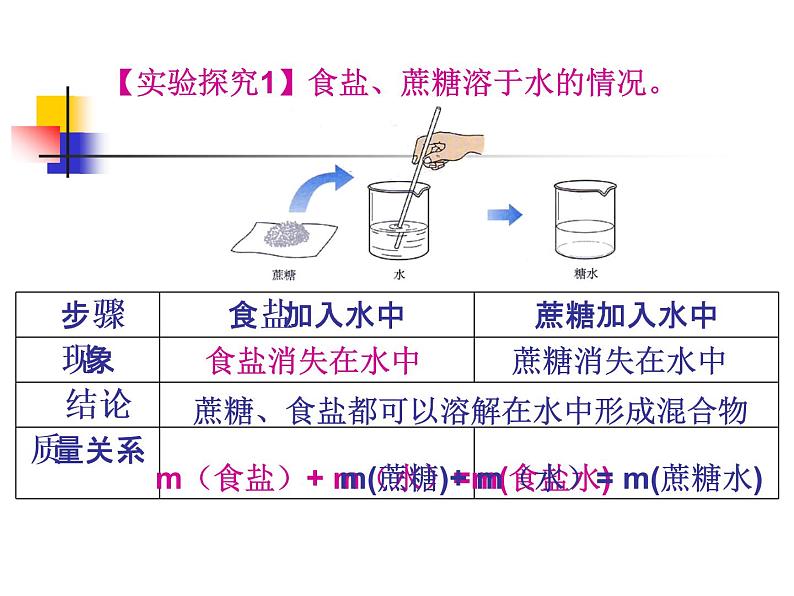
【实验探究1】食盐、蔗糖溶于水的情况。
蔗糖、食盐都可以溶解在水中形成混合物
m(食盐)+ m(水)=m(食盐水)
m(蔗糖)+ m(水)= m(蔗糖水)
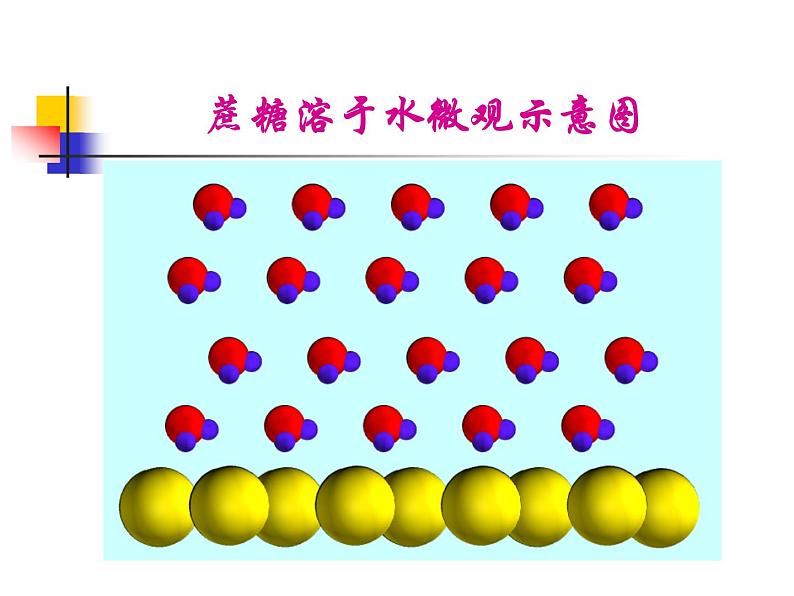
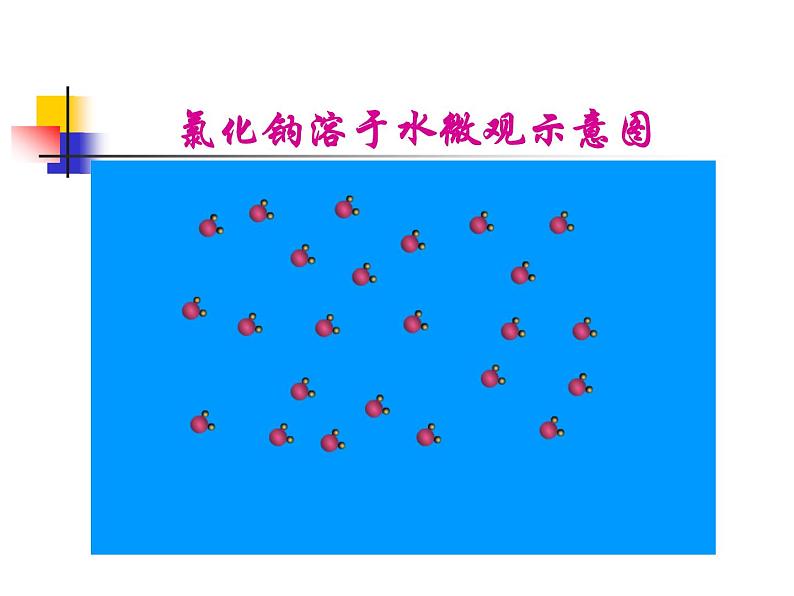
氯化钠溶于水微观示意图
思考:我们得到的液体都是混合物。每种液体各部 分的性质都一样;只要条件不改变,无论放 置多长时间,每种液体都没有沉淀析出。
如此,你能给溶液一个定义?
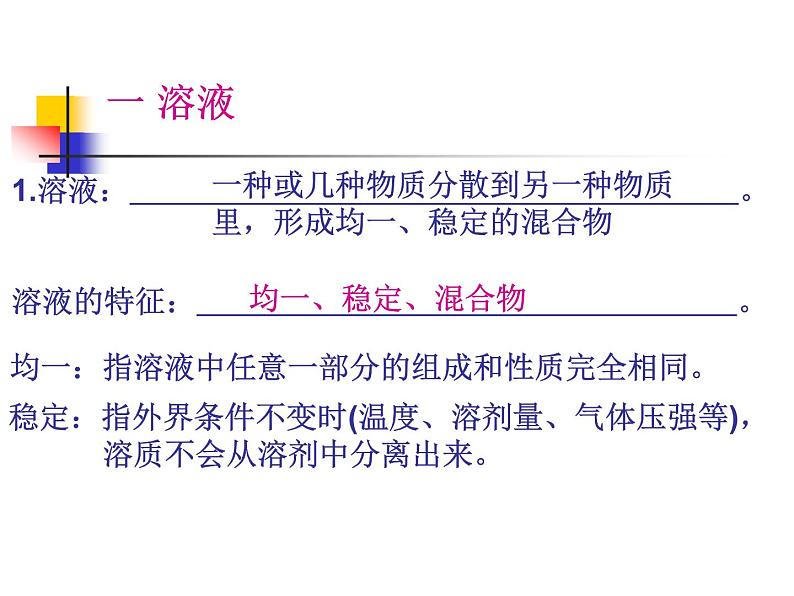
一 溶液1.溶液: 。溶液的特征: 。
一种或几种物质分散到另一种物质里,形成均一、稳定的混合物
稳定:指外界条件不变时(温度、溶剂量、气体压强等), 溶质不会从溶剂中分离出来。
均一:指溶液中任意一部分的组成和性质完全相同。
2.溶质: 。如食盐、蔗糖等。3.溶剂: 。如水(水是较 好的溶剂,许多物质能溶解在其中)。溶质、溶剂、溶液三者之间的质量关系:
m(溶质)+ m(溶剂)= m(溶液)
【讨论】指出下列溶液中的溶质和溶剂
思考:我们都有这样的生活经验:衣服上沾上油滴时,用 水很难洗去,解决的方法有以下三种:可以用肥皂 水洗;可以用洗衣粉洗;可以用汽油洗。用谁洗效 果更好呢?
1 2 3 4
结论:碘难溶于水,易溶于汽油;高锰酸钾易溶于水,难溶于汽油;这说明: . 。
同种溶质在不同溶剂中的溶解能力不同,不同种溶质在同种溶剂里的溶解能力也不同
思考:看来衣服上的油滴用汽油洗效果 更好;因为油在水中溶解能力弱、 在汽油中溶解能力强。前边我们 谈到的溶质大部分是固体,那么 溶质还能否是别的状态呢?
二 、溶质与溶剂的辩证关系 【 实验探究3】乙醇溶于水。【实验步骤】取少量高锰酸钾溶液于试管中,滴入少量乙 醇,观察现象。
震荡前分层说明乙醇密度小于水,最后不分层说明乙醇能溶解在水中形成溶液。
1.液—液互溶时, 。2.通常:有水时, 。
量多者为溶剂,量少者为溶质
3. 溶质可以为: 。 同学们能否举出溶质是气体的例子?如-------。【溶液的用途】1.动物体内氧气和二氧化碳都是溶解在血液中进行循环的2.医疗上葡萄糖和生理盐水、各种注射液都是按一定要求 配成溶液使用的。3.现在农业上的无土栽培技术就是利用溶液代替土壤,提 供植物所需养料。4.许多化学反应在溶液中进行,可以加快反应速率。
【思考】我们已经知道:汽油可以把衣服上的油脂 洗去,是汽油可以溶解油脂。那肥皂水、洗 涤剂也可以洗去油污,道理何在?【实验探究4】油脂怎样溶解在含有洗涤剂的水中
乳浊液: 。
小液滴分散到液体里形成的混合物
【结论】1.人们把能使 . 叫 。这种现象叫做乳化现象。确切地说是类似 于形成“水合分子”。乳化是乳化剂把大的液滴分散成无 数细小的液滴-----使大集团化解为“个体户”。2.汽油去油污是油污溶解在汽油中,洗涤剂去油污是乳化 现象。两者效果相同但原理不同。
两种互不相溶的液体形成稳定乳浊液的物质 乳化剂
三、溶解时的吸热和放热 【活动与探究】NH4NO3 、NaCl 、NaOH分别溶于 水时,用温度计测量温度的变化。实验步骤:1.将温度计插入水中插入盛水的烧杯中,观察 并记录水的温度; 2.向烧杯中分别加入NaCl 、NH4NO3、NaOH 用玻璃棒迅速搅拌,读出温度计的刻度并记 录。
实验结论: NaCl溶于水没有明显的吸热或放热象; NH4NO3 溶于水时吸热; NaOH 溶于水时放热。
实验分析:溶质溶于水形成溶液时溶液温度变化的实质: 在溶解过程中发生了两种变化,一种是在水的 作用下,溶质的分子或离子被拆开,向水中扩 散,这一过程吸收热量;另一种是溶质的分子或离子和水分子作用,结合成水合分子或水合离子,这一过程放出热量。 综上所述,我们可以得出这样的结论:①扩散过程吸收热量 > 水合过程放出热量,溶液温度 . ②扩散过程吸收热量 < 水合过程放出热量,溶液温度 . ③扩散过程吸收热量=水合过程放出热量,溶液温度 .
思考:如果没有温度计,我们也可以设计装置探究溶质 溶解时的吸热、放热现象;只是不太准确而已。这 种方法叫做定性分析。请看下面定性分析实验方案:
【课堂练习】 1.下列说法正确的是( ) A. 碘酒中的溶剂是水 B. 把食用油放入水里,并用力振荡,食用油是溶质C.高锰酸钾放入水中,形成紫色溶液D. 将少量氯化钠放入水中溶解,溶质是氯化钠2.各种洗涤剂广泛进入人们的生活中,下列洗涤中所用 洗涤剂具有乳化功能的是( )A. 用汽油除去衣服上的油污 B. 用餐具洗洁精洗餐具上的油污C. 用水洗去盘子中的水果渣 D. 用醋洗去水壶的水垢3.“凡是均一的、稳定的液体都是溶液”。这种说法是否 正确?
4.根据生活常识判断,下列物质与水作用能放出大 量热的是( ) A.白糖 B.味精 C.生石灰 D.洗衣粉【基础训练】1.把下列物质分别放到水中,充分搅拌, 可以得到溶液的是( ) A.面粉 B.氯化钠 C.汽油 D.蔗糖2.可以作为溶质的是( ) A.只有固体 B.只有液体 C.只有气体 D.气体、液体、固体都可以3.试列举生活中常见的一些溶液,说出其中的溶质和溶 剂。开放题。
4.试从微观的角度说明溶质在溶液中是 怎样存在的由此说明为什么在溶液中 进行的化学反应比较快举例说明这一 道理在实验室或化工生产中的应用
溶质在溶液中以分子或离子的形式均一地分散在溶剂分子中间。两种或多种溶液混合在一起时,发生反应的分子或离子直接接触,因此反应比较快。常常把反应物配成溶液 ,当溶液混合时,就立即发生化学反应。
答:蛋白质、脂肪、固形物等,有的还加入维A维D或增 加Ca剂。 答:原理不同。汽油溶解油污时形成溶液;洗涤剂洗油 污是把油污分散成细小的液滴形成乳浊液,随水流去
4.牛奶是一种混合物,查阅包装盒或包装袋,记录其中所 含的成分。5.用汽油或加了洗涤剂的水都能除去衣服上的油污。试分 析二者的原理是否相同。
(1)装置A产生的现象是 ,原因是 . . 。(2)装置B产生的现象是 .. ,原因是 .
1.某班化学兴趣小组设计了如下图所示实验装置, 用来研究物质溶于水后温度的变化。试猜想:
木板掉落、烧杯外壁发烫
玻璃片与烧杯固定在一起、烧杯外冰凉
石蜡融化 NaOH溶于 水放热
木板上水结冰,木板与烧杯连结一起 NH4NO3 溶于水吸热,使溶液温度下降
【能力提高与历史回顾】
3.某一杯长期放置的食盐水,若上部的密度为a g/cm3, 则下部的密度为( )A、大于a g/cm3 B、等于a g/cm3 C、小于a g/cm3 D、无法判断
2.下列液体属于溶液的是___________。(填序号) ①啤酒 ②水 ③泥水 ④澄清石灰水 ⑤盐酸
下列清洗方法中,利用乳化作用的是( ) A.用自来水洗手 B.用汽油清洗油污 C.用清洗剂洗油腻的餐具 D.用盐酸清除铁锈
课题二 溶解度 第一课时 饱和溶液 上节课我们学习了溶液的形成。是不是一定量的溶剂里可以无限的溶解溶质呢?溶质溶解在溶剂里,还受那些因素的影响?下面我们就以氯化钠和硝酸钾为例进行探究
一定量的溶剂里,只能溶解一定量的溶质
思考:一定量的溶剂里,只能溶解一定量的溶质。NaCl 不能无限地溶解在一定量的水中。固体溶解在水中 还受那些因素的影响?【实验探究2】把上述实验中的氯化钠换成脚酸钾再进行 上述实验。
剩余KNO3 全部溶解
温度可以影响KNO3 的溶解能力
综上所述:物质的溶解能力除受溶剂量的多少的影响; 还受温度的影响。
因此,在讨论饱和溶液和不饱和溶液时,一定要指明“溶剂的量”是多少,在什么“温度下”,才是正确的;缺这两个量中的任何一个量,讨论溶液的饱和与不饱和都是错误的.如20℃时,100g水中溶解了31.6g硝酸钾达到饱和,若升高温度或增大溶剂的量,原来饱和溶液就变成不饱和溶液了。所以“一定温度”和“一定量的溶剂”影响我们对物质的溶解能力的认识。
饱和溶液:一定温度下,一定量的溶剂里不能溶 解溶质的溶液。
不饱和溶液:一定温度下,一定量的溶剂里还能溶 解溶 质的溶液。
这样看来:饱和溶液与不饱和溶液在一定条件下 是可以互相转化的。如:
我们已经知道:溶质溶解在溶剂里受温度、溶剂的量的多 少的影响。如何定量地描述溶质在溶剂里的溶解能力,就需要定一个标准,这个标准的要求必须是在 、 、 才可以。
增加溶质或降低温度或蒸发溶剂
同样的温度 相同量的溶剂 达到饱和
一.溶解度:在 ,某物质在 溶剂(水) 里 时所溶解的质量(单位是g)。
在20℃时, 100g水中溶解36gNaCl恰好形成饱和溶液。
如 “在20℃时,NaCl 的溶解度是36g”其含义是:
进一步分析,还可以获取的信息:溶剂的量为100g,溶质的质量为36g,形成饱和溶液136g,质量分数通过计算得到。
标准:100g溶剂;(人为规定)
通过你对定义的理解,判断下列说法是否正确:
20克 A 物质溶解在100克水里恰好制成饱和溶液, A的溶解度是20克。
(2) 20℃时,10克氯化钠溶解在水里制成饱和溶液,故20℃ 时氯化钠的溶解度是10克.
(3) 20℃时,10克氯化钠可溶解在100克水里,20℃时氯化钠 的溶解度是10克。
(4) 20℃时, 100克水最多可溶解36克氯化钠, 则20℃时氯 化钠的溶解度为36。
0 10 20 30 40 50
8070605040302010
(1)溶解度与温度存在 一、 一对应关系; 该溶液是饱和溶液; (2)通过溶解度曲线可 以判断出某物质在一 定温度下的溶解度;(3)通过溶解度曲线可 以比较不同物质在不 同温度下的溶解能力 (溶解度);
(4)大多数固体物质溶 解度随温度升高而增 大,例如: 硝酸钠、 氯化铵等。(5)少数固体物质溶解 度受温度影响不大, 例如食盐.(6)极少数固体物质溶 解度随温度升高反而 降低。如氢氧化钙等。
(7)线上的点表示某温度 下某物质的溶解度; 该溶液是饱和溶液; (8)两条线的交点表示该 温度下两种物质的 溶解度相同;(9)线上方的点表示在该 温度下该溶液是饱和 溶液且有该物质未溶解;(10)线下方的点表示该 温度下该溶液是不 饱和溶液。
从溶解度曲线中,可以后的下列信息:
如图是A、B、C三种物质在水中的溶解度曲线,请回答:(1)M点的含义是_________________________ (2)当温度为t1 ℃,三种物质溶解度由小到大依次为_______,当温度为t3 ℃时,溶解度最大的是___;(3)C可能表示哪种物质: 。(4)从B溶液中得到晶体宜采用的方法是 。(5)除去A中混有的少量B的方法是 。
t2ºC时,A和C两种物质的溶解度相等
你发现溶解度曲线的线型有几种类型?
(6)当A、B、C三种物质的溶液接近饱和时,采用增加溶质、恒温蒸发溶剂、降低温度的方法均可以达到饱和的是 物质溶液。
难溶
0.01 1 10 S/g 20℃
溶解度是物质溶解能力的一种表达方式,通常把物质分为:
3.溶解度与溶解性的关系
【课堂练习】1.下列说法正确的是( ) A.饱和溶液就是无论条件如何变化都不能再溶解某种溶 质的溶液 B.饱和溶液是指很浓的溶液,不饱和溶液是指比较稀得 溶液 C.饱和溶液不会变成不饱和溶液,不饱和溶液也不会变 成饱和溶液 D.在一定温度下往20g水中放入一些蔗糖,充分搅拌后 仍有固体蔗糖剩余,这时的蔗糖溶液是饱和溶液
2.下列说法正确的是( ) A 相同温度下,饱和溶液一定比不饱和溶液浓 B 饱和溶液一定是浓溶液 C 不饱和溶液降温不一定会变成饱和溶液 D 对同种溶质来说,饱和溶液一定比不饱和溶液浓
3.现有下列方法:①升高温度 ②降低温度 ③增加硝酸钾 ④减少硝酸钾 ⑤增加水 ⑥蒸发水。能用来将硝酸钾不饱和溶液转化为饱和溶液的方法是( ) A ①③⑥ B ②③⑥ C ①③⑤ D ②④⑥
4.在室温下,一杯饱和的糖水,怎样用实验的方法证 明它是饱和溶液还是不饱和溶液?答:
通过溶解度曲线,同学查出下列物质的溶解度:1. 10℃时,硝酸钠的溶解度是 g; 80℃时,硝酸钠的溶解度是 g。2.在70℃时,氯化钠、氯化铵、硝酸钾三种物质的溶解 度分别为 g 、 g 、 g。3.温度 68℃时,硝酸钠的溶解度大于硝酸钾的溶解性;温度 68℃时,硝酸钠的溶解度等于硝酸钾的溶解度;温度 68℃时,硝酸钠的溶解度小于硝酸钾的溶解度。
37.8 60.2 138
现象:天气闷热时,鱼儿为什么总爱在水面 上进行呼吸?结论:气体在水中的溶解能力受温度的影响。
喝可乐、雪碧时,打开易拉罐会发生这样的现象:
结论: 气体在水中的溶解能力随压强 增大而增大,压强减小而减小。
综上所述:气体在水中的溶解能力受温度、压强的影响。
在压强为101kPa、一定温度时,1体积水里达到饱和状态时溶解的气体的体积。
压强越大,气体的溶解度越大;温度越高,气体的溶解度越小。
2.下列几种物质①硝酸钾②熟石灰③氧气④二氧化碳溶解度随温度的升高而减小的是( )A.①② B.③④ C.②③④ D.只有①
【课堂练习】1.下列对“20℃时,硝酸钾的溶解度为31.6g”的解释正确的是( )A. 20℃时,31.6g硝酸钾溶解在水中 B. 20℃时,100g溶液中含31.6g硝酸钾C. 31.6g硝酸钾溶解在100g水中达到饱和状态D.20℃时,31.6g硝酸钾溶解在100g水中恰好达到饱和状态
【基础巩固】1.用什么方法可以使接近饱和的硝酸钾溶液 变为饱和溶液?2.硝酸钾在60 ℃时的溶解度是110g,这说明在 ℃时, g 硝酸钾溶解在 g水中恰好形成饱好溶液。3.在提到某种物质的溶解度时,为什么要特别指明温度?答:溶解度与温度有关。不同温度下同一种物质的溶解度 不同。4.分析溶解度曲线,从中可以看出固体的溶解度与温度有 什么关系?答:大多数物质的溶解度随温度的升高而增大如KNO3 ; 少数物质的溶解度随温度的升高变化不大如NaCl; 极少数物质的溶解度随温度升高而减小如Ca(OH)2 。
5.为什么汗水带有咸味?被汗水浸湿的衣服晾干后,常出 现白色的斑迹,这是为什么?答:汗水中含有盐。水分蒸发后,盐留在衣服上形成白斑6.现有一瓶蒸馏水和一瓶氯化钾溶液,可用什么简单的办 法把它们鉴别开?答:用玻璃被各蘸液体少量于酒精灯上灼烧,无斑迹的是 蒸馏水,有斑迹的是氯化钾。7.加热冷水时,当温度尚未达到沸点时,为什么水中常有 气泡冒出?天气闷热时,鱼塘里的鱼为什么总是接近水 面游动?答:温度升高,气体的溶解度减小,溶解在水中的气体逸出; 水温升高、水中溶解的氧气减少,而水面与空气接触溶解的氧气多,所以--------。
8.氨在常温下是一种气体,它易溶于水,溶于水后就形成 氨水,当温度升高时氨又会逸出。氨水是一种常用的化 学肥料,平时贮存在氨水罐中。试设想在保存氨水时应 注意什么?答:放在阴凉处、密封保存在氨水罐中。9.下图是a、b两种固体物质的溶解度曲线。从图中你能得 到哪些信息?开放题
t ℃时,a、b两种物质的溶解度相等;小于t ℃时, a溶解度< b物质溶解度;大于t ℃时, a溶解度> b物质溶解度.
【能力提高】 1.10℃时硝酸钾的溶解度是20.9g,20℃时食盐的溶解度是25g,70℃时氯化铵的溶解度是60g,则( )A. 硝酸钾的溶解度最小 B. 食盐的溶解度的最大C. 氯化铵的溶解度最大 D. 无法比较溶解的的大小2.将60℃时的硝酸钾饱和溶液冷却到20℃,溶液中保持不变的是( )A. 溶质质量 B. 溶剂质量 C. 溶液质量 D. 质的溶解度
3.根据下图所示的溶解度曲线,回答下列问题: (1)我国某些盐湖里出产天然碱 (主要成分为纯碱晶体,并含 少量氯化钠等杂质)。在实验室 里从天然碱中分离出较纯的纯碱 晶体应采用 方法 (杂质仅考虑氯化钠)。(2)具体的实验操作步骤:①加热溶解;②结晶; ③过滤; ④洗涤晾干。
(3)完成(2)中① ~③必备的实验仪器有铁架台(附铁 圈,石棉网)、烧杯、玻璃棒和 、 等。
【历史回顾】1.在初中化学中,我们学习了溶液的 有关知识。右图是KNO3的溶解度曲线。(1)从右图溶解度曲线可以得到的信息 是 。(2)小明参照右图在常温20℃时进行了如下实验:
小明观察到A中所加固体全部溶解,则B中的现象是____。
上述实验过程中属于不饱和溶液的是(填字母)_________.D中溶液的溶质质量分数是___________________。
20℃时,KNO3的溶解度是31.6g
2.甲物质在水中的溶解度曲线如右图,a、b、c、d为图象中的四个点。①t1℃时,甲物质的溶解度是_____ g / 100g水。②t2℃时,25g水中最多能溶解甲物 质________g.③要使甲物质的饱和溶液成为不饱和溶液,可采用的一 种方法是______________________。④甲物质的溶液分别处于a、b、c、d四个点时,溶液中 甲的质量分数大小关系正确的是____(选填下列编号).Ⅰ.c>d= b >a Ⅱ.c=d >a= b Ⅲ.c>a>b= d Ⅳ.c>a= b>d
课题三 溶质的质量分数一溶质的质量分数【实验探究1】分别在1号、2号、3号试管中加入 0.5g、1g、1.5g固体硫酸铜, 再分别倒入10mL水,振荡、溶解后, 比较3种硫酸铜溶液的颜色。实验现象:1号试管中溶液颜色最浅; 2号次之; 3号试管中的溶液颜色最深。实验结论:溶液颜色越深、溶液越浓。
【实验探究2】将刚才配好的硫酸铜溶液,取一支溶液倒 入2支空试管中往,其中一支加入水,振荡, 观察颜色。实验现象:颜色明显变浅。实验结论:影响溶液浓度的因素还有溶剂的质量。
综上所述: 溶质质量、溶剂质量都会影响溶液的浓度。
今天的粥稠了,是潜意识和昨天的粥比、米多了; 今天的粥稀了,是潜意识和昨天的粥比、米少了。 张家认为的稠粥在李家可能就是稀粥。 怎样才能比出千家万户的粥,到底谁家的粥稠了、稀了? 取相同质量的粥,考察米的多少,便可知道谁家的粥稠稀。或者说:溶液的浓、稀在数学上是这样表达的:
一 溶质的质量分数 定义:溶质的质量与溶液的质量之比表达式:溶质的质量分数= 溶质质量 = 溶液质量×溶质的质量分数 溶液质量 = 溶剂质量 + 溶质质量 = 溶质质量÷溶质质量分数 = 溶液体积 × 溶液密度
1.溶液的分类(1)从能否继续溶解某种溶质把溶液分为: 饱和溶液;不饱和溶液。(2)从溶质与溶剂的质量比把溶液分为: 浓溶液;稀溶液。2. 饱和溶液、不饱和溶液与“浓”“稀”溶液的关系
二 饱和溶液、不饱和溶液与浓溶液、稀溶液之间的关系
结论:饱和溶液不一定是浓溶液, 稀溶液不一定是不饱和溶液
如20 / ℃时,100g水中溶解20gNaCl,可谓浓但没有饱和; 20 / ℃时,100g水中溶解0.153gCa(OH)2,可谓稀但饱和.
×100% = 13%
0.5g + 10g
×100% = 4.8 %
三 溶液的计算1.已知溶质和溶剂质量,求溶质的质量分数【计算】在3个盛10mL水的烧杯中分别加入0.5g、1g、 1.5g溶质,三种溶液中溶质的质量分数各是多少?三种溶液中溶质的质量分数为:
1.溶质的质量分数为:
1g + 10g
×100% = 9 %
2.溶质的质量分数为:
1.5g + 10g
3.溶质的质量分数为:
【活动与探究】同学完成下表:(水的密度=1g·cm-1)
结论:1.氯化钠溶液是无色的、无法通过观察其颜色确定溶液的 浓稀。2.可以通过计算溶质的质量分数比较各溶液浓度的大小。
2.已知溶液质量和溶质的质量分数,求溶质和溶剂的质 量 溶质质量 = 溶液质量×溶质的质量分数 例1.在农业生产上,常需要用质量分数为16%的氯化钠 溶液来选种。现要配制150kg的这种溶液,需要氯 化钠和水的质量各是多少?解:含溶质NaCl = 150kg×16% = 24kg 含溶剂水 = 溶液质量 — 溶质质量 = 150kg— 24kg =126kg答:-----------。
例2.用A、B两个烧杯各取90g溶质的质量分数为10%的硝 酸钾溶液,再A向烧杯中加入10g硝酸钾,向B烧杯 中加入10g水,并用玻璃棒搅拌至全部溶解。求:1.原溶液中溶质的质量、溶剂的质量各是多少?2.向原溶液中增加10g硝酸钾(全部溶解)或增加10g水 后,溶液中溶质质量、溶剂质量、溶液质量各是多少?3.上述形成的两种溶液中溶质的质量分数各是多少?
解: 1.原溶液中含硝酸钾:90g×10%=9g 含水:90g-9g=81g
含硝酸钾:9; 含水:81g
含硝酸钾:9g 含水:81g
2. ①增加10g硝酸钾后:A烧杯中 溶质质量 = 9g + 10g = 19g 溶剂质量=81g(不变) 溶液质量 = 19g+81g=100g 或90g+10g=100g
②加入10g水后:B烧杯中 溶质质量=9g(不变) 溶剂质量 = 81g + 10g =91g 溶液质量 = 9g + 91g = 100g 或90g + 10g=100g
3. ①增加10g硝酸钾后,A烧杯中:
×100% = 19 %
溶质的质量分数
②增加10g水后,B烧杯中:
终上所述:增加 ;增加 。
溶质质量则溶质和溶液质量同时增加,溶液中溶质质量分数升高
溶剂质量则溶剂和溶液质量同时增加,溶液中溶质质量分数降低
三、配制溶液的一般步骤 例3. 配制50g质量分数为5%的NaCl溶液,需NaCl 和H2O各多少克?解:1.计算;需NaCl:50g×5%=2.5g 需H2O:50g -2.5g=47.5g
配制溶液需要的仪器:托盘天平、药匙、量筒、 胶头滴管、烧杯、玻 璃棒、试剂瓶。
2.用氯化钠固体配制50g质量分数为5%的氯化钠溶 液,下列仪器中需要用到的是( )
A. ②④⑥⑦ B. ①④⑤⑥ C. ①③⑤⑦ D. ①③④⑥
3.用氯化钠配制100g溶质质量分数为20%的氯化钠溶液,现有下列操作①溶解;②称取氯化钠;③过滤; ④量取水;⑤计算;⑥蒸发结晶。正确的操作顺序是( ) A. ①②③④ B. ⑤②④① C. ①③⑤②④① D. ①③⑥⑤②④
4.在40g溶质质量分数为15%的硝酸钾不饱和溶液中, 加入10g硝酸钾或10g水,计算所得溶液中溶质的质 量分数。
×100% = 32 %
解:加入10gKNO3 后,溶质的质量分数:
×100% = 12 %
加入10gH2O后,溶质的质量分数:
答:---------。
第二课时 溶质质量分数的计算将1g食盐放入烧杯中,再加入9mL水,用玻璃棒搅拌至溶解。再向上述烧杯中加入10mL水、搅拌(水的密度1g·cm-3)求:1.试分别写出稀释前后溶质质量、溶液质量、溶质质量分数。2.分析各量的变化情况。
稀释前溶质质量是1g、溶液质量是10g、溶质质量分数是10%
稀释后溶质质量是1g、溶液质量是20g、溶质质量分数是5%
答:1. 稀释前 稀释后
2.稀释后溶液质量增加,溶质质量不变,溶质质量分数减小.
稀释前溶质的质量=稀释后溶质的质量
结论:溶质的质量分数减小一半, 加水的质量和对应溶液的质量一样多
一 溶液稀释和配制问题的计算家里做稀饭稠了,变稀的方法是加水,但加水前后稀饭中米粒数不变.即:
例1.化学实验室现有98%的浓硫酸,在实验中常需要用较稀的硫酸溶液。要把50g质量分数为98%的浓硫酸稀释为质量分数为20%的硫酸溶液,需要多少克水?解1:设需加水的质量为x 答:--------。
解2:设稀释后溶液的质量为y 59g×98% = 20%·y y=245g需水:245g—50g=195g
例2.某工厂化验室配制5000g 20%的盐酸,需38%的盐酸 多少毫升(密度为1.19g·mL—1)分析:溶质的质量分数是质量比,不能把体积直接代入公 式计算。涉及到体积时:溶质质量=溶液体积×溶液密度×溶质的质量分数解:设需38%的盐酸体积为x答:---------。
1.19 g · mL—1 · x · 38%
13g x
二 溶质的质量分数应用于化学方程式的计算例3.100g某硫酸溶液恰好与13g锌完全反应。 试计算这种硫酸中溶质的质量分数。解:设100g硫酸溶液中溶质质量为x Zn + H2SO4 = ZnSO4 + H2↑ 65 98
13g x
65 98
溶质的质量分数=
×100% = 19.6%
【课堂练习】 1.把200g 20%食盐水溶液稀释成10%的溶液需加水 多少克?2.把30g质量分数为20%的氢氧化钠溶液加水稀释到100g此溶液中氢氧化钠的质量分数为多少?
解:设--------x
3.实验室要配制50g溶质质量分数为20%的硝酸钾溶液。 现有25g溶质质量分数为40%的硝酸钾溶液、20g溶质 质量分数为15%的硝酸钾溶液及足够多的硝酸钾晶体和 蒸馏水,请选用上述药品,设计配制方案填入下表:解:(1)50g、20%的KNO3溶液中含KNO3:50×20%=10g 含H2O:50g-10g=40g(2) 20g、15%的KNO3溶液中含KNO3:20g×15%=3g 含H2O:20g-3g=17g 在20g、15%的溶液中,再加KNO3 :10g-3g=7g 再加H2O: 40g-17g=23g(3)设在25g、40%的KNO3溶液加水的质量为x时,配成 50g、20%的KNO3溶液。
10g硝酸钾和40g水
20g溶质质量分数为15%的硝酸钾溶液、7g硝酸钾和23g水
25g溶质质量分数40%的硝酸钾溶液和25g水
【基础训练】1.某温度下,蒸干35g氯化钾溶液,得到 10g,求该溶液中溶质的质量分数。解:该溶液中溶质的质量分数:
×100%=28.6%
2.把100g质量分数为98%的硫酸稀释成10%的稀硫酸, 需要水的质量是多少?解:设-------x答:------。
3.某工厂化验室配制5000g 20%的盐酸,需要38%的 盐酸(密度为1.19g/mL)的体积是多少?解:设------x 答:-------。
4.配制500mL质量分数为10%的氢氧化钠溶液(密度为 1.1 ),需要氢氧化钠和水的质量各是多少?解:含NaOH:500mL×1.1 ×10%=55g 含H2O:500mL×1.1 -55g = 495g答:-------。
x · 1.19 g/mL ×38%
5.100g某硫酸恰好与13g锌完全起反应。试计算这种硫酸 中溶质的质量分数。 解:设--------x Zn + H2SO4 = ZnSO4 + H2 65 98 13g x 硫酸溶液的质量分数: 答:--------。
65 98
13g x
×100%=19.6%
6. 50g质量分数为38%的盐酸与足量大理石反应,生 成二氧化碳的质量是多少?这些二氧化碳的体积( 标准状况)是多少?(在标准状况下,二氧化碳的 密度为1.977g/L)解:设---------x CaCO3 + 2HCl = CaCl2 + H2O + CO2 73 44 50g×38% x
73 44
50g×38% x
答:--------。
7.某食品加工厂生产的酱油中氯化钠的质量 分数为15%~18%,该厂日产酱油15t试。 计算该厂每月(按30天计)消耗氯化钠的 质量。解: 67.5t ~ 81t答:-----。
8.某注射用药液的配制方法如下: (1)把1.0g药品溶于水制成4.0mL溶液a; (2)取0.1mL溶液a,加水稀释至1.0mL,得溶液b; (3)取0.1mL溶液b,加水稀释至1.0mL,得溶液c; (4)取0.2mL溶液c,加水稀释至1.0mL,得溶液d。由于在整个配制过程中,药液很稀,其密度近似看作 。试求:(1)最终得到的药液(溶液d)中溶质的质量分数;(2)1.0g该药品可配制溶液d的体积是多少?解:(1) (2)答:----------------。
9.在20 ℃时,要提纯50g含有少量泥沙的粗盐,最 好用多少水来溶解粗盐?
10.现欲配制10%的NaCl溶液100g,试简述配置过程。 学生讨论完成。
解:------------x
答:-------------。
【能力提高】将一瓶80g 溶质质量分数为10%的NaCl溶液平均分为2等份,每份溶液中溶质的质量分数为 ; 若将其中的一份溶液中溶质的质量分数减小一半, 应加水 g, 若将另一份溶液中溶质的质量分数增大一倍,应加入NaCl g。
解析:设加入的溶质质量为x,则由题意可得:
初中化学人教版九年级下册第九单元 溶液课题3 溶液的浓度精品课件ppt: 这是一份初中化学人教版九年级下册第九单元 溶液课题3 溶液的浓度精品课件ppt,共21页。PPT课件主要包含了溶液的配制,氯化钠固体和蒸馏水,方法一,溶质的质量少了,溶剂的质量多了,方法二,装瓶存放,自制汽水,玻璃棒等内容,欢迎下载使用。
九年级下册第九单元 溶液课题3 溶液的浓度一等奖课件ppt: 这是一份九年级下册第九单元 溶液课题3 溶液的浓度一等奖课件ppt,共23页。PPT课件主要包含了溶质的质量分数,溶质的浓度,溶质的质量,溶液的质量,×100%,相关计算式,基本公式的变形,理由如下,溶液的稀释,x=245g等内容,欢迎下载使用。
初中人教版课题3 溶液的浓度课文配套ppt课件: 这是一份初中人教版课题3 溶液的浓度课文配套ppt课件,文件包含人教九下第9单元课题3溶液的浓度第一课时pptx、人教九下第9单元课题3溶液的浓度第二课时pptx、三种不同浓度的硫酸铜溶液mp4、盐水浮鸡蛋mp4、配制两种不同质量分数的氯化钠溶液mp4等5份课件配套教学资源,其中PPT共69页, 欢迎下载使用。













