






苏教版 (2019)选择性必修2专题4 分子空间结构与物质性质第二单元 配合物的形成和应用完整版ppt课件
展开Au+HNO3+4HCl=H[AuCl4]+NO↑+2H2O
1.滴加氨水后,试管中首先出现蓝色沉淀。
Cu2++2NH3·H2O=Cu(OH)2↓+2NH4+
2.继续滴加氨水,沉淀逐渐溶解,溶液变成深蓝色。
思考:沉淀为什么溶解?深蓝色的可溶物质是什么?
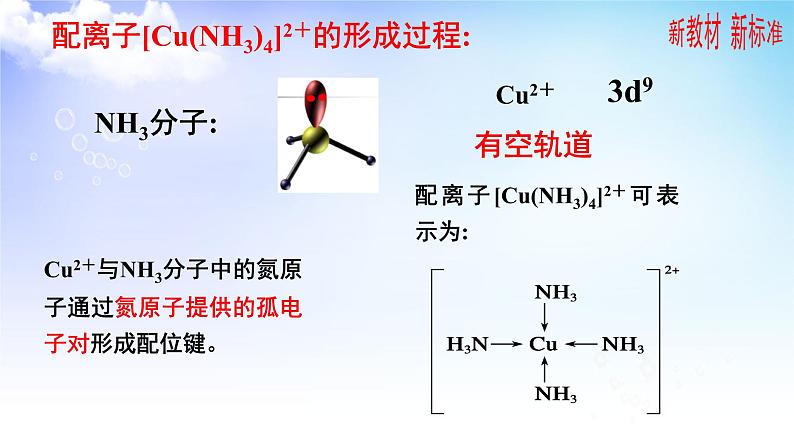
Cu2+与NH3分子中的氮原子通过氮原子提供的孤电子对形成配位键。
配离子[Cu(NH3)4]2+的形成过程:
Cu(OH)2+4NH3·H2O=[Cu(NH3)4]2++2OH-+4H2O
乙醇的作用:(醇析)降低[Cu(NH3)4]SO4的溶解度,利于析出[Cu(NH3)4]SO4·H2O晶体。
思考:为什么无水CuSO4是白色的,而CuSO4·5H2O和CuSO4溶液是蓝色的?
1、概念:把金属离子(或原子)与某些分子或离子(称为配体)以配位键结合形成的化合物称为配位化合物,简称配合物。如:[Cu(NH3)4]SO4、[Ag(NH3)2]OH等均为配合物。 注意NH4Cl不是配合物。
(内外界之间是完全电离的)
=[Cu(NH3)4]2++SO42-
[Cu(NH3)4] SO4
[Cu (NH3) 4 ] SO4
[C(NH3)6]Cl3
K3[Cr(CN)6]
1、填空下列配合物的配位数 K[PtCl3(NH3)] 配位数为___ [C(NH3)4Cl2]Cl 配位数是___ [C(NH3)5Cl]Cl2 配位数是___
配位体不是同一分子或离子时,配位数要两者相加
Ni(CO)5、Fe(CO)5 中Ni和Fe都是中性原子
配位体中配位原子必须含有孤对电子的原子,如NH3中N,H2O中O。
如X-、OH-、SCN-、CN--等
如H2O、NH3、CO等
学 以 致 用
现有两种配合物晶体[C(NH3)6]Cl3和[C(NH3)5Cl]Cl2,一种为橙黄色,另一种为紫红色。请设计实验方案将两种配合物区别开来。
取相同质量的两种晶体分别配成溶液,向两种溶液中分别滴加硝酸酸化的AgNO3溶液至不再产生沉淀,分别记录滴加的AgNO3溶液的体积。滴加体积多的为[C(NH3)6]Cl3,滴加体积少的为[C(NH3)5Cl]Cl2。
(1)配合物的空间结构
一般中心原子的配位数为2、4、6。
(2)配合物的异构现象
含有两种或两种以上配位体的配合物,若配位体在空间的排列方式不同,就能形成不同的几何构型的配合物。
如:Pt(NH3)2Cl2有顺式和反式两种异构体。
二、配合物的性质及应用
1.配合物性质: 具有一定的稳定性,配位键越强,配合物越稳定。过渡金属配合物远比主族金属易形成配合物。
配制银氨溶液时,向AgNO3溶液中滴加氨水,先生成白色沉淀,后沉淀逐渐溶解,生成银氨溶液。
Ag++NH3·H2O=AgOH↓+NH4+ AgOH+2NH3·H2O=[Ag(NH3)2]++OH-+2H2O
(2)检验Fe3+离子
Fe3+与SCN-生成[Fe(SCN)n](3-n)+
加冰晶石Na3[AlF6]降低熔点
在生命体中、医药、配合物与生物固氮、生产生活等中都有很重要的应用。
CO中毒原因人体内血红蛋白是Fe2+卟林配合物, Fe2+与O2结合形成配合物,而CO与血红蛋白中的Fe2+能生成更稳定的配合物。发生CO中毒事故,应首先将病人移至通风处,必要时送医院抢救。
人教版 (2019)选择性必修1第四章 化学反应与电能第二节 电解池一等奖课件ppt: 这是一份人教版 (2019)选择性必修1<a href="/hx/tb_c4002435_t3/?tag_id=26" target="_blank">第四章 化学反应与电能第二节 电解池一等奖课件ppt</a>,文件包含43电解池ppt、实验4-2电解氯化铜溶液mp4等2份课件配套教学资源,其中PPT共24页, 欢迎下载使用。
化学选择性必修2专题4 分子空间结构与物质性质第二单元 配合物的形成和应用课前预习ppt课件: 这是一份化学选择性必修2专题4 分子空间结构与物质性质第二单元 配合物的形成和应用课前预习ppt课件,文件包含42配合物的形成和应用第2课时课件pptx、42配合物的形成和应用第2课时教案docx等2份课件配套教学资源,其中PPT共22页, 欢迎下载使用。
高中化学苏教版 (2019)选择性必修2第二单元 配合物的形成和应用教案配套ppt课件: 这是一份高中化学苏教版 (2019)选择性必修2第二单元 配合物的形成和应用教案配套ppt课件,文件包含42配合物的形成和应用第1课时教案docx、42配合物的形成和应用第1课时课件pptx、硫酸四氨合铜的制备mp4等3份课件配套教学资源,其中PPT共0页, 欢迎下载使用。













