











初中科学浙教版九年级上册第1章 物质及其变化第3节 常见的酸课文配套ppt课件
展开第2课时 硫酸的性质
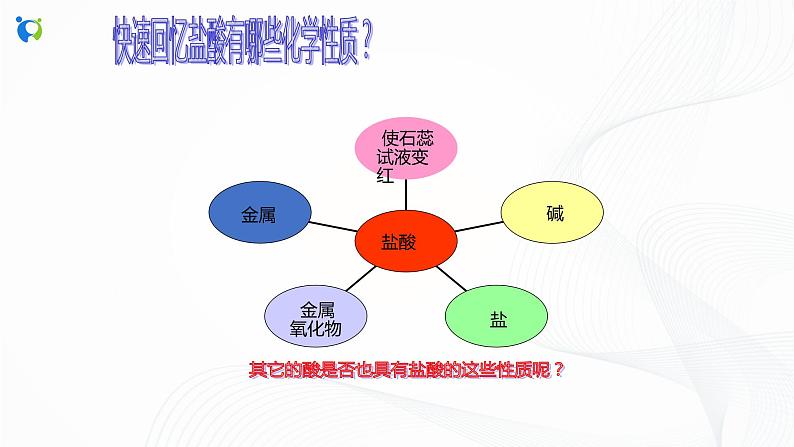
快速回忆盐酸有哪些化学性质?
其它的酸是否也具有盐酸的这些性质呢?
(一)、盐酸(HCl)的个性
1、盐酸是氯化氢(HCl)气体的水溶液。纯净 的盐酸是无色透明并有刺激性气味和酸味的液 体。常用的浓盐酸中溶质的质量分数约为37%, 密度为1.19克/厘米3。
2、浓盐酸具有挥发性。打开浓盐酸的试剂瓶,会挥发出有刺激性气味的气体,在瓶口有白雾形成。
3、盐酸与硝酸银溶液反应,能生成不溶于稀 硝酸的AgCl白色沉淀。
(二)、稀盐酸(HCl)的化学性质
1、盐酸能与指示剂反应
能使紫色石蕊试液变红,无色酚酞试液不变色。
2、盐酸能与金属反应生成盐和氢气
3、盐酸能与金属氧化物反应生成盐和水
4、盐酸能与碱反应生成盐和水
5、盐酸能与盐反应生成新盐和新酸
其他的酸是否也具有盐酸的这些性质呢?
(三)、稀硫酸(H2SO4)的化学性质
在盛稀硫酸的试管中滴入紫色石蕊试液,观察现象。
在盛稀硫酸的试管中滴入无色酚酞,观察现象。
1、硫酸能与指示剂反应
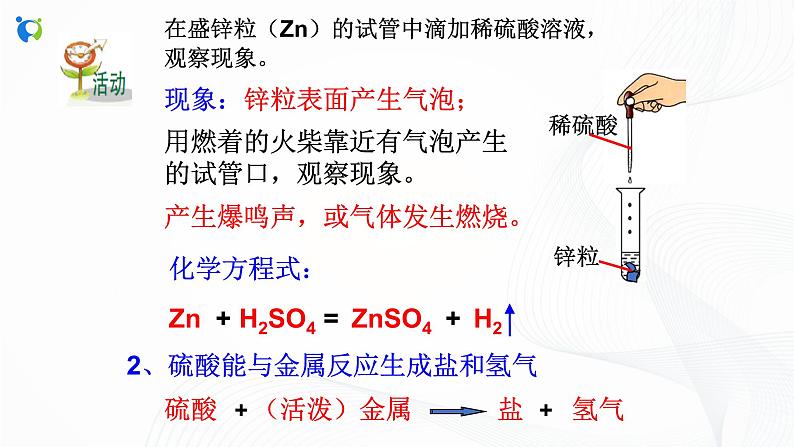
在盛锌粒(Zn)的试管中滴加稀硫酸溶液,观察现象。
用燃着的火柴靠近有气泡产生的试管口,观察现象。
产生爆鸣声,或气体发生燃烧。
2、硫酸能与金属反应生成盐和氢气
在盛氧化铁粉末(Fe2O3) 的试管中滴加稀硫酸溶液,观察现象。
红色氧化铁溶解,溶液变黄色。
在盛有氧化铜(CuO)的试管中滴加稀硫酸溶液,观察现象。
黑色氧化铜溶解、消失,溶液变成蓝色。
3、硫酸能与金属氧化物反应生成盐和水
在盛有氢氧化铜的试管中滴加稀硫酸溶液,观察现象。
蓝色氢氧化铜固体逐渐溶解,溶液变成蓝色。
4、硫酸能与碱反应生成盐和水
在盛有BaCl2溶液的试管中滴加稀硫酸溶液,观察现象。
5、硫酸能与盐反应生成新盐和新酸
以上实验说明硫酸具有_____________________________________________性质。
某些金属氧化物、碱、某些盐反应的
为什么稀盐酸、稀硫酸具有相似的化学性质呢?
稀盐酸、稀硫酸的酸溶液中都含有氢离子(H+)
2、酸 +(活泼)金属 = 盐 + 氢气
3、酸 + 某些金属氧化物 = 盐 + 水
4、酸 + 碱 = 盐 + 水
5、酸 + 某些盐 = 新盐 + 新酸
硫酸与盐酸有哪些不同之处?
(五)、硫酸(H2SO4)个性
1.查阅硫酸试剂瓶的标签上写了哪些内容。 你能看懂那些内容吗?
硫酸(分析纯)化学式:H2SO4 质量分数:98%净含量:500ml 密度:1.84g/ml【性状】本品为无色透明的粘稠 液体,有强腐蚀性!
2.用玻璃杯蘸取浓硫酸,观察浓 硫酸的黏度 _____________。
用玻璃棒蘸取少量浓硫酸滴在纸片上,过一会儿观察有何现象发生。__________________________________。
1、浓硫酸具有很强的腐蚀性
在实验时不小心碰到了浓硫酸,该怎么办?
如果浓硫酸不慎溅到皮肤上,要先用干布拭去,然后用大量清水冲洗,最后用小苏打溶液冲洗,严重时应立即送医院。
做实验时必须小心操作。
浓硫酸滴在纸片上,纸片为什么会变黑?
用小木棒蘸取少量浓硫酸,过一会儿观察有何现象发生。______________。
植物纤维(如棉花、麻、造纸的木纤维)、人的皮肤等含有碳、氢、氧3 种元素,浓硫酸能把其中的氢元素和氧元素“脱出”结合成水。
脱水性是浓硫酸的 性质,物质被浓硫酸脱水的过程是 变化过程。
实验室常用浓硫酸做干燥剂,用来干燥氧气、氢气、二氧化碳等气体。这是利用何性质?
浓硫酸作某些气体的干燥剂。
如果浓硫酸敞口放置,会发生什么变化?
如果浓硫酸敞口放置,由于浓硫酸具有吸水性,直接吸收空气中的水分,因而会导致溶液质量增加,溶液中溶质的质量分数减小。
纯净的浓硫酸是无色、粘稠、油状的液体,
常见的浓硫酸的质量分数为98%,密度为1.84克/厘米3,无挥发性。
取一只盛有50毫升水的烧杯,把约10毫升浓硫酸沿玻璃棒慢慢倒入水中,并不断地搅拌。用手触摸烧杯外壁,有何感觉? ________________________________。
烫手;浓硫酸溶于水会放出大量的热量
浓硫酸沿玻璃棒慢慢倒入水中,并不断地搅拌。
切不可把水倒进浓硫酸里。
切不可把水倒入浓硫酸中稀释,知道这是为什么吗?
若把水倒入浓硫酸,因浓硫酸的密度大于水的密度,所以水会漂在浓硫酸的上面,导致滴水部位形成局部高温使水沸腾,致使酸液向四周飞溅,造成事故。
6、鉴别硫酸根离子(SO42-)的方法:
先滴入硝酸钡溶液,产生白色沉淀,再滴入稀硝酸,白色沉淀不消失。
Ba(NO3)2溶 液
为什么要再滴入稀硝酸?
再滴入稀硝酸目的是除去CO32-杂质离子的干扰。
而BaSO4不溶于稀硝酸。
白色沉淀溶 解
我们已经知道了盐酸、硫酸的性质,它们有哪些用途?
(五)、盐酸与硫酸的用途
重要化工产品,用于金属表面除锈、制造药物(如盐酸麻黄素、氯化锌)等;
人体胃液中含有盐酸,可帮助消化。
硫酸(H2SO4)
重要化工原料,用于生产化肥、农药、火药、染料以及冶炼金属、精炼石油和金属除锈等。
浓硫酸有吸水性,在实验室中常用它做干燥剂。
(六)、硝 酸(HNO3)
硝酸也是一种在工业上有着广泛用途的强酸。
1、纯硝酸是无色、易挥发、有刺 激性气味的液体。
2、浓硝酸具有挥发性;
3、硝酸具有很强的氧化性;
5、浓硝酸见光易分解,故浓硝酸 一般密封保存在棕色的瓶中。
4、具有很强的腐蚀性;
1、是无色、粘稠、油状的液体
1、铅蓄电池中含有硫酸,如果不慎将硫酸漏到 大理石地面上,会发出嘶嘶声,并有气体产生。 这种气体是---------------------------------------( ) A. 二氧化硫 B. 二氧化碳 C. 氢气 D. 氧气
2、下列物质中不能跟稀硫酸反应的是----( ) A. 铁 B. 氧化镁 C. 二氧化碳 D. 碳酸钠
3、下列试剂能区别稀硫酸和盐酸的是----( ) A. 锌粒 B. 紫色石蕊试液 C. 氢氧化钾溶液 D. 氯化钡溶液
4、怎样鉴别3 瓶分别盛有水、稀盐酸、稀硫酸的 无色液体?
先用指示剂鉴别出水,再用氯化钡溶液或硝酸银溶液鉴别稀盐酸和稀硫酸。
5、某工厂利用废铁屑与废硫酸起反应来制取硫 酸亚铁。现有废硫酸9.8 吨(H2SO4的质量分 数为20%),与足量的废铁屑起反应,可生产 FeSO4 多少吨?
设:可生产 FeSO4 X吨
答:可生产 FeSO4 3.04吨
科学九年级上册第4节 物质的分类背景图ppt课件: 这是一份科学九年级上册第4节 物质的分类背景图ppt课件,文件包含第4节物质的分类第2课时课件pptx、第4节物质的分类第2课时常见物质的分类同步练习docx、第4节物质的分类第2课时教案doc等3份课件配套教学资源,其中PPT共13页, 欢迎下载使用。
科学九年级上册第3节 常见的酸评课课件ppt: 这是一份科学九年级上册第3节 常见的酸评课课件ppt,文件包含第3节常见的酸第1课时课件pptx、第3节常见的酸第1课时盐酸的性质同步练习docx、第3节常见的酸第1课时教案doc等3份课件配套教学资源,其中PPT共21页, 欢迎下载使用。
初中科学浙教版九年级上册第5节 物质的转化教案配套课件ppt: 这是一份初中科学浙教版九年级上册第5节 物质的转化教案配套课件ppt,文件包含第5节物质的转化第2课时课件pptx、第5节物质的转化第2课时金属的冶炼同步练习docx、第5节物质的转化第2课时教案doc、一氧化碳还原氧化铁wmv、木炭还原氧化铜wmv等5份课件配套教学资源,其中PPT共22页, 欢迎下载使用。














