

2021学年第三章 烃的衍生物第四节 羧酸 羧酸衍生物第1课时学案
展开第三章第四节 羧酸 羧酸衍生物第1课时 羧酸学案及课堂检测
核心素养发展目标
- 能从羧基的成键方式的角度,了解羧酸的结构特点和分类,理解羧酸的化学性质及官能团与反应类型之间的关系。
- 能根据酯化反应的原理优化乙酸乙酯制备的方案,提高乙酸乙酯的产率。
知识梳理
一、羧酸的结构与分类
1.羧酸的组成和结构
(1)羧酸:由烃基(或氢原子)与羧基相连而构成的有机化合物。官能团为—COOH或。
(2)通式:一元羧酸的通式为R—COOH,饱和一元羧酸的通式:CnH2nO2或CnH2n+1COOH。
2.羧酸的分类
(1)按分子中烃基的结构分类
羧酸
(2)按分子中羧基的个数分类
羧酸
(3)按分子中烃基所含碳原子数多少分类
羧酸
3.常见的羧酸
典型羧酸 | 物理性质 | 主要用途 |
甲酸(蚁酸)HCOOH | 无色、有刺激性气味的液体,有腐蚀性,能与水、乙醇等互溶 | 工业上可用作还原剂,是合成医药、农药和染料等的原料 |
苯甲酸(安息香酸) | 无色晶体,易升华,微溶于水,易溶于乙醇 | 用于合成香料、药物等,其钠盐是常用的食品防腐剂 |
乙二酸(草酸) HOOC—COOH | 无色晶体,通常含有两分子结晶水,可溶于水和乙醇 | 化学分析中常用的还原剂,也是重要的化工原料 |
4.羧酸的物理性质
甲酸、乙酸等分子中碳原子数较少的羧酸能够与水互溶。随着分子中碳原子数的增加,一元羧酸在水中的溶解度迅速减小,甚至不溶于水,其沸点也逐渐升高。高级脂肪酸是不溶于水的蜡状固体。羧酸与相对分子质量相当的其他有机化合物相比,沸点较高,这与羧酸分子间可以形成氢键有关。
总结归纳:羧酸的系统命名法
(1)选主链:选择含有羧基的最长碳链作为主链,按主链碳原子数称为某酸。
(2)编号位:在选取的主链中,从羧基碳原子开始给主链上的碳原子编号。
(3)定名称:在“某酸”名称之前加上取代基的位次号和名称。
例如:
二、羧酸的化学性质
羧酸的化学性质与乙酸相似,主要取决于官能团羧基。
1.酸性
由于—COOH能电离出H+,使羧酸具有弱酸性,一元羧酸电离的方程式:RCOOH
RCOO-+H+。
写出下列反应的化学方程式:
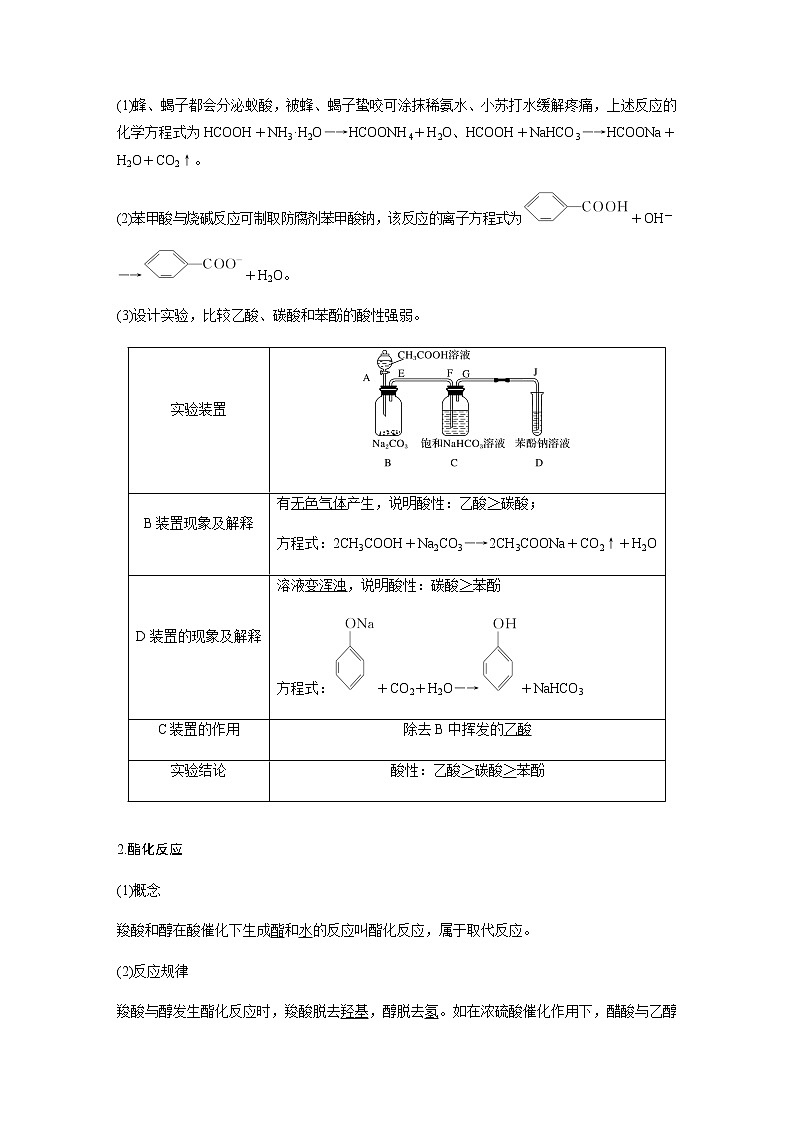
(1)蜂、蝎子都会分泌蚁酸,被蜂、蝎子蛰咬可涂抹稀氨水、小苏打水缓解疼痛,上述反应的化学方程式为HCOOH+NH3·H2O―→HCOONH4+H2O、HCOOH+NaHCO3―→HCOONa+H2O+CO2↑。
(2)苯甲酸与烧碱反应可制取防腐剂苯甲酸钠,该反应的离子方程式为+OH-
―→+H2O。
(3)设计实验,比较乙酸、碳酸和苯酚的酸性强弱。
实验装置 | |
B装置现象及解释 | 有无色气体产生,说明酸性:乙酸>碳酸; 方程式:2CH3COOH+Na2CO3―→2CH3COONa+CO2↑+H2O |
D装置的现象及解释 | 溶液变浑浊,说明酸性:碳酸>苯酚 方程式:+CO2+H2O―→+NaHCO3 |
C装置的作用 | 除去B中挥发的乙酸 |
实验结论 | 酸性:乙酸>碳酸>苯酚 |
2.酯化反应
(1)概念
羧酸和醇在酸催化下生成酯和水的反应叫酯化反应,属于取代反应。
(2)反应规律
羧酸与醇发生酯化反应时,羧酸脱去羟基,醇脱去氢。如在浓硫酸催化作用下,醋酸与乙醇(CH3CH218OH)酯化反应的化学方程式为
3.“形形色色”的酯化反应
(1)一元羧酸与二元醇或二元羧酸与一元醇的酯化反应
如:2CH3COOH+HOCH2CH2OHCH3COOCH2CH2OOCCH3+2H2O。
(2)二元羧酸与二元醇的酯化反应
①形成环状酯
++2H2O。
②形成高分子化合物——聚酯
nHOOC—COOH+nHOCH2CH2OH+(2n-1)H2O。
(3)含有羧基(—COOH)和羟基(—OH)有机物的酯化反应,如乳酸()
①两分子酯化:
++2H2O。
②羟基酸分子内脱水生成酯
+H2O。
③羟基酸自身聚合形成高分子化合物——聚酯
+(n-1)H2O。
归纳总结:醇、酚、羧酸分子中羟基氢原子的活泼性比较
名称 | 乙醇 | 苯酚 | 乙酸 |
结构简式 | CH3CH2OH | CH3COOH | |
羟基氢原子的活泼性 | 不能电离 | 能电离 | 能电离 |
酸性 | 中性 | 极弱酸性 | 弱酸性 |
与Na反应 | 反应放出H2 | 反应放出H2 | 反应放出H2 |
与NaOH反应 | 不反应 | 反应 | 反应 |
与Na2CO3反应 | 不反应 | 反应 | 反应 |
与NaHCO3反应 | 不反应 | 不反应 | 反应 |
由上表可知,常见分子(离子)中羟基氢原子的活泼性顺序为RCOOH>H2CO3>
>HCO>H2O>ROH。运用上述实验现象的不同,可判断有机物分子结构中含有的羟基类型。
课堂检测
1.(2020·四川省泸县五中高二月考)生活中遇到的某些问题,常常涉及化学知识,下列各项叙述不正确的是( )
A.鱼虾会产生不愉快的腥臭味,可在烹调时加入少量食醋和料酒
B.“酸可以除锈”“汽油可以去油污”都是发生了化学变化
C.被蜂蚁蜇咬会感觉疼痛难忍,这是由于人的皮肤被注入了甲酸的缘故,此时若能涂抹稀氨水或碳酸氢钠溶液,可以减轻疼痛
D.苯酚溶液用于环境消毒,医用酒精用于皮肤消毒,福尔马林用于制生物标本,都是因为使蛋白质变性凝固
答案 B
解析 酸除锈是酸和铁锈反应生成盐,属于化学变化,洗涤剂去油是利用物质的相似相溶原理,属于物理变化,故B项错误;甲酸是酸性物质能和碱反应生成盐,所以甲酸和氨水、碳酸氢钠等碱性物质反应生成盐,从而减轻疼痛,故C项正确;强酸、强碱、重金属盐、苯酚、乙醇等都能使蛋白质变性,病菌属于蛋白质,苯酚、酒精能使病菌变性,从而达到消毒目的,故D项正确。
2.有机物CH3CH2CH(CH3)CH(CH3)COOH的名称是( )
A.2-甲基-3-乙基丁酸 B.2,3-二甲基戊酸
C.3,4-二甲基戊酸 D.3,4-二甲基丁酸
答案 B
解析 该有机物含有一个—COOH属于羧酸,选含有—COOH而且最长的碳链为主链,主链上共有五个碳原子,编号时从—COOH上的碳原子开始,在2、3号碳原子上各有一个甲基,按照有机物的系统命名方法,该有机物的名称为2,3-二甲基戊酸。
3.(2020·昆明月考)钠与下列物质反应都能够产生氢气:①H2O;②CH3COOH;③CH3CH2OH,从产生氢气的剧烈程度可推断出这三种物质产生H+的难易程度是(从难到易的顺序)( )
A.①②③ B.②③①
C.③①② D.②①③
答案 C
4.已知在水溶液中存在平衡:
当与CH3CH2OH发生酯化反应时,不可能生成的物质是( )
A. B.
C.H—18OH D.H2O
答案 A
解析 乙酸在水溶液中存在平衡,那么根据酯化反应的机理,酯化反应生成的酯可能有两种:和,但绝不能生成A;生成水分子也有两种:H—18OH和H2O。
5.实验室中用乙酸和乙醇制备乙酸乙酯,为除去所得的乙酸乙酯中残留的乙酸,应选用的试剂是( )
A.饱和食盐水 B.饱和碳酸钠溶液
C.饱和NaOH溶液 D.浓硫酸
答案 B
解析 乙酸能与碳酸钠反应,乙醇能溶于水,乙酸乙酯不溶于水,所以选用饱和碳酸钠溶液可以溶解乙醇,反应乙酸,降低酯在水中的溶解度,有利于其析出。
6.(2019·吕叔湘中学高二月考)甲酸具有下列性质:①挥发性、②酸性、③比碳酸的酸性强、④还原性、⑤能发生酯化反应。
(1)在碳酸钠溶液中加入甲酸,有气体产生,说明甲酸具有________(填序号,下同)。
(2)在甲酸钠中加入浓磷酸,加热后放出能使湿润蓝色石蕊试纸变红的气体,说明甲酸具有________。
(3)与乙醇、浓硫酸混合后共热,能闻到一种香味,说明甲酸具有________。
(4)在甲酸中加入氢氧化铜,能看到溶液变蓝色,说明甲酸具有________。
(5)在新制的Cu(OH)2中加入甲酸,加热看到有砖红色沉淀生成,说明甲酸具有________。
答案 (1)②③或③ (2)①② (3)⑤ (4)② (5)④
解析 (1)在碳酸钠溶液中加入甲酸,有气体产生,说明甲酸能制得碳酸,满足强酸制弱酸原理。
(2)在甲酸钠中加入浓磷酸,加热后放出能使湿润蓝色石蕊试纸变红的气体,说明甲酸在加热时以蒸气形式存在,且具有酸性。
(3)与乙醇、浓硫酸混合后共热,能闻到一种香味,说明甲酸反应生成了酯,即酸与醇发生了酯化反应。
(4)在甲酸中加入氢氧化铜,能看到溶液变蓝色,说明甲酸能与碱反应,具有酸性。
(5)在新制Cu(OH)2悬浊液中加入甲酸,加热看到有砖红色沉淀生成,说明甲酸反应生成了氧化亚铜,即表现出还原性,将氢氧化铜还原为氧化亚铜。
高中化学人教版 (2019)选择性必修3第四节 羧酸 羧酸衍生物第二课时导学案: 这是一份高中化学人教版 (2019)选择性必修3第四节 羧酸 羧酸衍生物第二课时导学案,共10页。
高中化学人教版 (2019)选择性必修3第三章 烃的衍生物第四节 羧酸 羧酸衍生物第一课时学案设计: 这是一份高中化学人教版 (2019)选择性必修3第三章 烃的衍生物第四节 羧酸 羧酸衍生物第一课时学案设计,共12页。
鲁科版高考化学一轮复习第9章第53讲羧酸羧酸衍生物教学课时学案: 这是一份鲁科版高考化学一轮复习第9章第53讲羧酸羧酸衍生物教学课时学案,共35页。













