













初中化学人教版九年级下册课题 3 金属资源的利用和保护公开课ppt课件
展开第八单元 金属和金属材料
课题3 金属资源的利用和保护
设计说明 本课题分两部分,第一部分为铁的冶炼,是本课题教学的重点。对于这一部分内容,可以通过课件简要介绍我国炼铁的历史,然后重点介绍从铁矿石中将铁还原出来的化学反应原理。一氧化碳还原氧化铁的实验是本节课的重点和难点,可以结合实验视频进行突破,注意厘清实验的原理、步骤、实验现象以及实验的注意要点。高炉炼铁的内容要求较低,可以通过观看视频完成。教材中有关杂质问题的计算是以例题的形式呈现的,这一知识点对于学生来说难度较大,教师应进行重点分析、引导以及步骤规范。[来源: 第二部分为金属资源的保护,重点是关于“铁制品锈蚀的条件”的探究,以及“防止铁制品锈蚀”的讨论。【探究】包括提出问题、设计实验并实施、讨论、得出结论等多个步骤,对于培养学生的创新精神和解决实际问题的能力具有较大的价值。【讨论】主要是对在【探究】中获得的结论进行应用。关于金属资源的保护,可以借助图片、视频等素材,利用点拨、讨论等形式使学生充分了解金属矿物资源是有限的,以及金属资源的保护措施。 教学目标 【知识与技能】 1.了解金属资源概况,知道一些常见的金属如铁、铝、铜等的矿石。 2.了解实验室炼铁和工业炼铁的原理。 3.了解金属锈蚀的条件及防止金属锈蚀的方法。 4.知道保护金属资源的方法。 【过程与方法】 1. 通过金属锈蚀条件的实验探究,学习利用控制变量法进行科学探究的方法。 2.会根据化学方程式对含有杂质的反应物或生成物进行有关计算。 【情感、态度与价值观】 1.增强对生活和自然界中化学现象的好奇心和探究欲,熟悉与化学有关的社会问题,初步形成主动参与社会决策的意识。 2.逐步树立珍惜资源、爱护环境、合理使用化学物质的观念,树立起为社会的进步而学习化学的志向。 重点难点 教学重点 1. 工业炼铁原理,根据化学方程式对含有杂质的反应物或生成物进行有关计算。 2. 铁制品锈蚀的原因及相应的防锈措施。 教学难点 根据化学方程式对含有杂质的反应物或生成物进行有关计算。 教学方法 讨论法:通过分析讨论、归纳总结出一氧化碳还原氧化铁实验的原理、步骤、实验现象以及注意事项。 探究法:通过学生的探究实验,引导学生正确推理,概括出铁锈蚀的条件以及相应的防锈方法。 控制变量法:铁制品锈蚀条件的探究实验中注意控制变量,验证时保证要验证的条件不同外,其他条件应完全相同。 教具、学具 1.计算机多媒体教学系统、CAI课件等。 2.《一氧化碳还原氧化铁》视频资源、《高炉炼铁》视频资源、《赤铁矿》图片资源、《黄铁矿》图片资源、《黄铜矿》图片资源、《我国古代先进的冶金技术》图片资源等。 3.一套提前准备好的探究铁生锈条件的器材,包括铁钉放入装有干燥空气的试管、铁钉放入装有蒸馏水的试管、铁钉放入装有上层有植物油下层有水的试管等。 授课时数 2课时 第1课时 铁的冶炼 教学过程 导入新课 【教师展示】 世界最长的跨海大桥——港珠澳大桥 2018年10月23日,世界最长的跨海大桥——港珠澳大桥开通仪式在广东珠海举行,被誉为“新世界七大奇迹”。 【教师讲解】大桥的建造利用了很多金属材料。生活中的厨具、硬币等需要利用金属材料,航空母舰、运载火箭、战斗机等军事装备也需要金属材料,可以说人类的生活离不开金属,军事与科技也需要大量的金属。金属有广泛的用途,对于人类社会起着不可替代的作用! 【教师提问】金属材料与我们的生活和生产密不可分,那么,大家是否想过我们使用的金属材料是怎么来的?它们都可以从自然界中直接获得吗?为了更好的回答这个问题,今天,我们就来共同学习金属资源的利用和保护相关的内容。 一、铁的冶炼 【教师点拨】在学习如何制备金属材料之前,我们先来了解金属资源 概况。 【学生讨论】根据教材内容,讨论下列问题: 1.人类所利用的金属资源在地球上主要存在于哪些地方? 2.金属在自然界的存在方式是怎样的? 3.常见的金属铁、铝、铜在自然界中是以化合物还是以单质存在的? 4.我国矿物的种类和储量情况是怎样的? 【学生回答】 1.地球上的金属资源广泛地存在于地壳和浩瀚的海洋中。 2.只有少数化学性质很不活泼的金属如金、银等以单质形式存在,其他金属以化合物形式存在。 3.常见的金属铁、铝、铜都是以化合物形式存在于金属矿石中。 4.我国矿物种类比较齐全,储量比较丰富,其中钨、钼、钛、锡等储量居世界前列。 【教师点拨】工业上从含有金属元素并有开采价值的矿山中提炼金属,我们来看几种常见的金属。 【教师展示】教师播放图片《赤铁矿》《黄铁矿》《黄铜矿》。
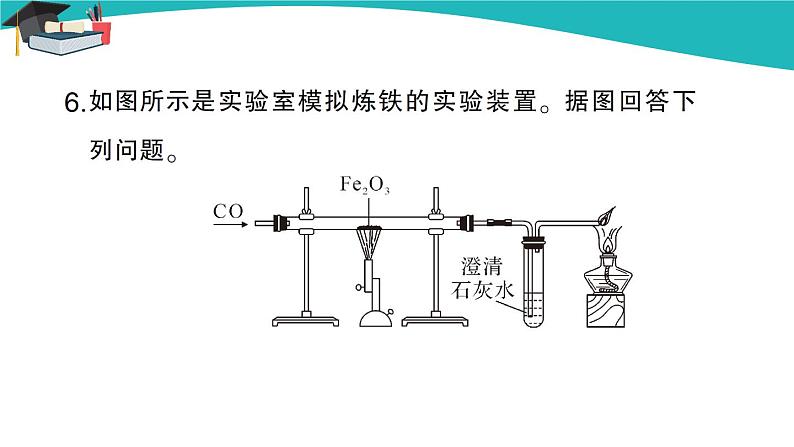
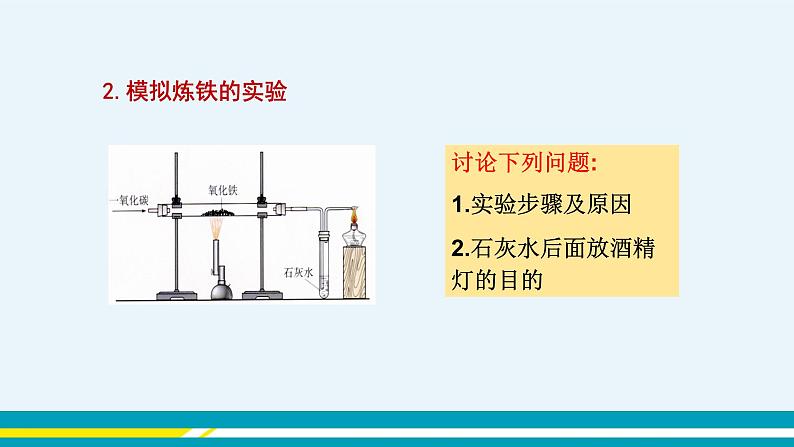
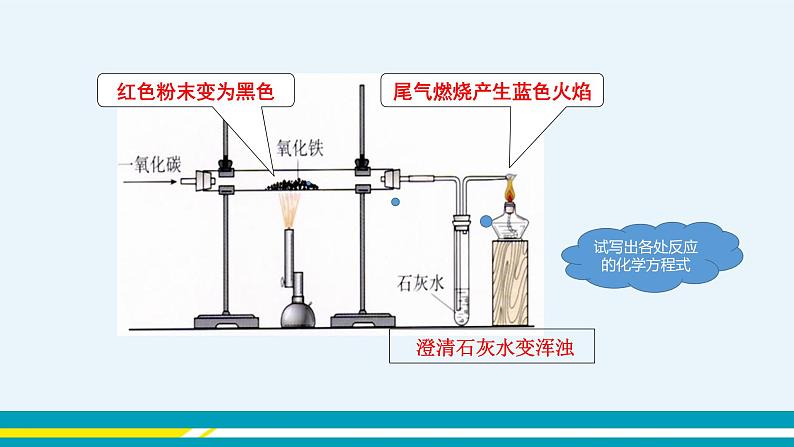
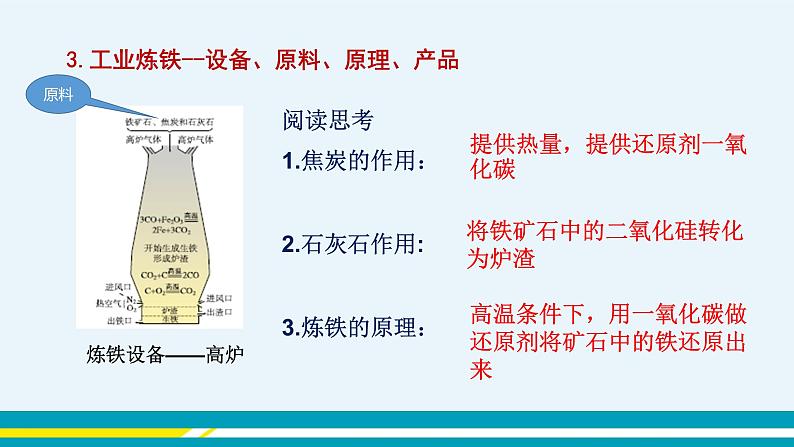
(插入图片《赤铁矿》) (插入图片《黄铁矿》) (插入图片《黄铜矿》) 【教师点拨】人类每年都要从自然界提取数以亿计的金属,其中提取量最大的是铁,那么我们如何从铁矿石中得到铁单质呢? 【知识回顾】你还记得上册我们学过什么物质可以将赤铁矿中的氧化铁(Fe2O3)还原为铁单质吗? 【教师引导】下面,我们通过视频来了解实验室中是怎样冶炼铁的。 【教师展示】教师播放视频《一氧化碳还原氧化铁》。 (插入视频《一氧化碳还原氧化铁》) 【师生总结】红棕色粉末逐渐变为黑色,生成的气体使澄清的石灰水变浑浊,尾气燃烧并产生蓝色的火焰。3CO+Fe2O32Fe+3CO2。 【注意事项】①先通入CO,后加热。②先停止加热,后停止通CO。 ③一氧化碳有毒,一定要进行尾气处理。 【教师点拨】我们已经学习了实验室炼铁的相关内容,下面再来了解工业炼铁的过程。 【教师展示】教师播放视频《高炉炼铁》。 (插入视频《高炉炼铁》) 【学生讨论】1.炼铁高炉内发生的化学反应是什么? 2.炼铁原料是什么? 3.焦炭、石灰石的作用分别是什么? 【学生回答】 1. C+O2CO2 CO2+C2CO 3CO+Fe2O32Fe+3CO2 2.铁矿石、焦炭、石灰石、空气等。 3.焦炭的作用:一是提供热量;二是提供还原剂。 石灰石的作用是将矿石中的二氧化硅转变为炉渣除去。 【教师展示】教师播放知识卡片《我国古代先进的冶金技术》。 (插入知识卡片《我国古代先进的冶金技术》) 【教师点拨】在实际生产时,所用的原料和产物一般都含有杂质,在计算用料和产量时,应考虑到杂质问题。 【教师展示】 【例题】用1 000 t含氧化铁80%的赤铁矿石,理论上可以炼出含铁96%的生铁的质量是多少? 分析:化学方程式表示的是纯净物之间的质量关系,赤铁矿石中含有纯的氧化铁的质量为1 000 t×80%。若设生铁的质量为,则其纯铁的质量为×96%,根据化学方程式就可计算出结果。 解:1 000 t赤铁矿石含氧化铁的质量为1 000 t×80%=800 t 设800 t氧化铁理论上可以炼出的铁的质量为。 3CO+Fe2O32Fe+3CO2 160 112 800 t =560 t 折合为含铁96%的生铁的质量为560 t÷96%≈583 t 答:1 000 t含氧化铁80%的赤铁矿石,理论上可炼出含铁96%的生铁 583 t。 【归纳总结】化学方程式表示的是纯净物之间的质量关系,因此,如果物质中含有杂质,要把不纯物质的质量换算为纯净物的质量,然后将纯净物的质量代入化学方程式进行计算。 纯度=纯净物的质量÷不纯物质的质量 纯净物的质量=不纯物质的质量×纯度 不纯物质的质量=纯净物的质量÷纯度 纯度=1-不纯物质中杂质的质量分数 典型例题 例1 下列关于工业炼铁的方法,错误的是( ) A.工业炼铁得到生铁 B.石灰石的作用是除去二氧化硅,形成炉渣 C.工业炼铁还原铁矿石中,作还原剂的是焦炭 D.工业炼铁的原料有铁矿石、焦炭、石灰石和空气 解析:工业炼铁中,利用焦炭的可燃性提供热量,又利用其还原性,与二氧化碳反应生成一氧化碳气体,然后利用一氧化碳和氧化铁反应生成铁,C错误。 答案:C 例2 如图是模拟炼铁的实验装置,下列说法不正确的是( ) A.该实验能观察到红棕色粉末变黑,澄清的石灰水变浑浊 B.一氧化碳还原氧化铁的反应不属于置换反应 C.该实验的三个反应中,碳元素的化合价都发生了变化 D.导管末端的酒精灯是进行尾气处理,防止污染空气 解析:一氧化碳与氧化铁反应生成铁和二氧化碳,该实验能观察到红棕色粉末逐渐变黑,澄清石灰水变浑浊,A正确。一氧化碳与氧化铁反应生成铁和二氧化碳,该反应的反应物均为化合物,不属于置换反应,B正确。该实验的三个反应是一氧化碳与氧化铁反应生成铁和二氧化碳;二氧化碳与氢氧化钙反应生成碳酸钙和水;一氧化碳燃烧生成二氧化碳;其中二氧化碳与氢氧化钙生成碳酸钙和水的反应中碳元素的化合价不变,C错误。导管末端的酒精灯是进行尾气处理,是为了点燃一氧化碳,防止污染空气,D正确。 答案:C 例3 某炼钢厂日产含杂质5%的生铁3 000 t,试计算: (1)该3 000 t生铁中含纯铁多少吨? (2)该炼钢厂每天需含Fe2O3质量分数为85%的赤铁矿石多少吨?(计算结果保留整数) 答案:解:(1)3 000 t×(1-5%)=2 850 t。 (2)设需要含Fe2O3质量分数为85%的赤铁矿石的质量为x。 3CO+Fe2O32Fe+3CO2 160 112 85%x 2 850 t = x≈4 790 t 答:(1)该3 000 t生铁中含纯铁2 850 t。 (2)需要含Fe2O3质量分数为85%的赤铁矿石的质量为4 790 t。 课堂小结 金属资源广泛存在于地壳和海洋中,大部分金属以化合物形式存在。铁矿石冶炼成铁是一个复杂的过程,主要反应原理是在高温下,一氧化碳夺取铁矿石里的氧,将铁还原出来。在实际的冶铁生产过程中,所用的原料或所得的产物一般都含有杂质,在计算用料和产量时,应注意杂质问题。 当堂达标 1. 距今2 000余年前的西汉时期,就有“曾青得铁则化为铜”的记述,这是现代湿法冶金技术的先驱,从现代的科学观点理解,“曾青”应赋予的最恰当的含义是( ) A.铜单质 B.硫酸铜溶液 C.铜的化合物 D.可溶性铜的化合物的溶液 答案:D 2. 下列关于炼铁的叙述错误的是( ) A.主要原料为铁矿石、焦炭、石灰石、空气等 B.主要设备为高炉 C.主要原理是利用焦炭的还原性置换出铁矿石中的铁 D.主要产物是生铁 答案:C 3. “中国高铁,世界第一”,高铁列车车体材料使用了含镍不锈钢,工业上火法炼镍的原理是C+2NiO2Ni+CO2↑,下列说法错误的是( ) A.反应中NiO发生还原反应 B.气体产物中可能有CO C.该不锈钢中还含有铁和碳 D.该不锈钢合金的硬度小于纯铁 答案:D 4. 实验室用如图装置模拟炼铁并检验反应后的气体。下列说法正确的是 ( ) A.应先加热Fe2O3再通入CO B.气体通过乙装置后可直接排放 C.停止加热后继续通入CO,能防止乙中液体倒吸 D.甲中的现象是固体的颜色由红棕色逐渐变为银白色 答案:C 5. 用3 000 t含氧化铁80%的赤铁矿,理论上可以炼出含铁96%的生铁的质量是( ) A.1 166 t B.1 750 t C.1 810 t D.1 944 t 解析:设理论上可以炼出含铁96%的生铁的质量为x。 Fe2O3+3CO2Fe+3CO2 160 112 3 000 t×80% 96%x
x =1 750 t 答案:B 6. 工业炼铁可利用一氧化碳与氧化铁反应。若要生产含铁97%的生铁231 t,需含氧化铁80%的赤铁矿石的质量最接近( ) A. 224 t B. 280 t C. 320 t D. 400 t 解析:231 t生铁中含铁的质量是231 t×97%≈224 t。 设该厂需含氧化铁80%的赤铁矿石的质量为x。
3CO+Fe2O32Fe+3CO2 160 112 80%×x 224 t x=400 t 答案:D 7. 如图为高炉冶铁、炼钢并用生产的钢来探究白铜成分的流程图。(已知硫酸镍的化学式为NiSO4) (1)用高炉冶铁的主要反应原理是 (用化学方程式表示)。 (2)分析流程图,三脱装置中发生反应的基本反应类型是 。 (3)向精炼炉中吹入氩气使钢水循环流动,各成分均匀混合,相当于化学实验中 (填一种仪器的名称)的作用。 (4)铁与镍相比,铁的金属活动性 (填“>”“=”或“<”)镍,判断依据是 (用化学方程式表示)。 (5)通过以上信息,得出白铜的成分是 ,其硬度比纯铜 (填“大”或“小”)。 答案:(1)3CO+Fe2O32Fe+3CO2(或4CO+Fe3O43Fe+4CO2) (2)化合反应 (3)玻璃棒 (4)> Fe+NiSO4Ni+FeSO4 (5)铜、镍 大 板书设计 第八单元 金属和金属材料 课题3 金属资源的利用和保护 第1课时 铁的冶炼 一、铁的冶炼 1.金属资源概况 2.炼铁 (1)CO还原Fe2O3的实验 实验现象:红色粉末逐渐变黑,澄清石灰水变浑浊,导管口有蓝色火焰。 (2)工业炼铁 ①设备:高炉。 ②原料:铁矿石、焦炭、石灰石、空气等。 ③原理:3CO+Fe2O32Fe+3CO2。 3.有关杂质问题的计算 |
人教版九年级下册课题 3 金属资源的利用和保护课文ppt课件: 这是一份人教版九年级下册课题 3 金属资源的利用和保护课文ppt课件,文件包含金属资源的利用和保护第1课时pptx、金属资源的利用和保护第2课时pptx、一氧化碳还原氧化铁的计算pptx、实验演示一氧化碳还原氧化铁mp4、无处不在的金属材料mp4、金属资源保护mp4、钢铁生锈mp4、铁制品锈蚀条件的探究mp4、铁生锈的条件mp4等9份课件配套教学资源,其中PPT共61页, 欢迎下载使用。
人教版九年级下册课题 3 金属资源的利用和保护课堂教学课件ppt: 这是一份人教版九年级下册课题 3 金属资源的利用和保护课堂教学课件ppt,共20页。PPT课件主要包含了钪Sc,镧La,铈Ce,镨Pr,钕Nd,钷Pm,钐Sm,铕Eu,钆Gd,铽Tb等内容,欢迎下载使用。
初中化学人教版九年级下册第八单元 金属和金属材料课题 3 金属资源的利用和保护优质ppt课件: 这是一份初中化学人教版九年级下册第八单元 金属和金属材料课题 3 金属资源的利用和保护优质ppt课件,文件包含第2课时金属资源保护ppt、第八单元课题3《金属资源的利用和保护》第2课时pptx、第八单元课题3docx等3份课件配套教学资源,其中PPT共43页, 欢迎下载使用。













