
















化学九年级下册课题1 常见的酸和碱公开课ppt课件
展开第十单元 酸和碱
课题1 常见的酸和碱
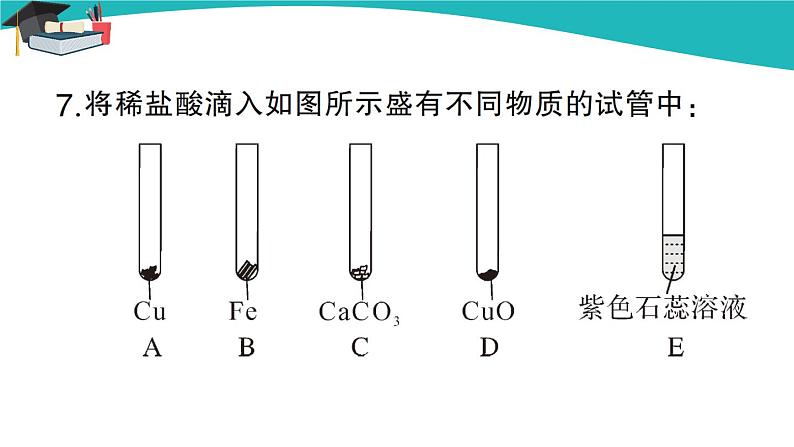
设计说明 [来源:Z.Com][ 本课题的教学内容分为三部分:第一部分,酸碱指示剂。认识酸、碱能与指示剂反应的性质,从而初步体现酸和碱作为不同类物质具有不同的性质,使学生对酸和碱的性质有一些初步的了解。第二部分,酸和碱的性质与用途。具体介绍几种常见酸和碱的性质、用途等,并通过学生总结的方式,简单归纳几种酸和碱各自具有的相似化学性质。关于酸和碱的腐蚀性可以结合浓硫酸、烧碱等介绍给学生。第三部分,酸和碱的共性。通过酸和碱导电性的实验,从微观的角度来说明酸和碱为什么会各自具有一些共同的性质。 对于酸和碱的知识,内容零散、细碎,难于记忆。涉及物质种类、名称、物质的化学式、化学方程式和反应类型等,这些内容会给学生的学习、理解、记忆带来一定的困难。必须将这些零散的知识纳入合理有效的系统中,运用归纳、对比等方法找到知识的共性与规律,既要从组成与结构上认识这类物质的特点,又要认识这类物质的共性和每种物质的特性,帮助学生形成学习“一类物质”的方法,提升学生的学习能力,为今后学习元素化合物知识打下基础。 教学目标 【知识与技能】 1.认识紫色石蕊、酚酞这两种酸碱指示剂,知道浓硫酸和浓盐酸的物理性质。 2.知道浓硫酸的特性,知道常见酸的主要化学性质。 3.知道氢氧化钠、氢氧化钙主要的物理性质和用途。 4.知道常见碱的相似化学性质。 5.了解酸、碱具有通性的原因。 【过程与方法】 1.会用酸碱指示剂检验溶液的酸碱性。 2.能运用酸、碱的通性分析实际问题。 3.能运用实验的方法获取信息,运用比较概括的方法对获取的信息进行加工。 4.能够从微观角度解释碱具有相似化学性质的原因,进一步巩固从个别到一般、从宏观到微观的思维方法。 【情感、态度与价值观】 1.通过对酸和碱性质与用途的学习,使学生认识化学在生活中的意义,培养学生热爱化学的情感。 2.通过对酸和碱化学通性的学习,培养学生的辩证思维方法。 重点难点 教学重点 1.运用酸碱指示剂检验溶液的酸碱性。 2.浓硫酸的强腐蚀性。 3.酸的化学性质。 4.氢氧化钠、氢氧化钙的物理性质与用途,碱的相似化学性质。 教学难点 1.浓硫酸的稀释。 2.根据实验归纳酸、碱的化学性质。 教学方法 1.通过学生的探究实验,引导学生正确推理,了解酸碱指示剂、酸碱的性质。 2.通过对比分析,归纳出酸碱的通性以及具有通性的微观本质。 教具、学具 1.计算机多媒体教学系统、CAI课件等。 2.仪器:玻璃棒、烧杯、试管、胶头滴管、点滴板等。 3.药品:浓硫酸、浓盐酸、稀盐酸、稀硫酸、白醋、苹果汁、NaOH与Ca(OH)2固体及溶液、紫色石蕊溶液、酚酞溶液、蒸馏水和乙醇、二氧化碳气体、带锈的铁钉、各小组准备的花和果实等。 授课时数 4课时 第3课时 常见酸的化学性质 教学过程 回顾思考 1.浓盐酸具有强烈的挥发性,在空气中打开盛有浓盐酸的瓶盖,在瓶口处会产生 ,在空气中长期敞口放置的浓盐酸,其溶质质量分数会 (填“变小”或“变大”)。 答案:白雾 变小 2.稀释浓硫酸时,应将 沿烧杯壁缓慢地注入盛有 的烧杯里,用 不断搅动。如果不慎将浓硫酸沾到皮肤或衣服上,应立即 ,然后涂上3%~5%的 溶液。 答案:浓硫酸 水 玻璃棒 用大量水冲洗 碳酸氢钠 导入新课 通过前面的学习我们已经知道,酸可以跟许多物质发生反应。我们以稀盐酸酸和稀硫酸为例,下面我们通过实验来探究酸的化学性质的相似性。 讲授新课 三、酸的化学性质 【实验探究】 (1)酸与指示剂的作用:在白色点滴板上进行实验,并观察现象。
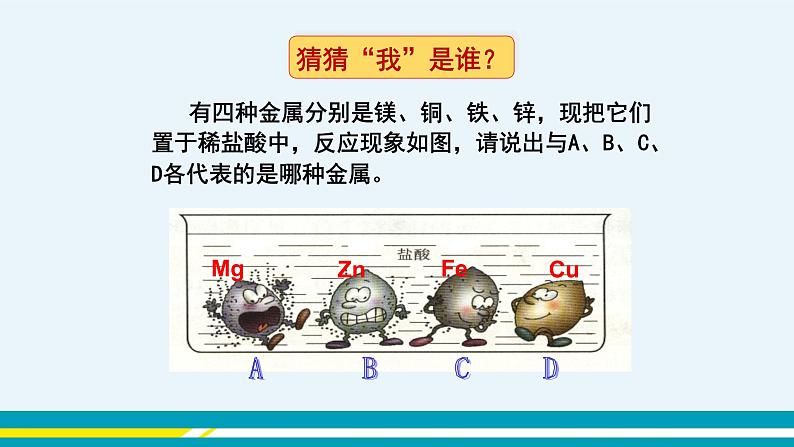
【实验结论】酸能使紫色石蕊溶液变红色,不能使酚酞溶液变色。 (2)酸与金属的反应 【教师提问】你还记得第八单元所学的几种金属分别与稀盐酸或稀硫酸的反应吗? 【多媒体展示】教师播放视频《探究实验——酸与较活泼金属反应》。 【教师提问】有四种金属分别是镁、铜、铁、锌,现把它们置于稀盐酸中,反应现象如图,请说出与A、B、C、D各代表的是哪种金属? 【参考答案】Mg Zn Fe Cu 【归纳总结】
上述反应都会生成氢气,另一生成物是金属离子和酸根离子构成的化合物。 (3)酸与金属氧化物反应 在盛有稀盐酸和稀硫酸的试管里分别放入一根生锈的铁钉,过一会儿取出铁钉,用水清洗干净,铁钉表面和溶液颜色有什么变化?
温馨提示:1.稀盐酸、稀硫酸具有一定的腐蚀性,使用时要十分小心,防止沾到皮肤上;2.如果不说明用量,液体取1~2 mL为宜。 【学生讨论】(1)上面反应的生成物有什么共同之处? (2)利用上面的反应可以清除金属制品表面的锈,除锈时能否将金属制品长时间浸在酸中?为什么? 【学生回答】 (1)上述反应的生成物之一都是水,另一种生成物都是金属离子与酸根离子构成的化合物(盐)。 (2)不能长时间浸入酸中,因为酸会与金属继续反应,造成金属制品腐蚀。 【教师提问】根据以上实验和讨论,你能归纳出盐酸、硫酸等酸有哪些相似的化学性质吗? 【归纳总结】酸的化学性质 (1)酸能使紫色石蕊溶液变红色,无色酚酞溶液遇酸不变色。 (2)酸能与活泼金属反应生成该金属的化合物和氢气。 (3)酸能与某些金属氧化物反应生成该金属的化合物和水。 课堂小结 本节课我们知道了酸具有一些通性,如酸能使紫色石蕊溶液变红色,无色酚酞溶液遇酸不变色;酸能与活泼金属反应生成该金属的化合物和氢气;酸能与某些金属氧化物反应生成该金属的化合物和水。 当堂达标 1.下列关于酸的说法错误的是( ) A.浓硫酸具有吸水性,浓盐酸具有挥发性 B.稀盐酸和稀硫酸都可用于金属除锈 C.稀盐酸能够使紫色石蕊溶液和无色酚酞溶液变红色 D.稀硫酸能够与活泼金属反应制取氢气 答案:C 2.下列物质中,不能用金属跟稀酸反应直接制得的是( ) A.硫酸锌 B.氯化镁 C.氯化铜 D.硫酸铝 答案:C 3.下列物质与稀盐酸反应的化学方程式正确的是( ) A.CaCO3+2HClCaCl2+H2O+CO2↑ B.2Fe+6HCl2FeCl3+3H2↑ C.Cu+2HClCuCl2+H2↑ D.Fe2O3+4HCl2FeCl2+3H2O 答案:A 4.小明想除去卫生间瓷砖上的铁锈痕迹,在用清水洗涤之前,他从家中选择了一种最合适的物质对铁锈进行处理,这种物质是( ) A.汽油 B.食盐水 C.白醋 D.米酒 答案:C 5.将生锈的铁钉放在盐酸中,最先看到的现象是铁锈逐渐溶解,溶液由无色变成黄色,反应的化学方程式为 ,当时间稍长时,又看到有气泡产生,其反应的化学方程式为 。 答案:Fe2O3+6HCl2FeCl3+3H2O Fe+2HClFeCl2+H2↑ 板书设计 第十单元 酸和碱 课题1 常见的酸和碱 第3课时 常见酸的化学性质 三、酸的化学性质 1.酸能使紫色石蕊溶液变红色,无色酚酞溶液遇酸不变色。 2.酸能与活泼金属反应生成该金属的化合物和氢气。 3.酸能与某些金属氧化物反应生成该金属的化合物和水
|
2021学年课题1 常见的酸和碱课堂教学ppt课件: 这是一份2021学年课题1 常见的酸和碱课堂教学ppt课件
2021学年课题1 常见的酸和碱一等奖课件ppt: 这是一份2021学年课题1 常见的酸和碱一等奖课件ppt,文件包含第4课时常见的碱及其化学性质ppt、第十单元课题1《常见的酸和碱》第4课时pptx、第十单元课题1docx等3份课件配套教学资源,其中PPT共48页, 欢迎下载使用。
人教版九年级下册第十单元 酸和碱课题1 常见的酸和碱精品ppt课件: 这是一份人教版九年级下册第十单元 酸和碱课题1 常见的酸和碱精品ppt课件,文件包含第2课时几种常见的酸及浓硫酸的腐蚀性ppt、第十单元课题1《常见的酸和碱》第2课时pptx、第十单元课题1docx等3份课件配套教学资源,其中PPT共30页, 欢迎下载使用。













