


化学反应的限度PPT课件免费下载2023
展开一、【课程地主要内容】
在工业生产和实验室中,人们会遇到各种各样的可逆反应,如合成氨的反应:
研究表明,可逆反应在适当条件下进行一段时间后一定会达到化学平衡状态。给定条件下,可逆反应达到化学平衡状态是反应所能达到的最大程度,即该反应的限度。
N2(g) + 3H2(g) 2NH3(g)
如何定量地描述化学反应的限度呢?
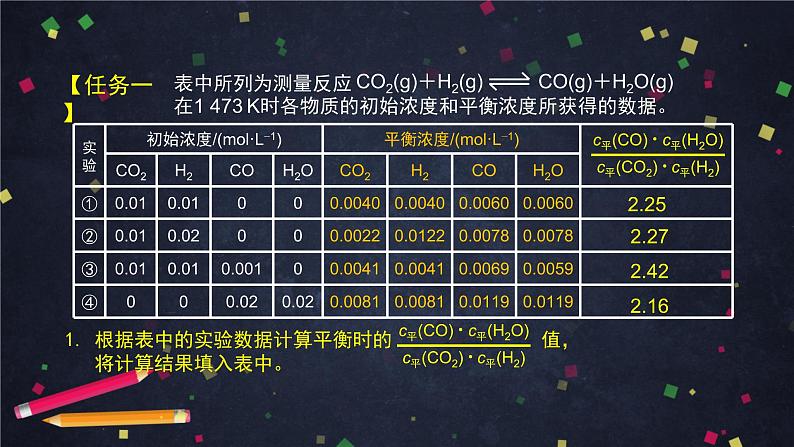
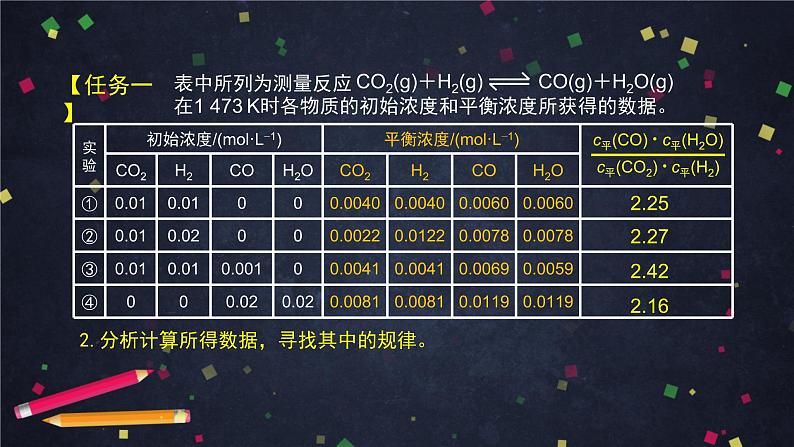
表中所列为测量反应 在1 473 K时各物质的初始浓度和平衡浓度所获得的数据。
CO2(g)+H2(g) CO(g)+H2O(g)
根据表中的实验数据计算平衡时的 值, 将计算结果填入表中。
2.分析计算所得数据,寻找其中的规律。
(1)温度为 1 473 K,平衡时, 为常数;
(2)该常数与反应的起始浓度大小无关;
(3)该常数与正向建立还是逆向建立平衡无关, 即与平衡建立的过程无关。
通过分析上述反应的实验数据和计算结果,得出以下结论:
1 473 K 时,密闭容器内发生如下反应:
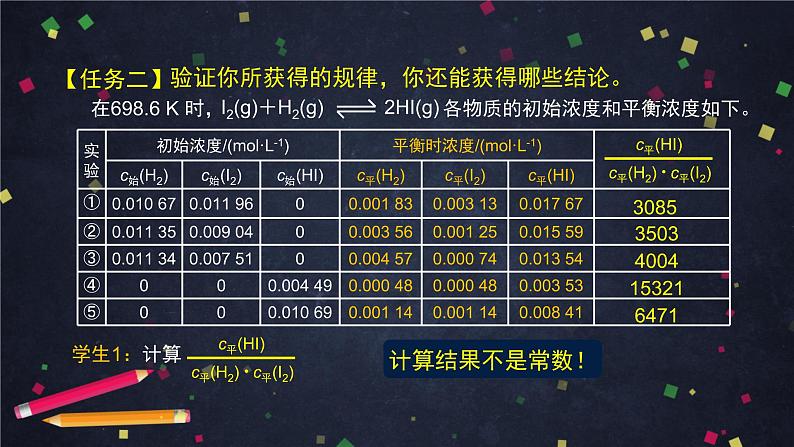
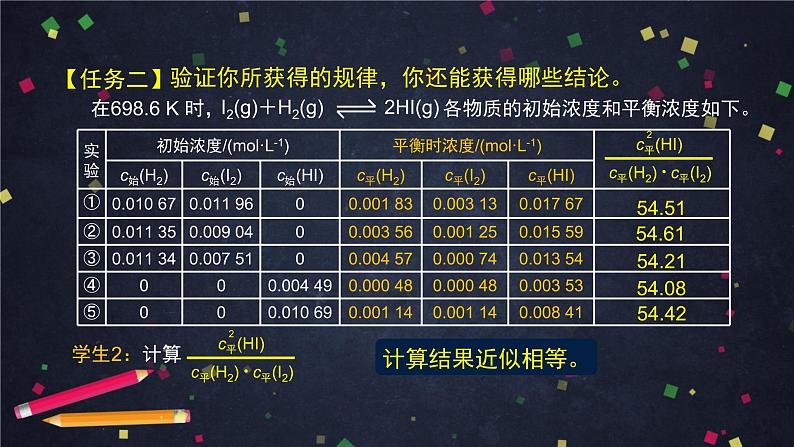
在698.6 K 时, 各物质的初始浓度和平衡浓度如下。
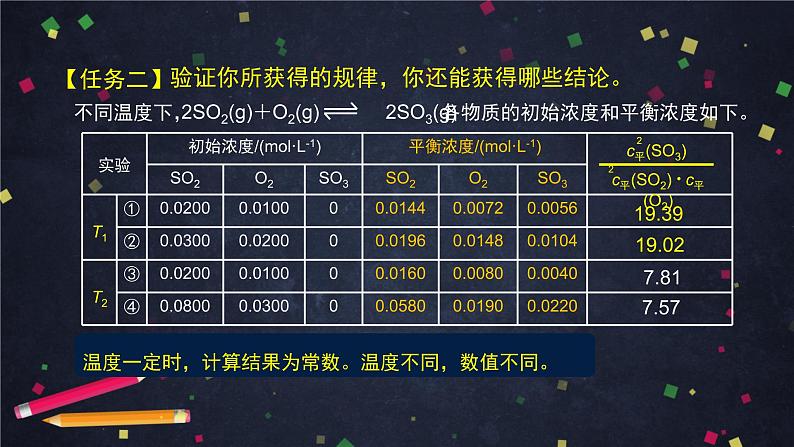
验证你所获得的规律,你还能获得哪些结论。
35034004153216471
学生1:计算 的值。
学生2:计算 的值。
不同温度下, 各物质的初始浓度和平衡浓度如下。
2SO2(g)+O2(g) 2SO3(g)
温度一定时,计算结果为常数。温度不同,数值不同。
二、【拓展学习】
一、化学平衡常数 1.定义 在一定温度时,当一个可逆反应达到平衡状态时,生成物平衡浓度的幂之积与反应物平衡浓度的幂之积的比值是一个常数,这个常数称为化学平衡常数(简称平衡常数)。
在研究了大量实验的基础上,人们总结出可以用化学平衡常数来定量描述化学反应的限度。
3.化学平衡常数的影响因素
一个反应的化学平衡常数的大小只与温度有关,与反应物或生成物的浓度无关。
化学平衡常数只受温度的影响!
1. 写出下表中各反应的平衡常数表达式,并写出后三个反应的K 的单位。
N2(g) + H2(g) NH3(g) N2(g)+3H2(g) 2NH3(g) 2NH3(g) N2(g)+3H2(g)
FeO(s)+CO(g) Fe(s)+CO2(g)
AgCl (s) Ag+ (aq)+Cl−(aq)
(ml ∙ L−1)2
在某温度下,合成氨反应在达平衡时,各物质的浓度分别是c平(N2)=0.04 mI·L−1,c平(H2)= 1.00 mI·L−1 .c平( NH3) = 0.04 mI·L−1 ,求下列反应的K值。
N2(g) + H2(g) NH3(g) N2(g)+3H2(g) 2NH3(g) 2NH3(g) N2(g)+3H2(g)
3. 结合以上分析,讨论下面的问题。
(1)对于一个反应,其平衡常数的表达式和平衡常数的数值是唯一的吗?
平衡常数表达式与化学方程式的书写方式有关。
(2)分析K 的单位与反应的化学方程式之间存在什么关系。
平衡常数的单位也与化学方程式的书写方式相对应。
三、【思考与探究】
谈谈你对化学反应限度的认识?
化学反应限度用平衡常数K 表达。影响化学平衡常数的因素为温度。压强、浓度不影响化学反应限度。对于同一个反应,同一种书写方式:温度一定,采用不同的投料方式,将达到不同的平衡状态,对应同一个K 值。对于同一个反应,不同的书写方式:平衡常数的表达式不同,同一温度下,K 值不同。
分析不同反应的K 值,你认为K 值大小与反应进行的程度存在怎样的关系?
化学平衡常数可定量地衡量化学反应进行的程度。K 值越大,表示反应正向进行的程度越大。
如果反应的平衡常数的数值在105左右,通常认为反应可进行得比较完全,相反,如果一个反应的平衡常数数值在10-5左右,则认为这个反应很难进行。
4.化学平衡常数的意义
(1)判断反应进行的程度:
K 值越大,表示反应正向进行的程度越大。
如果按②和③的起始浓度投料,对应的状态是平衡状态吗?如果不是,请分别判断反应将向哪个方向进行?
【任务五】 1 473 K 时,密闭容器内发生如下反应:
温度一定,K 为一常数
(2)判断可逆反应是否达到化学平衡状态
(3)预测反应进行的方向
原电池PPT课件免费下载2023: 人教版 (2019)高中化学选择性必修1课文《原电池》,完整版PPT课件免费下载,优秀PPT背景图搭配,精美的免费ppt模板。轻松备课,欢迎免费下载使用。
氮的固定PPT课件免费下载2023: 苏教版 (2019)高中化学必修 第二册课文《氮的固定》,完整版PPT课件免费下载,优秀PPT背景图搭配,精美的免费ppt模板。轻松备课,欢迎免费下载使用。
电离平衡PPT课件免费下载2023: 人教版 (2019)高中化学选择性必修1课文《电离平衡》,完整版PPT课件免费下载,优秀PPT背景图搭配,精美的免费ppt模板。轻松备课,欢迎免费下载使用。













