



人教版九年级下册课题1 常见的酸和碱课前预习课件ppt
展开氨水NH3·H2O无色液体
注意;不能干燥酸性气体: (HCl、CO2、SO2、H2S等)
不能干燥酸性气体: HCl、CO2、SO2等
②易潮解,称量氢氧化钠时,不能放在纸上称量,应放在玻璃器皿中
③保存氢氧化钠要密封。
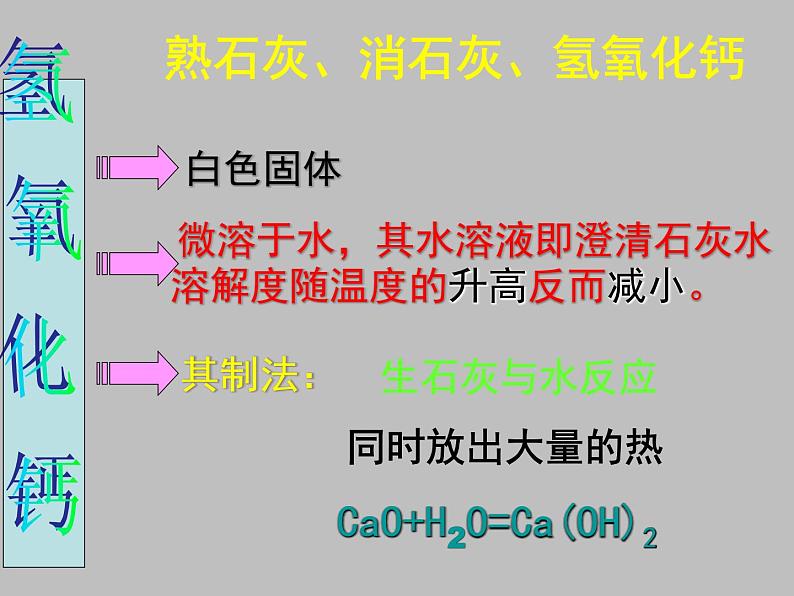
微溶于水,其水溶液即澄清石灰水
CaO+H2O=Ca(OH)2
熟石灰、消石灰、氢氧化钙
溶解度随温度的升高反而减小。
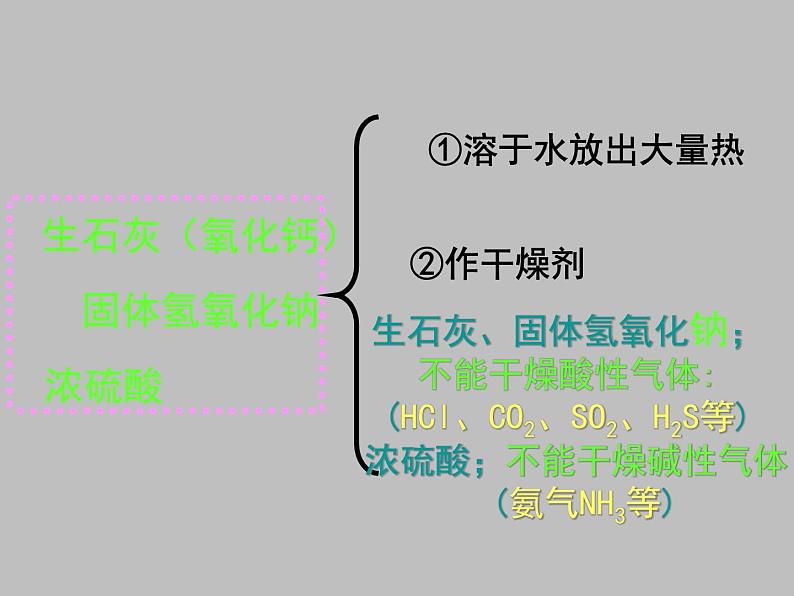
生石灰、固体氢氧化钠;不能干燥酸性气体: (HCl、CO2、SO2、H2S等)
浓硫酸;不能干燥碱性气体: (氨气NH3等)
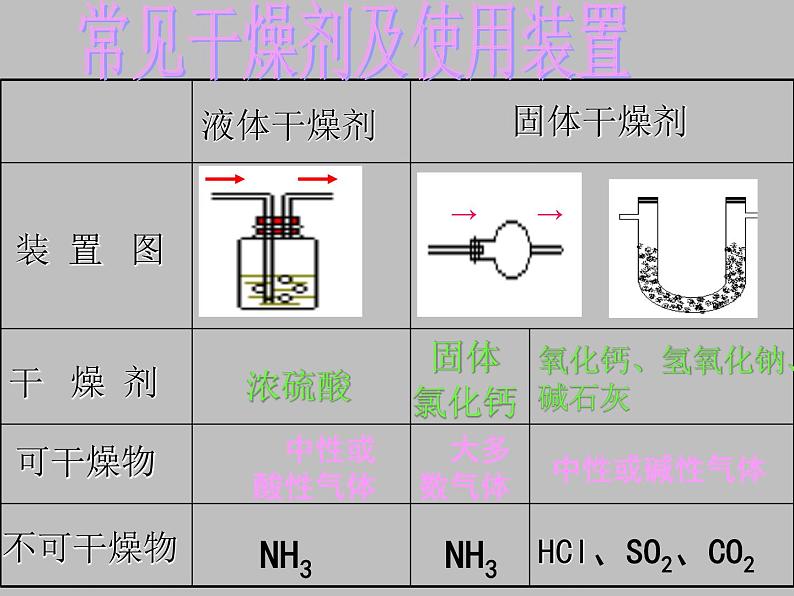
固体 氯化钙
氧化钙、氢氧化钠、碱石灰
HCl、SO2、CO2
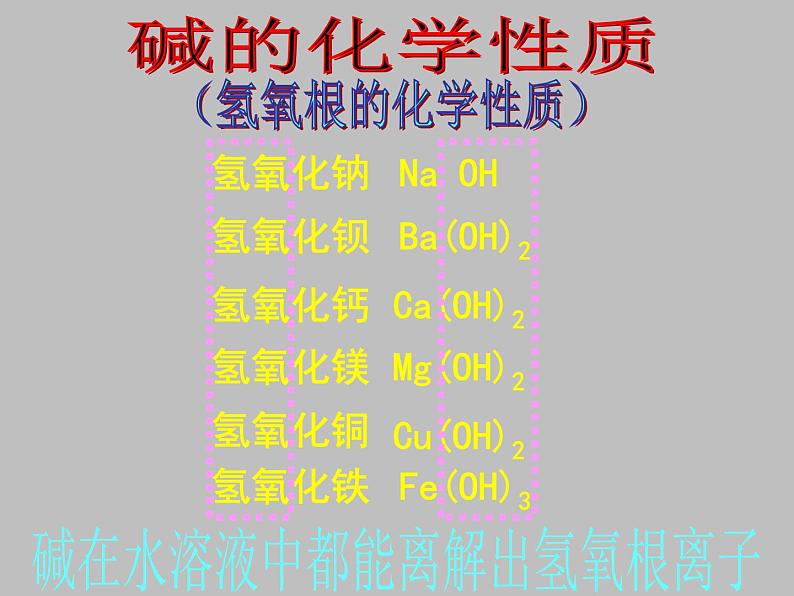
碱在水溶液中都能离解出氢氧根离子
酚酞 酸无碱红
碱+非金属氧化物=盐+水
CO2 + Ca(OH)2 =CaCO3+H2O
CO2 + 2 NaOH = Na2CO3 +H2O
SO2 +2 NaOH =Na2SO3+H2O
SO2 + Ca(OH)2 =CaSO3+H2O
SO3 +2 NaOH =Na2SO4+H2O
SO3 + Ba(OH)2 =BaSO4+H2O
(2)碱+非金属氧化物=盐+水
上述反应均不是复分解反应
2HCl + Ca(OH)2 =CaCl2+2H2O
H2SO4+2 NaOH =Na2SO4+2H2O
HNO3 + NaOH =NaNO3+H2O
2HNO3 + Ca(OH)2 =Ca(NO3)2+2H2O
2HCl + Ba(OH)2 =BaCl2+2H2O
H2SO4+ Ba(OH)2 =BaSO4+2H2O
(3)碱 + 酸 = 盐 + 水
碱 + 酸 = 盐 + 水
酸和碱生成盐和水的反应
二、中和反应在实际中的应用
植物需要在一定酸碱性的土壤中生长,
但近年来由于不合理使用化肥,或酸雨的形成,破坏土壤的酸碱性,不利于植物的生长,
应怎样去改变酸性土壤?
能用生石灰代替熟石灰吗?为什么?
因为 CaO + H2O == Ca(OH)2
某硫酸厂排出的废水中含有硫酸等杂质,严重危害当地的生态环境,你会怎样处理这些废水呢?
应在排放前用碱性物质(例如熟石灰)进行中和处理。
你能写出化学方程式吗?
Ca(OH)2 + H2 SO4 == CaSO4 + 2H2O
Al(OH)3 + 3HCl==AlCl3 + 3H2O
(4)碱与某些盐反应:
生成物中要有沉淀、气体或水
3Ba(OH)2+2FeCl3=2Fe(OH)3+3BaCl2
2NaOH + CuSO4=Cu(OH)2 +Na2SO4
2KOH + CuSO4 =Cu(OH)2 + K2SO4
Ba(OH)2+CuSO4=Cu(OH)2+BaSO4
用 途
(1)二氧化碳使澄清的石灰水变浑浊
(2)久置在空气中的澄清石灰水变质
(3)长久盛装澄清石灰水的试剂瓶内有一层白膜。
(4)用石灰水刷过的墙壁很快变硬
CO 2 + Ca(OH)2 =CaCO3+H2O
1、如何检验二氧化碳气体?写出化学方程式。
2、除去一氧化碳中的二氧化碳,用什么吸收好?写出相应的化学方程式。
3、如何鉴别氢氧化钠与澄清石灰水?
CO2 +2 NaOH =Na2CO3+H2O
1.碱溶液有相似的化学性质的原因是碱溶液中都含有( ) A.氢离子 B.氢氧根离子 C.金属离子 D.酸根离子
2.用一种试剂(或试纸)就能一次性把Ca(OH)2、NaCl、HCl三种溶液区别开,这种试剂(或试纸)是 ( ) A. 酚酞试液 B.紫色石蕊试液 C.水
4.保存NaOH溶液时,下列方法中不正确的是( ) A.不避光 B.玻璃瓶配玻璃塞 C.塑料瓶装 D.密封
6.某些食品的包装袋内有一个装有白色颗粒状固体的小纸袋,上面写有“干燥剂,主要成分为生石灰,请勿食用”等字样,回答下列问题:⑴ 生石灰可作干燥剂理由(化学方程式)⑵ “请勿食用”是因为干燥剂食用后对人体有什么危害作用?
3.下列物质中常用来改良土壤酸性的是( ) A.石灰石 B.熟石灰 C.干冰 D.烧碱
5.欲除去NaOH溶液中的Na2CO3杂质,可选用下列试剂中的( ) A.稀盐酸 B.CaCl2溶液 C.CO2气体 D.澄清石灰水
如: CO2 、SO2 、 SO3、P2O5 等。
如:K2O 、Na2 O、 CaO、MgO 等。
如:CO 、NO2 NO、等。
三、溶液酸碱度的表示法-pH
1、如何检验溶液的酸碱性?
2、如何比较酸、碱性相对强弱呢?即溶液的酸碱度呢?
PH值——溶液酸、碱度的表示法 ,用数值表示,数值的取值范围为[0……14]
1、pH值与溶液酸、碱性的关系:
pH值> 7,溶液呈碱性;
pH值= 7,溶液呈中性 ;
pH值< 7,溶液呈酸性;
2、pH值与溶液酸、碱度的关系:
pH值越大,碱性越强;
pH值越小,酸性越强;
(二)测定pH值的方法:用pH试纸
1、用pH试纸测定pH的方法:
在白瓷板或玻璃片上放一小片试纸,将被测液滴到试纸上,把试纸显示的颜色与标准比色卡比较,即可得出被测液的pH。
(1)测定几种酸或碱的稀溶液的pH。
碱溶液的浓度越大; pH值越大
酸溶液的浓度越大, pH值越小
pH值与同一酸、同一碱浓度的关系:
(2)测定生活中一些物质的pH,说明它们的酸碱性。
酸与酸性,碱与碱性的关系:
酸一定呈酸性,但呈酸性的溶液不一定是酸
如: K2CO3 (草木灰)、Na2CO3、NaHCO3不是碱,但呈碱性。
如:NaHSO4不是酸,但呈酸性;
碱一定呈碱性,但呈碱性的溶液不一定是碱
1、在硫酸铜溶液中滴加氢氧化钠溶液。2、在氯化铁溶液中滴加氢氧化钠溶液。3、在碳酸钠溶液中滴加石灰水。4、在硫酸铜溶液中滴加石灰水。
CuSO4 + 2NaOH = Cu(OH)2↓+ Na2SO4
FeCl3 + 3NaOH = Fe(OH)3↓+ 3NaCl
Na2CO3 + Ca(OH)2 = CaCO3↓+ 2NaOH
CuSO4 + Ca(OH)2 = Cu(OH)2↓+ CaSO4
(4)能与某些盐反应碱溶液 + 盐溶液 → 新盐 + 新碱CuSO4 +Ca(OH)2 =Cu(OH)2↓+ CaSO4;CuSO4 + 2NaOH = Na2SO4 + Cu(OH)2↓ Ca(OH)2 + Na2CO3==2NaOH + CaCO3↓
思考:碱和盐的反应有什么用途?
化学九年级下册课题1 常见的酸和碱评课ppt课件: 这是一份化学九年级下册课题1 常见的酸和碱评课ppt课件,共43页。PPT课件主要包含了变蓝色,变红色,不变色,自制指示剂原料,浅红色,变黄色,黄绿色,淡红色,变绿色,浅紫色等内容,欢迎下载使用。
人教版九年级下册课题1 常见的酸和碱示范课ppt课件: 这是一份人教版九年级下册课题1 常见的酸和碱示范课ppt课件,共60页。PPT课件主要包含了酸的化学性质,小结酸的化学性质,碱的化学性质,想一想,反馈练习等内容,欢迎下载使用。
人教版九年级下册第十单元 酸和碱课题1 常见的酸和碱集体备课课件ppt: 这是一份人教版九年级下册第十单元 酸和碱课题1 常见的酸和碱集体备课课件ppt,共27页。PPT课件主要包含了Q吸﹤Q放,生活中的碱,常见的碱,反应放出大量的热,课堂练习,自制指示剂原料等内容,欢迎下载使用。














