



高中化学鲁科版 (2019)选择性必修1第2节 化学能转化为电能——电池多媒体教学课件ppt
展开1.原电池的概念:将 能转化为 能的装置。
2.构成原电池的条件: (1)自发进行的 反应。 (2)电极 和电极 。 (3) 导体和 导体。
汽车等机动车往往需要配备电池,人造卫星、宇宙飞船等必须携带电池,人们在日常生活中也经常要使用电池……这些足以说明电池的重要作用。 现在,为满足人们生产和生活水平不断提高的需要,性能优异的新型电池相继出现,如锌银电池、锂电池、燃料电池等。那么,电池究竟是一种什么样的装置?他们在工作时,装置中发生了什么变化?
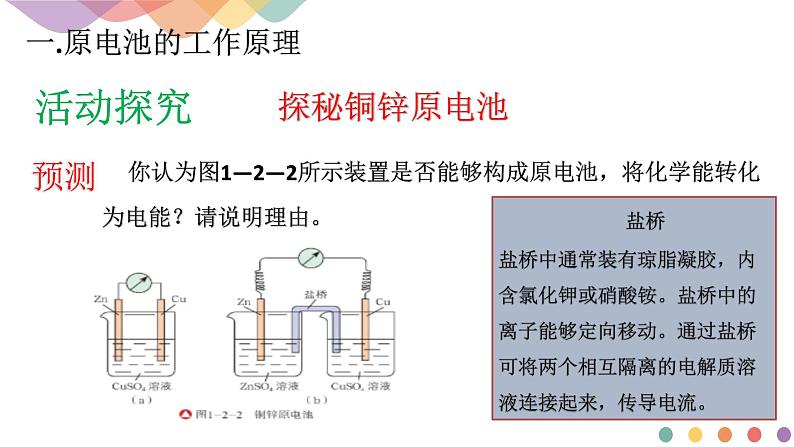
你认为图1—2—2所示装置是否能够构成原电池,将化学能转化为电能?请说明理由。
盐桥盐桥中通常装有琼脂凝胶,内含氯化钾或硝酸铵。盐桥中的离子能够定向移动。通过盐桥可将两个相互隔离的电解质溶液连接起来,传导电流。
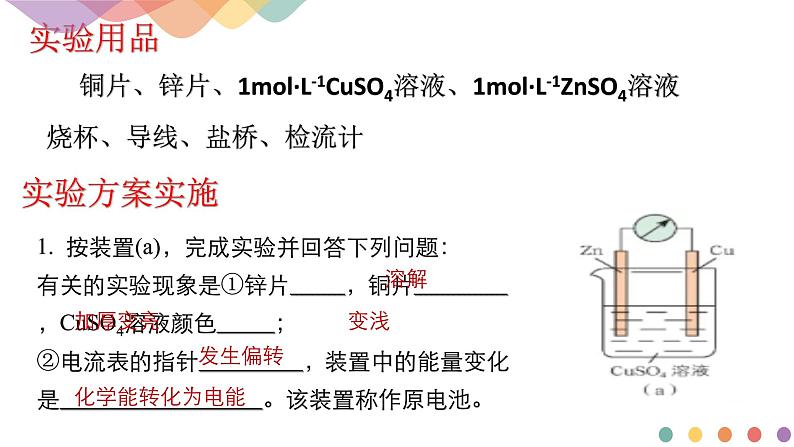
铜片、锌片、1ml·L-1CuSO4溶液、1ml·L-1ZnSO4溶液烧杯、导线、盐桥、检流计
1. 按装置(a),完成实验并回答下列问题:有关的实验现象是①锌片 ,铜片 ,CuSO4溶液颜色 ;②电流表的指针 ,装置中的能量变化是 。该装置称作原电池。
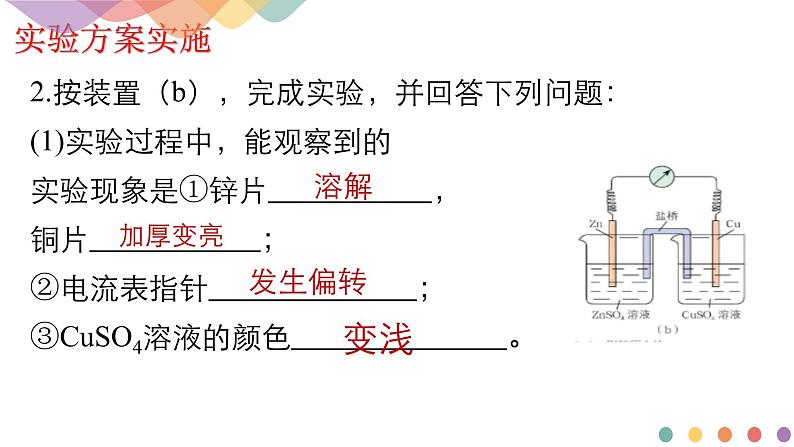
2.按装置(b),完成实验,并回答下列问题:(1)实验过程中,能观察到的实验现象是①锌片 ,铜片 ;②电流表指针 ;③CuSO4溶液的颜色 。
锌片溶解,质量减轻;铜片加厚变亮,硫酸铜溶液颜色变浅,电流表指针发生偏转。
未插盐桥,无明显现象;插入盐桥,锌片溶解,铜片加厚变亮,硫酸铜溶液颜色变浅,电流表指针发生偏转。
两套装置,检流计指针均发生偏转,说明均有电流产生,即发生了化学能转化为电能的过程,都形成了原电池。
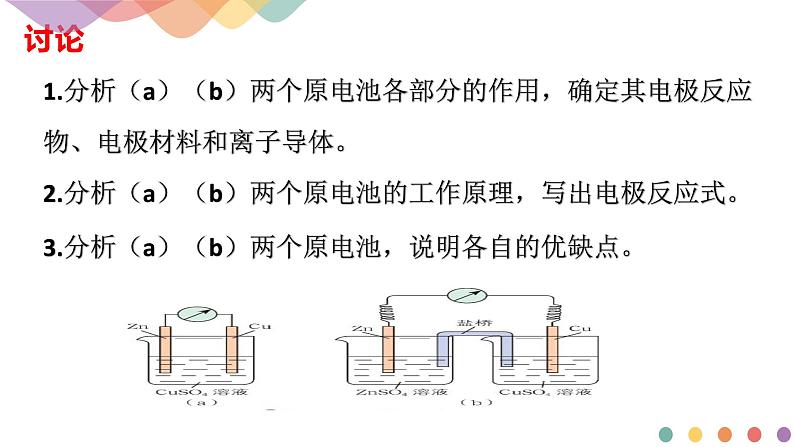
1.分析(a)(b)两个原电池各部分的作用,确定其电极反应物、电极材料和离子导体。
2.分析(a)(b)两个原电池的工作原理,写出电极反应式。
3.分析(a)(b)两个原电池,说明各自的优缺点。
负极:Zn、正极:Cu
CuSO4溶液ZnSO4溶液、盐桥
负极:Zn、正极:CuSO4
(a)(b)两个原电池各部分的作用
负极:Zn-2e-=Zn2+
正极:Cu2++2e-=Cu
总反应:Zn+Cu2+=Zn2++Cu
两个原电池的工作原理及电极反应式。
若用温度计测量溶液的温度,发现(a)装置溶液的温度略有升高,而(b)装置溶液的温度不变,试分析原因是什么?
(a)装置中,锌片和硫酸铜溶液直接接触,还有Cu2+直接在锌电极上得电子被还原,部分化学能转化成热能。(b)装置中锌片和CuSO4溶液没有直接基础,CuSO4溶液中的Cu2+不能移向锌片得电子被还原。
相同点:氧化还原反应原理;两个电极及电极反应;都能产生电流; 外电路均是电子的定向移动, 内电路均是离子的定向移动。
不同点:单液电池Zn和Cu2+直接接触,两个半反应在同一区域进行, 能量转化率低,电流强度弱不稳定,持续时间短。 双液电池Zn和Cu2+不直接接触,两个半反应在不同区域进行, 能量转化率高,电流强度大稳定,持续时间长。
Zn+Cu2+=Zn2++Cu
Zn-2e-=Zn2+
Cu2++2e-=Cu
电极反应(半反应)
在原电池中,氧化还原反应是在两个电极上分别进行的。每个电极上或是发生失去电子的变化,或是发生获得电子的变化,分别相当于氧化还原反应的一半,这种反应称为半反应。
可以表示电极上物质的变化情况以及电子的转移情况的式子。
在电极上进行的半反应。
原电池的两个电极反应组成电池的总反应。
原电池原理是将氧化反应和还原反应分开进行,还原剂在负极上失去电子发生氧化反应,电子通过导线流向正极,氧化剂在正极上得到电子发生还原反应。
正极得电子数目=负极失电子数目
判断右边原电池的正、负极,并写出电极反应式。
负极: Cu - 2e- = Cu2+正极: 2Fe3+ + 2e- = 2Fe2+
Cu + 2Fe3+ = Cu2+ + 2Fe2+
根据化合价升降判断正负极
1.简单原电池电极方程式的写法
Cu+2FeCl3 = CuCl2 +2FeCl2
将反应Cu+2FeCl3=2FeCl2+CuCl2 设计成双液盐桥电池
2.简单盐桥原电池设计
根据氧化还原反应电子转移判断电极反应
根据电极反应确定合适的电极材料和电解质溶液
如图所示的原电池装置,X、Y为两电极,电解质溶液为稀硫酸,外电路中的电子流向如图所示,对此装置的下列说法正确的是 ( )A.外电路的电流方向为:X→外电路→YB.若两电极分别为Zn和石墨棒,则X为石墨棒,Y为ZnC.若两电极都是金属,则它们的活动性为X>YD.X极上发生的是还原反应,Y极上发生的是氧化反应
【解析】由图可知,电子的流动方向是X→外电路→Y,则电流的方向就为Y→外电路→X;X为原电池的负极,Y为正极,X的活动性比Y的强;X极应发生氧化反应,Y极应发生还原反应。
不活泼金属或非金属导体
1.原电池电极(正极、负极)的判断依据有多种。试填写下表:
2.有一纽扣电池,其电极分别为Zn和Ag2O,以KOH溶液为电解质溶液,电池的总反应为Zn+Ag2O+H2O===2Ag+Zn(OH)2。(1)Zn发生____反应,是___极,电极反应式是________________________。(2)Ag2O发生_ __反应,是___极,电极反应式是____________________ 。
Zn+2OH-2e-===Zn(OH)2
Ag2O+2e-+H2O===2Ag+2OH-
已知总反应式,书写电极反应式(1)分析化合价,确定正极、负极的反应物与反应产物。(2)在电极反应式的左边写出得失电子数,使得失电子守恒。(3)根据质量守恒配平电极反应式。(4)复杂电极反应式=总反应式-简单的电极反应式。
鲁科版 (2019)选择性必修1第2节 化学能转化为电能——电池说课课件ppt: 这是一份鲁科版 (2019)选择性必修1<a href="/hx/tb_c4002574_t3/?tag_id=26" target="_blank">第2节 化学能转化为电能——电池说课课件ppt</a>,共22页。PPT课件主要包含了电解质溶液,原电池的工作原理,还原反应,氧化反应,原电池的形成条件,原电池的应用,设计原电池,原电池正负极的判断,活泼的金属,阳离子移向等内容,欢迎下载使用。
高中化学第一节 原电池评课课件ppt: 这是一份高中化学第一节 原电池评课课件ppt,共17页。
高中化学第二单元 化学能与电能的转化公开课课件ppt: 这是一份高中化学第二单元 化学能与电能的转化公开课课件ppt,共31页。PPT课件主要包含了化学能与电能的转化,主要内容,主要特点,学习方法,两极一液一连线,习题探究,作业布置等内容,欢迎下载使用。













