




初中化学鲁教版 (五四制)九年级全册2 金属的化学性质授课课件ppt
展开1.认识镁、铝、铁、铜等常见金属与氧气的反应;2.认识常见金属与盐酸、硫酸及某些盐溶液的置换反应,并能解释日常生活中的一些化学现象;3.能说出常见金属的活动性顺序,并能利用该规律判断置换反应。
回顾与讨论:请同学们回忆过去的学习中,我们了解了哪几种金属和氧气的反应?你还能回忆起这些反应的现象吗?
镁条和铝片在常温下就能和空气中的氧气反应4Al+3O2=2Al2O3 2Mg+O2=2MgO铁丝和铜片在高温时能与氧气反应:金不能和氧气反应综合上述信息可知:1.大多数金属都能与_______反应,反应难易程度 ______。2.金属的性质: _______ 较活泼,________次之, ____不活泼。
资料:16世纪中叶,瑞士化学家帕拉塞斯和17世纪的一些化学家,都发现了有些金属和酸可以反应生成一种可燃性气体——氢气,并发现不同的金属反应的剧烈程度不同。活动与探究:如何判断Fe、Cu、Al的活动性
B组:在点滴板中分别放入铁片、铜片、铝片。然后,分别向其中加入一些稀硫酸。
A组:在点滴板中分别放入铁片、铜片、铝片。然后,分别向其中加入一些盐酸。
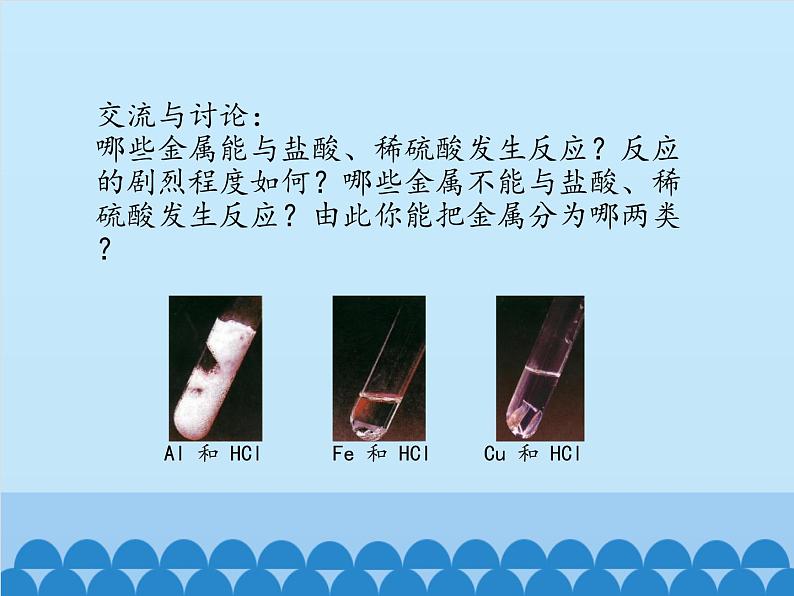
交流与讨论:哪些金属能与盐酸、稀硫酸发生反应?反应的剧烈程度如何?哪些金属不能与盐酸、稀硫酸发生反应?由此你能把金属分为哪两类?
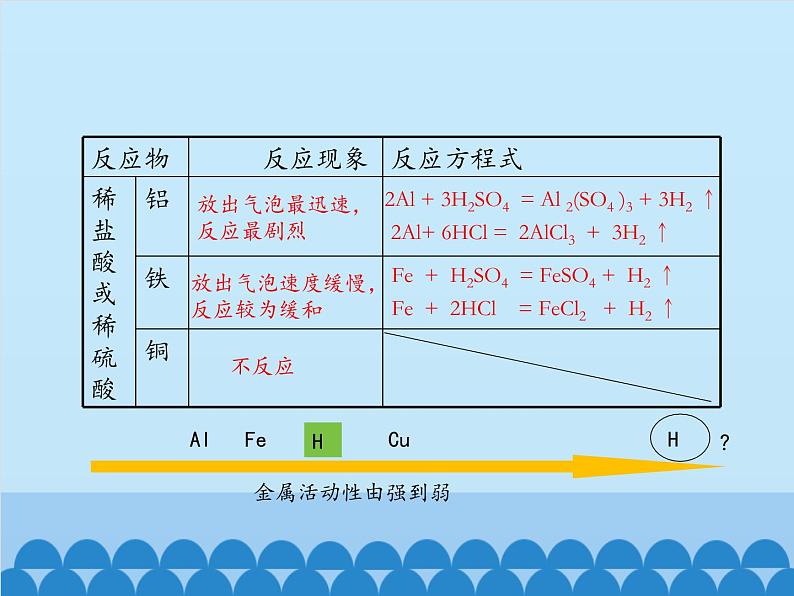
2Al + 3H2SO4 = Al 2(SO4 )3 + 3H2 ↑
2Al+ 6HCl = 2AlCl3 + 3H2 ↑
Fe + H2SO4 = FeSO4 + H2 ↑
Fe + 2HCl = FeCl2 + H2 ↑
放出气泡最迅速,反应最剧烈
放出气泡速度缓慢,反应较为缓和
金属活动性顺序:在金属活动性顺序中:1、金属的位置越靠前,它的活动性越强。2、位于氢前面的金属能置换出盐酸、稀硫酸中的氢。
分析铁、铝与盐酸反应的化学方程式由一种单质与一种化合物反应,生成另一种单质和另一种化合物的反应叫作置换反应。
2Al + 6HCl = 2AlCl3 + 3H2 ↑Fe + 2HCl = FeCl2 + H2 ↑
单质 化合物 化合物 单质
许多金属能与酸溶液反应,那么金属能否与盐溶液发生反应呢?
三、金属与盐溶液的反应
Fe+CuSO4 =Cu+ FeSO4
现象:铁钉的表面覆盖一层红色物质,溶液由蓝色变成浅绿色。
金属活动性顺序中,位于前面的金属能把位于后面的金属从它们化合物的溶液里置换出来。
铜丝表面覆盖一层银白色物质,溶液由无色逐渐变为蓝色
Cu+2AgNO3 =2Ag+Cu(NO3)2
1.下列物质中,不能在氧气中燃烧的是( )A.金箔 B.铁丝 C.木炭 D.氢气 2.遇稀盐酸不产生气体的是( )A.铁片 B.铜片C.铝片 D.镁条
3.下列化学变化属于置换反应的有:(1)CO+Fe2O3→Fe+CO2(2)C+Fe2O3 → Fe+CO2(3)H2O2 → H2O+O2(4)Fe+AgNO3 → Fe(NO3)2+Ag
4.X、Y、Z是三种金属,根据下列有关化学方程式可知,三种金属的活动性顺序是( )①Z + YSO4 = ZSO4+ Y ②X + YSO4 = XSO4+ Y③X + H2SO4 = XSO4+ H2 ↑ ④Z + H2SO4不反应A. Z>X>Y B. Z>Y>X C. X>Y>Z D. X>Z>Y
2021学年第四单元 金属2 金属的化学性质示范课ppt课件: 这是一份2021学年第四单元 金属2 金属的化学性质示范课ppt课件,共53页。PPT课件主要包含了真相只有一个,测密度,测硬度,元素守恒,金属+酸,盐+氢气,酸会腐蚀金属,制氢气,合理利用,趋利避害等内容,欢迎下载使用。
初中化学鲁教版 (五四制)九年级全册2 金属的化学性质备课课件ppt: 这是一份初中化学鲁教版 (五四制)九年级全册2 金属的化学性质备课课件ppt,共25页。PPT课件主要包含了动脑筋,--金属活动性顺序,动脑回顾,一金属与氧气的反应,交流展示,倒入稀盐酸HCl,结论金属活动性,CuAg,不反应,猜想正确等内容,欢迎下载使用。
初中化学鲁教版 (五四制)九年级全册2 金属的化学性质教学演示课件ppt: 这是一份初中化学鲁教版 (五四制)九年级全册2 金属的化学性质教学演示课件ppt,共16页。PPT课件主要包含了本节目录,学习目标,本节课的重难点,新课导入,金属与氧气反应,学习新课,自己动手哦,④实验现象,锌铁铜,无明显现象等内容,欢迎下载使用。













