






人教版九年级下册课题1 生活中常见的盐课前预习ppt课件
展开家庭中用于调味的盐——用作洗涤剂的盐——烘培面食用的盐——用作消毒剂的盐——工业有毒的盐——配制农药波尔多液的盐——建筑材料的盐——
Fe + CuSO4 == Cu + FeSO4
现象:铁的表面析出一层红色的物质,溶液由蓝色变成了浅绿色
金属的活动性:Fe>Cu
Cu + 2AgNO3 == 2Ag + Cu (NO3)2
现象:铜的表面析出一层银白色的物质,溶液由无色变成了蓝色
(1) 盐+金属 = 新盐+新金属
1.活泼的金属才能置换出不活泼的金属(前金换后金)
2.金属除K、Ca、Na以外的金属;
3.盐需可溶,且在溶液中进行;
4.当溶液中有两种不同金属阳离子都能被金属置换时,金属活动性顺序表中排位越靠后的金属越先被置换出来。
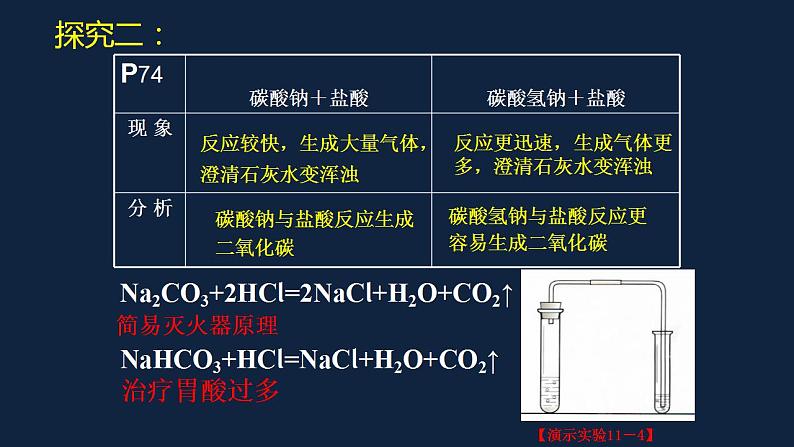
反应较快,生成大量气体,澄清石灰水变浑浊
反应更迅速,生成气体更多,澄清石灰水变浑浊
碳酸钠与盐酸反应生成二氧化碳
碳酸氢钠与盐酸反应更容易生成二氧化碳
Na2CO3+2HCl=2NaCl+H2O+CO2↑
NaHCO3+HCl=NaCl+H2O+CO2↑
自制汽水:取一个洗刷干净的汽水瓶,瓶里加入占容积80%的冷开水,再加入白糖及少量果味香精,然后加入2 g碳酸氢钠,搅拌溶解后,迅速加入2 g柠檬酸。并立即将瓶盖压紧,使生成的气体不能逸出,而溶解在水里。将瓶子放置在冰箱中降温。取出后,打开瓶盖就可以饮用。
性质:CaCO3 + 2HCl = CaCl2 + H2O + CO2 ↑
CaCO3 + 2HCl = CaCl2 + H2O + CO2↑
Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑NaHCO3 + HCl = NaCl + H2O + CO2↑
讨论:含CO32-的盐叫碳酸盐,含HCO3-的盐叫碳酸氢盐,你能总结出碳酸盐或碳酸氢盐与酸反应的规律吗?
思考:证明搜集到的物质是否含有碳酸盐
碳酸根离子(CO32-)及碳酸氢根离子(HCO3-)的检验:
取少量样品于试管中,滴加稀盐酸,若有气泡产生,将生成的气体通入澄清石灰水中,若石灰水变浑浊,则样品中含有CO32-或HCO3-
Ca(OH)2 + CO2 = CaCO3↓+ H2O
CaCO3+H2O+CO2=
CaCO3+H2O+CO2=Ca(HCO3)2
CaCO3+H2O+CO2=Ca(HCO3)2 Ca(HCO3)2 =CaCO3↓+H2O+CO2↑
知识拓展:水壶中水垢形成的原因
Ca(HCO3)2 =CaCO3↓+H2O+CO2↑
如何除去水壶中的水垢?
(2)盐 + 酸 = 新盐 + 新酸
配制硝酸银溶液时,绝不能用自来水,你知道其中的原理吗?
Cl2+H2O=HCl+HClO
HCl+AgNO3=AgCl↓+HNO3
BaCl2+H2SO4 =
HCl+AgNO3 = AgCl↓+HNO3
BaSO4↓+2HCl
向盛有少量碳酸钠溶液(Na2CO3)的试管中滴入澄清石灰水Ca(OH)2
(3)盐溶液与碱溶液反应
Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
碳酸钠与氢氧化钙反应生成不溶于水的碳酸钙,故出现浑浊(沉淀)
【注】此反应的意义:工业上用纯碱制烧碱
CuSO4+2NaOH=Cu(OH)2↓+Na2SO4
Cu(OH)2是一种蓝色沉淀
NaOH溶液中滴加FeCl3溶液
FeCl3+3NaOH=Fe(OH)3↓+3NaCl
Fe(OH)3是一种红褐色沉淀
NaOH溶液中滴加CuSO4溶液
(3)盐 + 碱 = 新盐 + 新碱
CuSO4+2NaOH=Na2SO4+Cu(OH)2↓
FeCl3+3NaOH=3NaCl+Fe(OH)3↓
条件:1.反应的盐和碱均可溶; 2. 至少有一种沉淀生成
人的汗液中含有氯化钠,法医做指纹鉴定时,常用硝酸银溶液喷洒指纹,经光照,马上会显示出黑色的指纹纹路,你知道其中的原理吗?
温馨提示:1.氯化银见光不稳定,易分解(2AgCl==2Ag+Cl2 ) 2.银粉成黑色,银块是银白色,指纹纹路是显黑色
思考:盐能不能与盐反应呢?
NaCl+AgNO3=AgCl↓+NaNO3
KCl+AgNO3=AgCl↓+KNO3
Cl-+Ag+=AgCl↓
取少量样品于试管中,滴加硝酸银溶液,若有白色沉淀产生,再滴加稀硝酸,沉淀不消失,则样品中含有Cl-
BaCl2+CuSO4=BaSO4↓+CuCl2
Ba2++SO42-=BaSO4↓
取少量样品于试管中,滴加Ba2+溶液(如Ba(NO3)2,若有白色沉淀产生,再滴加稀硝酸,沉淀不消失,则样品中含有SO42-
(4)盐 + 盐 = 新盐 + 新盐
条件:1.参加反应的盐和盐均可溶; 2.有沉淀生成即难溶性盐)
CaCl2+Na2CO3=
CaCO3↓+2NaCl
盐在溶液中表现出的化学性质总结如下:
硫酸盐不溶BaSO4( CaSO4 、Ag2SO4微溶)
碳酸盐只溶钾、钠、铵
溶于水的碱有:NH3.H2O 、 KOH、NaOH、 Ba(OH) 2 、 Ca(OH)2(微溶)
白色沉淀:碳酸钙 CaCO3 碳酸钡 BaCO3 硫酸钡 BaSO4 氯化银 AgCl 氢氧化镁 Mg(OH)2 蓝色沉淀:氢氧化铜 Cu(OH)2 红褐色沉淀:氢氧化铁 Fe(OH)3
(既不溶于水 也不溶于酸)
1.证明鸡蛋壳中含石灰石(CaCO3)的方法,是滴加( ),若有( )产生,就证明鸡蛋壳中含石灰石(CaCO3),有关化学方程式是________________________________
2.已知可溶性钡盐有毒,而在医院里做胃镜透视时,要用BaSO4造影,俗称“钡餐”,吃下BaSO4无毒是因为( )。但如果无意中误服了BaCO3则会引起中毒,这是因为(用化学方程式表示,下同)_______________________________________,误服后, 应立即用泻盐MgSO4解毒,这是因为_________________________________________
BaSO4不溶于水,也不与酸反应
BaCO3 + 2HCl = BaCl2 + H2O + CO2↑
BaCl2+MgSO4=BaSO4↓+MgCl2
请你鉴别三瓶失去标签的溶液NaClNa2SO4 Na2CO3
3.厨房里有两瓶白色固体,一瓶是食盐,一瓶是纯碱。想想看,我们能用哪些方法鉴别它们呢?
1、取样,加入适量盐酸
3、取样,加入适量澄清石灰水
2、取样,加入酚酞试液
4、取样,加入氯化钡溶液
4:在一条鱼虾绝迹的小河边,有四座工厂:甲、乙、丙、丁。他们排放的废液里,每厂只有碳酸钠、氯化铁、氢氧化钙、盐酸的一种。某中学环保小组对实现调查的情况如图。甲处的河水是乳白色的,乙处的河水是红褐色的,丙处的河水变清了,丁处的河水是清的,但有气泡产生。
请推测这四座工厂废液里的污染物
人教版九年级下册课题1 生活中常见的盐备课ppt课件: 这是一份人教版九年级下册课题1 生活中常见的盐备课ppt课件,共20页。PPT课件主要包含了课堂训练,几种常见离子的检验,①滴加硝酸钡现象,生成白色沉淀,②滴加稀硝酸现象,沉淀不溶解,①滴加硝酸银现象,复分解反应的概念,+CB等内容,欢迎下载使用。
九年级下册课题1 生活中常见的盐教案配套课件ppt: 这是一份九年级下册课题1 生活中常见的盐教案配套课件ppt,共21页。PPT课件主要包含了复分解反应的概念等内容,欢迎下载使用。
初中化学人教版九年级下册课题1 生活中常见的盐示范课课件ppt: 这是一份初中化学人教版九年级下册课题1 生活中常见的盐示范课课件ppt,共32页。PPT课件主要包含了学习目标,复分解反应的条件,海水晒盐,简答题,生成新盐和新酸,溶解性规律,AgCl不溶,复分解反应,CaCO3↓不溶,奇妙的石笋和钟乳石等内容,欢迎下载使用。













