



高中化学人教版 (2019)必修 第一册第四章 物质结构 元素周期律第二节 元素周期律教学课件ppt
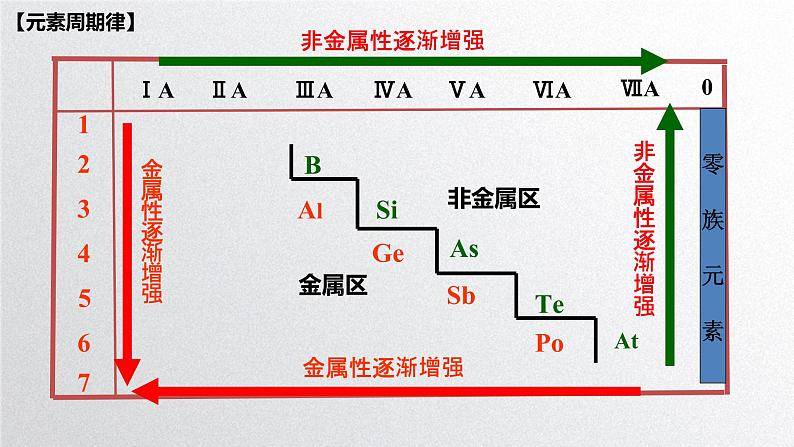
展开金属性逐渐增强
非金属性逐渐增强
1、证明金属性强弱的方法有:(1)单质与水(或酸)反应生成氢气的难易(金属性越强反应越容易)(2)最高价氧化物的水化物——氢氧化物的碱性强弱(金属性越强氢氧化物的碱性越强)
2、证明非金属性强弱的方法有:(1)单质与氢气反应生成气态氢化物的难易(非金属性越强反应越容易)(2)最高价氧化物的水化物的酸性强弱(非金属性越强酸性越强)(3)气态氢化物的稳定性(非金属性越强气态氢化物越稳定)
短周期主族元素中最高价氧化物的水化物酸性最强的是 。碱性最强的是 。气态氢化物稳定性最强的是 。
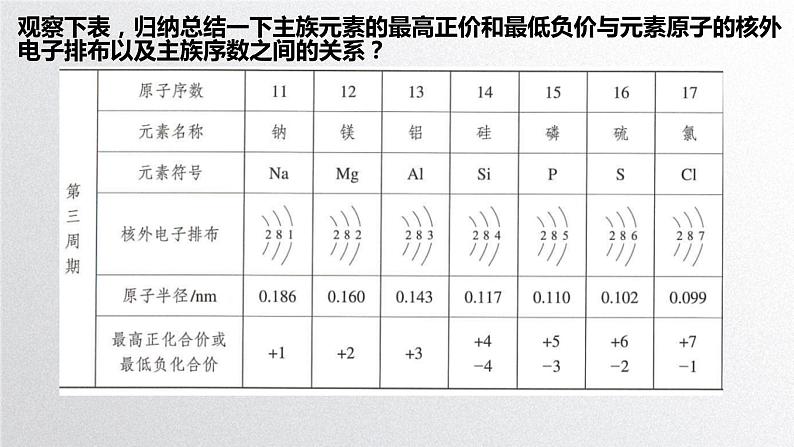
观察下表,归纳总结一下主族元素的最高正价和最低负价与元素原子的核外电子排布以及主族序数之间的关系?
3.元素化合价与元素在周期表中位置的关系(1)主族元素最高正化合价=_________ =_____________。(2)非金属元素的化合价①最高正价等于原子所能失去或偏移的_____________。②最低负价等于使其达到______ 稳定结构所需要得到的电子数。③最高正价与最低负价绝对值之和等于__。
【规律方法】短周期主族元素性质的特殊性:
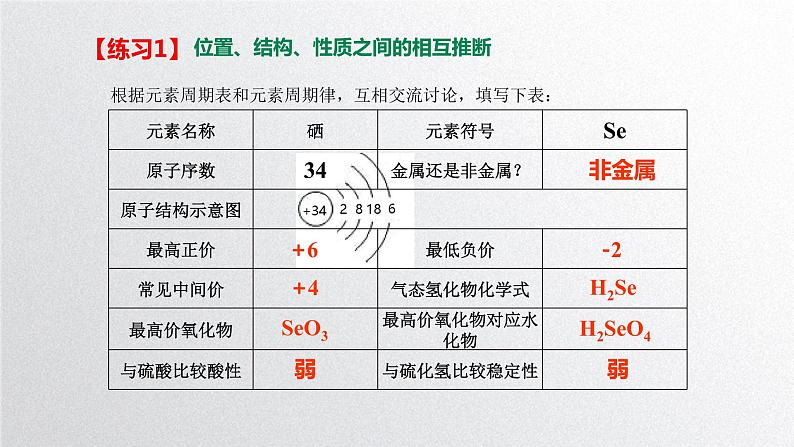
根据元素周期表和元素周期律,互相交流讨论,填写下表:
位置、结构、性质之间的相互推断
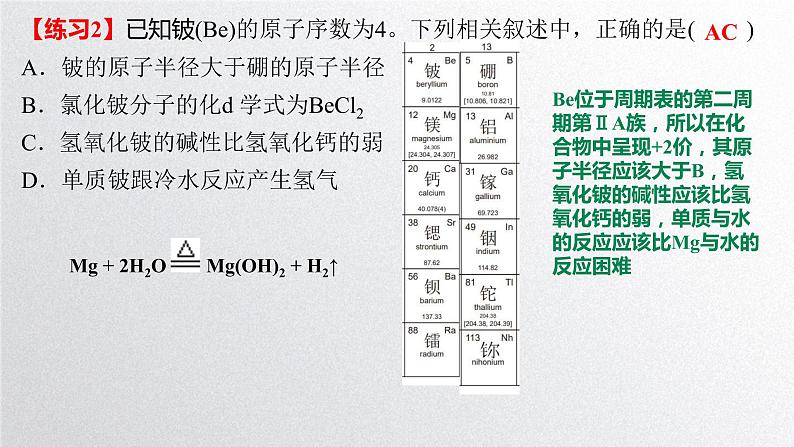
【练习2】已知铍(Be)的原子序数为4。下列相关叙述中,正确的是( )A.铍的原子半径大于硼的原子半径 B.氯化铍分子的化d 学式为BeCl2C.氢氧化铍的碱性比氢氧化钙的弱 D.单质铍跟冷水反应产生氢气
Be位于周期表的第二周期第ⅡA族,所以在化合物中呈现+2价,其原子半径应该大于B,氢氧化铍的碱性应该比氢氧化钙的弱,单质与水的反应应该比Mg与水的反应困难
【练习3】五种短周期元素的原子半径、最高正化合价及负化合价见下表
下列叙述正确的是 ( )A.L的金属性比M的金属性弱 B.Q、T两元素间可形成两性化合物C.T的单质是黄绿色气体 D.L、R两元素的简单离子的核外电子数可能相等
根据元素化合价可以直接得到R为S,T为O;再根据原子半径和化合价得到L、M、Q分别为Mg、Be、Al
二、元素周期表和元素周期律的应用(1)根据同周期、同主族元素性质的递变规律判断元素性质的_____ (或_____)。(2)应用于元素“位置—结构—性质”的相互推断。(3)预测新元素:为新元素的发现及预测它们的_______________ 提供线索。(4)寻找新物质
在周期表中金属和非金属的分界处可以找到半导体材料,如硅、锗、镓等
农药,目前世界上统一的英文名为pesticide—-“杀害药剂”,但实际上所谓的农药系指用于防治危害农林牧业生产的有害生物(害虫、害螨、线虫、病原菌、杂草及鼠等)。例如六六六农药等。
若要寻找新型农药的元素,应在元素周期表的什么位置?提示:元素周期表的右上角。
人工合成氨是科学史上的里程碑之一。一百多年来,工业合成氨需要高温高压的苛刻条件,而自然界的生物固氮是在常温常压下进行的。因此高效的人工模拟生物固氮成为催化科学领域的圣杯。若要研制新型的高效催化剂,应该在元素周期表的什么位置寻找合适的元素?提示:在过渡元素中寻找催化剂和耐高温、耐腐蚀的合金材料
1.元素周期表中,同一周期从左到右,金属性逐渐减弱,非金属性逐渐增强;同一主族自上而下,金属性逐渐增强,非金属性逐渐减弱。2.元素周期表中,第三周期中金属与非金属分界处的元素是铝(Al)和硅(Si)。3.常用作半导体材料的硅,在元素周期表中的位置是第三周期第ⅣA族。4、元素周期律的内容:元素的性质随着原子序数的递增而呈周期性的变化。5、元素周期律的实质:元素性质的周期性变化是元素原子的核外电子排布 周期性变化的必然结果。
1、X、Y、Z均是短周期元素,X、Y位于同一周期,X、Z的最低价离子分别为X2-和Z-,且Y+和Z-离子具有相同的电子层结构.下列说法正确的是( )A. 原子最外层电子数:X>Y>ZB. 对应气态氢化物的稳定性:X>ZC. 离子半径:X2->Y+>Z-D. 原子序数:X>Y>Z
X、Y、Z均是短周期元素,X、Z的最低价离子分别为X2-和Z-,则X为第ⅥA族元素,Z为ⅦA族元素;Y+和Z-具有相同的电子层结构,则Y在Z的下一周期,则Y为Na元素,Z为F元素,X、Y同周期,则X为S元素。
2、某主族元素R的最高正化合价与负化合价的代数和为4,下列有关叙述正确的是( ) A、R一定是第四周期元素 B、R的气态氢化物分子式为H2R C、R的气态氢化物比同周期其他元素的气态氢化物稳定 D、R的气态氢化物的水溶液显碱性
非金属元素的最高正价和最低负价的绝对值之和等于8,R的最高正化合价与负化合价的代数和为4,所以R的最高正价为+6,最低负价为-2,可以推断出R在第ⅥA族
3、四种短周期元素在周期表中的位置如图,其中只有M为金属元素。下列说法不正确的是( )A. Y的最高价氧化物对应水化物的酸性比X的弱B. Z位于元素周期表中第二周期,第ⅥA族C. X的气态氢化物的稳定性比Z的弱D. M的原子半径比Y的原子半径大
由四种短周期元素在元素周期表中的位置,可知Y、Z处于第二周期,M、X处于第三周期,其中只有M一种为金属元素,则M为Al,可推知X为Si,Y为N,Z为O。
【素养新思维】 4.我国著名化学家张青莲精确地测定了锗(Ge)、锌等九种元素的相对原子质量,得到的新值被作为国际新标准。已知锗的原子序数为32。回答下列问题:
(1)它位于元素周期表中第________周期________族。 (2)锗类似于铝,能溶于氢氧化钠溶液,其主要原因是________(填编号)。 ①它与硅位于同一主族②它与铝属于同一周期③它位于周期表中金属与非金属分界线附近(3)材料科学是目前全世界研究的热点,为了寻找催化剂,科学家应在元素周期表中某区域寻找元素组成材料,该区域是_________________。 A.左上角 B.右上角C.过渡元素D.金属与非金属分界线附近(4)氢化物的稳定性GeH4________CH4(填“>”或“<”),锗酸(H4GeO4)是________(填“难”或“易”)溶于水的________(填“强”或“弱”)酸。
化学必修 第一册第四章 物质结构 元素周期律第二节 元素周期律教学ppt课件: 这是一份化学必修 第一册第四章 物质结构 元素周期律第二节 元素周期律教学ppt课件,共20页。PPT课件主要包含了学习目标,课堂小结等内容,欢迎下载使用。
高中化学人教版 (2019)必修 第一册第二节 元素周期律教案配套课件ppt: 这是一份高中化学人教版 (2019)必修 第一册第二节 元素周期律教案配套课件ppt,共49页。
高中人教版 (2019)第二节 元素周期律教学课件ppt: 这是一份高中人教版 (2019)第二节 元素周期律教学课件ppt,共40页。PPT课件主要包含了自主预习·悟新知,非金属,主族序数,最外层电子数,寻找新物质,合作探究·提素养,问题生成,解题方法,1原子半径,元素周期表的应用等内容,欢迎下载使用。













