





高中化学人教版 (2019)必修 第一册第一节 物质的分类及转化优秀ppt课件
展开第一节 物质的分类及转化
第一章 物质及其变化
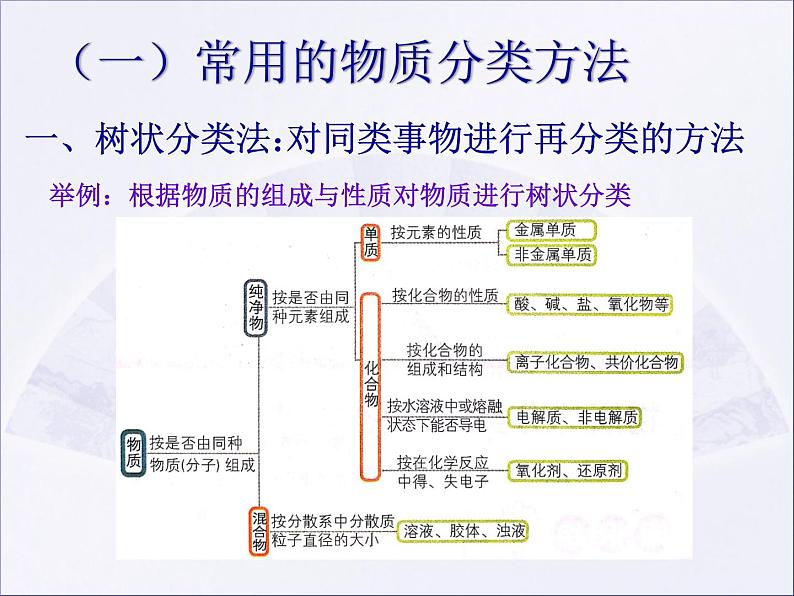
(一)常用的物质分类方法
对同类事物进行再分类的方法
根据物质的组成与性质对物质进行树状分类
在水溶液中电离产生的阳离子全部是H+的化合物。
、氢碘酸(HI)、氢溴酸(HBr)、高氯酸(HCIO4)
碳酸(H2CO3)、醋酸(CH3COOH)、磷酸(H3PO4)、氢硫酸(H2S)氢氟酸(HF)、硅酸(H2SiO3)、次氯酸(HClO)亚硫酸(H2SO3)、亚硝酸(HNO2)、草酸(H2C2O4)
在水溶液中电离产生的阴离子全部是OH-的化合物。
氢氧化钠、氢氧化钾、氢氧化钡、氢氧化钙
氢氧化铁、氢氧化亚铁、氢氧化铜、氢氧化镁、氢氧化铝、氨水
注意:六大强酸、四大强碱
在水溶液中电离产生金属阳离子(或NH4+)和酸根离子的化合物
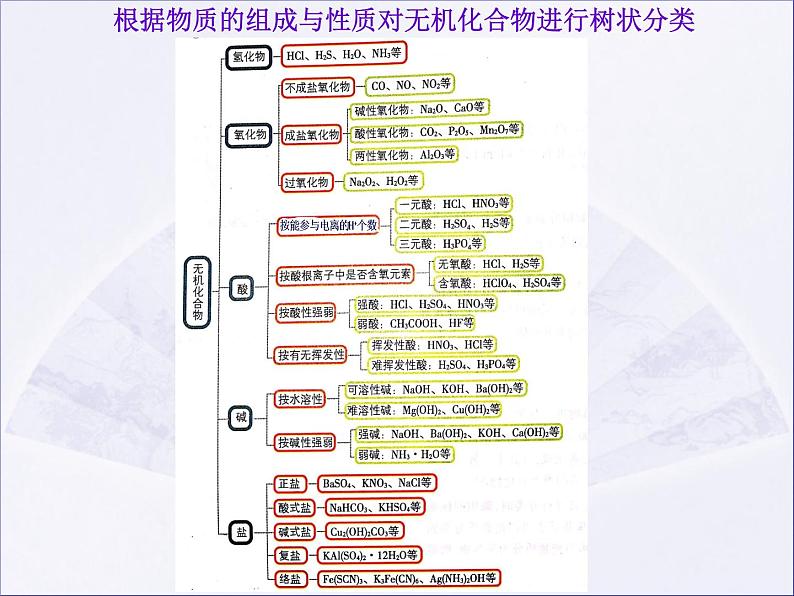
BaSO4、KNO3、NaCl、Na2SiO3、NaAlO2
NaHCO3、KHSO3、NaHSO4
Cu2(OH)2CO3
KAl(SO4)2 ·12H2O
Fe(SCN)3、K3Fe(CN)6、Ag(NH3)2OH
正盐:在水溶液中电离只产生一种阳离子和一种阴离子的盐
酸式盐:在水溶液中电离还能产生H+的盐
碱式盐:在水溶液中电离还能产生OH-的盐
复盐:在水溶液中电离产生两种或两种以上金属阳离子(或NH4+)的盐
根据物质的组成与性质对无机化合物进行树状分类
只含两种元素,且其中一种是氧元素
CO2、P2O5、Mn2O7
不成盐氧化物:既不能与酸反应,也不能与碱反应生成相应价态的盐和水的氧化物,所谓相应价态即指化合价不变
碱性氧化物:与酸反应只生成盐和水的氧化物
酸性氧化物:与碱反应只生成盐和水的氧化物
两性氧化物:与酸、碱都能反应,且都只生成盐和水的氧化物
注:碱性氧化物、酸性氧化物、两性氧化物都属于成盐氧化物
:含有O22-的氧化物
关于氧化物的几点说明:
1、碱性氧化物一定是金属氧化物,但金属氧化物不一定是碱性氧化物。例:Mn2O7为酸性氧化物,Al2O3为两性氧化物、Na2O2为过氧化物
2、酸性氧化物不一定是非金属氧化物,例如:Mn2O7; 非金属氧化物不一定是酸性氧化物,例如:CO、NO
3、酸性氧化物、碱性氧化物不一定都能与水反应生成相应的酸、碱。例:SiO2、CuO
下列物质属于混合物的是①水银 ②空气 ③氯酸钾 ④五氧化二磷 ⑤糖水 ⑥硫粉 ⑦氨气 ⑧盐酸A.①②⑤⑦ B.①②④⑥C.②⑤⑧ D.②③⑤
1、下列属于碱的是( )A. 乙醇 B.碳酸钠 C.氢氧化钙 D.碱式碳酸铜
2、下列属于酸的是( )A.HNO3 B.CaCO3 C.CO2 D.NaOH
1、下列属于酸性氧化物的是( )A.Na2CO3 B.Mn2O7 C.MgO D.NH3
2、下列属于碱性氧化物的是( )A.CO B.Fe2O3 C.Mn2O7 D.SiO2
1、FeSO4是补血剂的成分之一。FeSO4属于( ) A.酸 B.碱 C.盐 D.氧化物
2、下列不属于碳的同素异形体的是( )A.金刚石 B.二氧化碳 C.石墨 D.C60
二、交叉分类法:
从不同角度对物质进行分类
把一种(或多种)物质以粒子形式分散到另一种(或多种)物质中所形成的混合物,叫做分散系
分散系中被分散成粒子的物质,叫做分散质
另一种物质,叫做分散剂
按照分散质或分散剂所处的状态(气、液、固)划分,可有9种组合方式
3、分类:按照分散质粒子直径的大小:
胶体:1-100nm之间
胶体按照分散质划分:
分子胶体(高分子溶液):淀粉溶液粒子胶体:Fe(OH)3胶体、硅酸胶体
胶体按照分散剂划分:
液溶胶:Fe(OH)3胶体、鸡蛋清、牛奶、豆浆、果冻、肥皂水、墨水固溶胶:烟水晶、有色玻璃、大多数天然宝石气溶胶:烟、雾、云
巨大数目的分子集合体
高分子或许多分子集合体
5、胶体的性质、制备、提纯和应用
一束光通过胶体产生一条光亮的“通路”,这是由于胶体粒子对光线散射形成的
Fe(OH)3胶体制备:FeCl3饱和溶液滴入沸水中,且不能过量,不能长时间加热,不能搅拌。FeCl3+3H2O = Fe(OH)3(胶体)+3HCl
净水剂的使用(不加热)
胶粒较大不能透过半透膜,而较小的离子、分子可透过半透膜,用此法将胶体提纯
(1)指示剂:紫色石蕊试液——变红,酚酞——不变色
(2)能与活泼金属反应:2Al+6HCl=2AlCl3+3H2↑
(3)能与碱性氧化物反应:Na2O+2HCl=2NaCl+H2O
(4)能与碱反应:NaOH+HCl=NaCl+H2O
(5)能与某些盐反应:HCl+AgNO3=AgCl↓+HNO3
(1)指示剂:紫色石蕊试液——变蓝,酚酞——变红
(2)能与酸性氧化物反应:CO2+Ca(OH)2=CaCO3↓+H2O
(3)能与酸反应:Cu(OH)2+H2SO4=CuSO4+2H2O
(4)能与某些盐反应:CuSO4+2NaOH=Cu(OH)2↓+Na2SO4
(1)能与某些酸反应:2HCl+CaCO3=CaCl2+ H2O+CO2↑
(2)能与某些碱反应:FeCl3+3NH3·H2O=Fe(OH)3↓+3NH4Cl
(3)能与某些盐反应:CuSO4+BaCl2=CuCl2+BaSO4↓
(4)能与某些金属反应:Fe+CuCl2=FeCl2+Cu
注:酸、碱、盐的常见反应类型:复分解反应、置换反应
常见的四大基本反应类型:化合反应、分解反应、 置换反应、复分解反应
4、酸性氧化物的性质:
(1)能与水反应:H2O+CO2
(2)能与碱性氧化物反应:CaO+CO2=CaCO3
(3)能与碱反应:CO2+Ca(OH)2=CaCO3↓+H2O
(4)能与某些盐反应:CO2+CaCO3+H2O=Ca(HCO3)2
5、碱性氧化物的性质:
(1)能与水反应:H2O+CaO=Ca(OH)2
(2)能与酸性氧化物反应:Na2O+CO2=Na2CO3
(3)能与酸反应:MgO+2HCl=MgCl2+H2O
(4)能与某些盐反应: H2O+CaO+Na2CO3=CaCO3↓+2NaOH
(1)与非金属反应:2Mg+O2
(2)与酸反应:Fe+2HCl=FeCl2+H2↑ 2Al+6HCl=2AlCl3+3H2↑
(3)与盐反应:Fe+CuSO4=FeSO4+Cu 2Al+3CuSO4=Al2(SO4)3+3Cu
1、常见的转化方式 ——单质转化为盐
人教版 (2019)必修 第一册第一节 物质的分类及转化说课ppt课件: 这是一份人教版 (2019)必修 第一册第一节 物质的分类及转化说课ppt课件,共15页。PPT课件主要包含了物质的通性,+O2,盐+H2,金属氧化物,盐+金属,极活泼金属,较活泼金属,不活泼金属,金属的活动性顺序表,氧化物等内容,欢迎下载使用。
人教版 (2019)必修 第一册第三节 化学键公开课ppt课件: 这是一份人教版 (2019)必修 第一册第三节 化学键公开课ppt课件,共20页。PPT课件主要包含了成键微粒,阳离子,成键本质,静电吸引,静电排斥,成键条件,成键原因,存在范围,离子化合物,书写方法等内容,欢迎下载使用。
高中化学人教版 (2019)必修 第一册第二节 金属材料优秀ppt课件: 这是一份高中化学人教版 (2019)必修 第一册第二节 金属材料优秀ppt课件,文件包含32金属材料ppt、实验3-4铝和稀盐酸的反应mp4、实验3-5铝和氢氧化钠溶液的反应mp4、苏州现巨型大闸蟹建筑霸气凌人mp4等4份课件配套教学资源,其中PPT共16页, 欢迎下载使用。













