






高中化学人教版 (新课标) / 必修2 期末复习(详细)
展开原子序数 = 核电荷数 = 核内质子数(Z) =原子的核外电子数(e)
质量数(A)=质子数(Z) + 中子数(N) ≈该原子的相对原子质量 ≈该原子的摩尔质量(数值)
一、物质结构 元素周期律
由18O构成的水以及H2O与D2O各 0.2ml的质量分别是多少?
③m克该离子中的电子的物质的量:
④该离子形成的b克氧化物中质子的物质的量:
质子数相同,中子数不同的核素间的互称。
同种元素形成的不同单质。
练习:下列各组粒子中属于同位素的是 A.16O和18OB.O2和O3 C.H2和D2D.24Mg和24Na
元素的种类由 决定;元素化学性质的主要由 决定
短周期( )
长周期( )
主族( )
共7个,位于第1、2及13~17列
副族( )
共7个,位于第3~7及11、12列
第Ⅷ族( )
1个,包括第8、9、10三列
0族( )
含元素种数最多的族是 ,物质种数最多的族是 ,因为 。
最外层电子数 – 8 =
练习:某元素的一种核素中含有16个电子、16个中子,写出该核素的符号:
该元素在周期表中的位置是:
练习:下列各组微粒的质子数相等,电子数也相等的是: A.NH3、OH- B.HF、CH4 C.Na+、Mg2+ D.NH4+、H3O+
练习:在周期表中,金属和非金属分界线附近能找到: A.制农药的元素 B.作催化剂的元素 C.制半导体的元素 D.制耐高温合金材料的元素
1、元素周期律:元素的性质随着原子序数的递增而呈周期性的变化。
原子核外电子排布呈周期性变化
3、主族元素各性质的变化规律:
同周期最外层电子数从1~7
同周期原子半径逐渐减小
同主族最外层电子数相同
同主族原子半径逐渐增大
原子半径减小,非金属性逐渐增强
原子半径增大,金属性逐渐增强
同周期最高正价从+1~+7(第二周期特殊)从第IVA开始出现负价, – 4~ – 1
④元素金属性、非金属性:
同周期金属性减弱、非金属性增强
同主族元素主要化合价相同
金属无负价;O、F无正价
形成的简单离子中:金属只有阳离子; 非金属一般只有阴离子
同主族金属性增强、非金属性减弱
短周期中金属性最强的是 , 非金属性最强的是 。
4、元素金属性强弱的判断:
(1)单质与水或酸反应置换出氢气的难易;
(3)单质之间的相互置换;
(4)根据原电池正负极;
(5)根据元素周期表;
(6)根据阳离子氧化性强弱。
金属性:Na、Mg、Al
碱性:NaOH> Mg(OH)2>Al(OH)3
Fe+Cu2+=Fe2++Cu
Fe、Cu组成原电池时,Fe做负极
氧化性:Fe2+
(4)单质之间的相互置换。
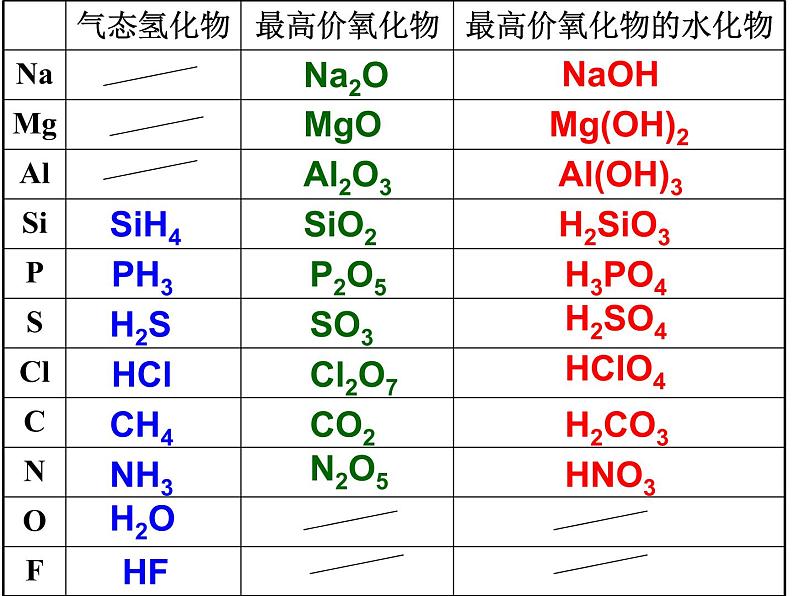
(2)气态氢化物的稳定性;
(1)非金属单质与氢气化合的难易程度;
(5)根据元素周期表。
非金属性:Cl、S
F2与H2黑暗处爆炸,Cl2与H2光照下爆炸
稳定性:HF> HCl>HBr>HI
酸性:HClO4>HBrO4>HIO4
HClO4>H2SO4
Cl2+2Br-=2Cl-+Br2
(6)根据阴离子还原性强弱。
还原性:I- >Br- >Cl-
练习:电子层数相同的三种元素X、Y、Z,已知其最高价氧化物对应的水化物的酸性强弱为:HXO4>H2YO4>H3ZO4。下列判断错误的是A.气态氢化物的稳定性:HX>H2Y>ZH3B.非金属性:X>Y>ZC.相对原子质量: X>Y>Z D.阴离子的失电子能力: X->Y2->Z3-
练习:某元素X的气态氢化物的化学式为H2X,下列叙述不正确的是 A.X原子最外层有6个电子 B.该元素最高价氧化物的水化物的化学式为HXO3 C.X一定是非金属元素 D.X元素的非金属性比F的强
练习:在一定条件下,RO3-与R-发生如下反应RO3-+5R-+6H+=3R2+3H2O,下列叙述正确的是 A.R是第VA族元素 B.R2在常温下一定是气体 C. RO3- 中的R元素只能被还原 D.R的氢化物的水溶液是强酸
练习:R元素气态氢化物的化学式为RH3,则其最高价氧化物的化学式为 A.R2O5 B.RO2 C.RO3 D.R2O7
2Na +2H2O = 2NaOH + H2↑
2K +2H2O = 2KOH + H2↑
2NaBr+Cl2=2NaCl+Br2
2KI+Br2=2KBr+I2
H2+X2 = 2HX
卤素单质之间的相互置换:(Cl-、Br-、I-的检验)
2KI+Cl2=2KCl+I2
用CCl4萃取反应后的溶液:CCl4层在下层,溶有溴时为橙色;溶有碘时为紫色。
2Br-+Cl2=2Cl-+Br2
2I-+Br2=2Br-+I2
2I-+Cl2=2Cl-+I2
都可与O2、Cl2等反应
都可与水反应,产物都是碱和氢气
与O2反应产物越来越复杂,Li只生成Li2O
硬度、密度小,熔、沸点低,银白色(Cs略带金色光泽)
密度逐渐增大(K反常);熔、沸点降低
与H2反应越来越剧烈;氢化物越来越不稳定
有颜色除F2外,在水中溶解度都不大
密度逐渐增大;熔、沸点升高;颜色逐渐加深
Na+、Mg2+、Al3+
HF、H2O、NH3、CH4
H3O+、NH4+OH-
9、电子层结构相同几种离子:aAn-、bBm-、 cCp+、dDq+存在以下几种关系:
m
aAn->bBm->cCp+>dDq+
练习:有aXm+与bYn-两种简单离子,它们的电子层结构相同,下列关系式或化学式中正确的是 ①a>b ②a=b+n+m ③ a+n=b+m ④ Y的氢化物化学式为HnY或YHn ⑤ X的氧化物化学式为XO A.① B.①②④ C.③ ⑤ D.②④
1、化学键存在于分子内的原子间
O= C= O
Na+、K+、Mg2+、Ca2+、Ba2+ 、NH4+等离子与其它阴离子形成的化学键一定是离子键。
存在于不同种非金属元素之间
存在于同种非金属元素之间
离子化合物:含离子键的化合物
2、离子化合物和共价化合物
共价化合物:化学键全部是共价键的化合物
强碱和大多数盐都属于离子化合物
含阴、阳离子,在熔融状态下或水溶液中都能电离、导电
不含阴、阳离子,在熔融状态下不电离、不导电,在水溶液中可能会电离、导电
练习:下列性质可证明某化合物中一定存在离子键的是 A.有较高的熔点 B.水溶液能导电 C.熔融状态能导电 D.可溶于水
练习:下列叙述不正确的是 A.离子化合物中一定含有离子键B.离子化合物中也可能含有共价键C.共价化合物中只有共价键D.共价化合物中也可能含有离子键
双原子单质分子中只含非极性键
3、电子式、结构式的书写
大多数共价化合物中只含极性键
某些共价化合物中同时含极性键和非极性键
由K+、Ca2+、 Na+、 Mg2+、Ba2+、NH4+与简单阴离子形成的离子化合物中只含离子键
既含离子键又含非极性键
含有原子团的离子化合物中既含离子键又含共价键
NH4Cl中既含离子键又含极性键
练习:下列叙述正确的是 A.离子化合物一定含有金属元素 B.只含非金属元素的化合物一定是共价化合物 C.存在不含化学键的分子 D.CH4存在非极性共价键
练习:在共价化合物中元素化合价有正负的主要原因是 A.电子有得失 B.共用电子对有偏移 C.电子既有得失又有偏移 D.有金属元素存在
练习:具有非极性键的离子化合物是 A.NaOH B.Na2O2 C.NaCl D.H2O2
练习:下列分子中,所有原子的最外层均为8电子结构的是 A.BeCl2 B.H2S C.PCl3 D.CH4
考点:用电子式表示化合物的形成过程
用电子式表示NaCl 、MgCl2、 HCl、 CO2的形成过程:
4、分子间作用力(范德华力)和氢键:
存在于分子之间,不是化学键
离子化合物熔化时要破坏离子键;共价化合物熔化时大多破坏的是分子间作用力。
分子间作用力影响物质的物理性质:
组成和结构相似的物质相对分子质量越大,分子间作用力越大,物质的熔、沸点越高。但HF、H2O、NH3由于氢键的存在,使得熔、沸点在同主族氢化物中最高。
练习1:指出下列过程中被破坏是微粒间的哪种相互作用:A. 碘升华 B. 溴蒸气被木炭吸C. NaCl溶于水 D. HCl气体溶于水E. 干冰熔化 F. NaBr溶液中通入 Cl2G. Na2O2溶于水 H. CO2溶于水
考试时间:90分钟(100分)
化学反应中能量变化的主要原因是 .
有新物质生成,同时伴随着能量的变化。
一个确定的化学反应在发生过程中是吸收能量还是放出能量,决定于_____________________________________。
反应物的总能量与生成物的总能量的相对大小
E反应物 > E生成物
E反应物 < E生成物
练习:氢气在氯气中燃烧时产生苍白色火焰,反应过程中,破坏1ml氢气中的化学键消耗的能量为Q1kJ,破坏1ml氯气中的化学键消耗的能量为Q2kJ,形成1ml氯化氢中的化学键释放的能量为O3kJ。下列关系式中正确的是 A.2Q1 + 2Q2 < Q3 B. Q1 + Q2 < Q3 C. Q1 + Q2 < 2Q3 D. Q1 + Q2 > 2Q3
热量的变化——吸热或者放热。
化学反应中的能量变化,通常主要表现为:
练习:指出下列各种情况下能量转化形式
练习:吸热反应一定是 A.释放能量 B. 贮存能量 C.反应物总能量高于生成物总能量 D.反应物总能量低于生成物总能量
练习:能量越低,物质越稳定。反应:C(石墨) C(金刚石)是吸热反应,由此可知: A.石墨比金刚石更稳定 B.金刚石比石墨更稳定 C.金刚石和石墨不能相互转化 D.金刚石和石墨可以相互转化
已知:2H2(g) + O2(g) =2H2O(g) 放出Q1
则:① 2H2O(g) = 2H2(g) + O2(g)
相同条件下发生的反应:
③ 2H2(g) + O2(g) =2H2O(l) 放出Q2
酸与 碱的 溶液发生中和反应生成 时所释放的热量称为中和热
指出下列过程是放热的还是吸热的:
HCl +NaOH = NaCl + H2O
2Al + 6HCl = 2AlCl3 = 3H2↑
Ba(OH)2·8H2O + 2NH4Cl = BaCl2 + 2NH3↑ + 10H2O
2Na2O2 +2CO2 = 2Na2CO3 + O2
把化学能转化成电能的装置
原电池不是化学能转化为电能的唯一途径
(都是根据原电池原理制得的)
锌锰电池的负极是 ,正极是 。
废弃的镍镉电池若不回收会 。
是一种高效、环境友好的发电装置
一个自发的氧化还原反应、
练习:将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是 A.两烧杯中铜片表面均无气泡产生 B. 甲中铜片是正极,乙中铜片是负极 C.两烧杯中溶液的pH值均增大 D. 产生气泡的速度甲比乙慢
原电池负极的本质特征:
相对活泼的金属;失去电子,作还原剂;元素化合价升高;被氧化;发生氧化反应;电子流出;电流流入;电极溶解,质量减少。
练习:镍镉(Ni—Cd)可充电电池在现代生活中有着广泛的应用,它的充放电反应按下式进行:Cd(OH)2+2Ni(OH)2 Cd+2NiO(OH)+2H2O由此可知,该电池放电时的负极材料是 A.Cd(OH)2 B. 2Ni(OH)2 C. Cd D. NiO(OH)
(三)化学反应速率与限度
1、 化学反应速率是用来描述化学反应过程进行的 的物理量。
常用单位:ml/(L·s)或 ml/(L·min)
对于一个反应:a A + b B == c C
= △nA : △ nB :△nC
= △cA : △ cB :△cC
练习:2L密闭容器中发生的如下反应:3X(g) +Y(g) = nZ(g) + 2W(g),开始投入一定量的X和Y ,5min时生成0.2mlW,同时测得以Z的浓度变化表示的反应速率为0.01ml/(L·min),则n值为 A.1 B. 2 C. 3 D. 4
影响反应速率的因素(外因):
⑤其他条件:光、超声波、激光、放射线等
决定反应速率的因素(内因):
反应物浓度越大,反应速率越快
反应温度越高,反应速率越快
使用催化剂能够改变反应速率
固体表面积越大,反应速率越快
练习:下列措施肯定能提高反应速率的是A.增大反应物用量 B.增大压强 C. 使用催化剂 D.适当升高温度
2、 化学反应限度是用来描述一定条件下的可逆反应所能达到或完成的 。
1、同一条件下可向两个相反的方向同时进行
2、任何一个可逆反应都不能进行到底。反应开始后,所有物质永远共存
练习:向1L容器中充入2mlSO3,在一定条件下发生反应,达到平衡时,SO2的浓度不可能为A.1ml/L B.0.75ml/L C. 2ml/L D. 1.5ml/L
平衡状态的特点:逆、动、等、定、变
V正= V逆 达到平衡时,正、逆反应速率相等
达到平衡后,体系中各物质c、n、m不再改变
只有可逆反应才能建立化学平衡
“变”在外界条件改变时,平衡发生改变
V正、V逆≠0 达到平衡时,反应并未停止
化学反应的限度首先决定于反应的化学性质,其次受温度、浓度、压强等条件的影响。
正反应速率等于逆反应速率,的反应物与生成物的浓度不再改变时的状态
1.同一物质的生成速率等于消耗速率
2 .不同物质表示的速率方向相反,大小等于系数比
本质特征V(正)= V(逆)
1.各组分的c、m、n不变
2.各组分的物质的量分数、质量分数不变
4.若有颜色,则颜色不变
5. aA2+bB2 = cC,若a+b≠c n总不变
基本内容串讲(结合章末复习使用)
在有机物分子中碳呈四价。碳原子既可与其他原子形成共价键,碳原子之间也可相互成键;既可以形成单键,也可以形成双键或三键;碳碳之间可以形成长的碳链,也可以形成碳环。
当烃分子中的碳原子个数为n时,其中氢原子个数的最大数值为2n+2,这是氢原子个数的上限值。以烷烃分子结构和分子组成通式CnH2n+2为基础进行分析和比较:在结构中,若增加一个C=C或C=O双键,就少2个H;在结构中若出现一个C≡C就少4个H;在结构中若出现一个环状结构也少2个H;所以,烯烃和环烷烃的分子组成通式都为CnH2n;炔烃和二烯烃的分子组成通式都为CnH2n-2;苯和苯的同系物,结构中有苯环结构,苯环可以看成是具有3个C=C双键和一个环状结构,氢原子个数应在烷烃的基础上减去4×2=8个,故苯和苯的同系物的分子组成通式为:CnH(2n+2-4×2)即CnH2n-6 (n≥6)。
结构相似,在分子组成上相差一个或若干个CH2原子团的物质互称为同系物。如甲烷、乙烷、丙烷 ······
(1)同系物必须结构相似,即组成元素相同,官能团种类、个数及连接方式相同,分子组成通式相同。(2)同系物在组成上相差一个或若干个“CH2”,即相对分子质量相差14或14的整数倍。(3)同系物有相似的化学性质,物理性质有一定的递变规律。
3、同分异构体 :
具有同分异现象的不同化合物互称为同分异构体。
化合物具有相同的分子式,但具有不同结构式的现象称为同分异现象。
同分异构体可以属于同一类物质,也可以属于不同类物质。可以是有机物,也可以是无机物。中学阶段涉及的同分异构体常见的有三类:(1)碳链异构(2)位置(官能团位置)异构 (3)类别异构(又称官能团异构)
有机物分子里的某些原子或原子团被其他原子或原子团所替代的反应叫取代反应。
被加成的试剂如:H2、X2(X为Cl、Br或I)、H2O、HX、HCN等能离解成一价原子或原子团的物质。通过有机物发生加成反应时反应物之间的量关系,还可定量判断该有机物分子结构中不饱和键的情况:是C=C键,还是C≡C键,或是苯环结构,以及它们的个数。
2、加成反应(及加聚反应) :
有机物分子中双键或三键两端的碳原子与其它原子或原子团直接结合生成新的化合物的反应,叫做加成反应
3、酯化反应(属于取代反应) :
酸和醇作用生成酯和水的反应叫做酯化反应 。
①酯化反应的脱水方式是:羧基脱羧羟基(无机含氧酸脱羟基氢),而醇脱羟基氢,即“酸脱羟基醇脱氢”(可用同位素原子示踪法证明)。
③在酯化反应中使用饱和Na2CO3溶液的作用是吸收未反应的乙酸,溶解乙醇,降低酯的溶解度,增大水的密度,使酯浮于水面,容易分层析出,便于分离。
④乙酸乙酯中除乙酸杂质,只能用饱和Na2CO3浓液,不能用NaOH溶液中和乙酸的方法。因为NaOH溶液碱性强,会促使乙酸乙酯水解,重新变成乙酸和乙醇,所以不能用NaOH溶液代替Na2CO3饱和溶液。
三、重要有机物的结构、性质和用途
分子结构特点主要化学性质主要用途
易取代、易分解、难氧化
易氧化、易加成(加聚)、易分解
⑴石油化学工业最重要的基础原料
——产量作为石油化工水平的标志
b、碳碳键是一种介于单键和双键之间的独特的键。
易取代、难加成、难氧化
(3)氧化反应(燃烧、氧化剂氧化、催化氧化)
(2)酯化反应(取代、可逆)
重要的化工原料,可用作车用燃料,是一类新的可再生能源。
制食醋,重要化工原料。
淀粉——非还原性糖,水解最终产物为葡萄糖,遇碘变蓝
葡萄糖——多羟基醛,不水解,还原性糖
果糖——多羟基酮,不水解,还原性糖
蔗糖——非还原性糖,水解生成葡萄糖和果糖
麦芽糖——还原性糖,水解只生成葡萄糖
纤维素——非还原性糖,水解最终产物为葡萄糖
——人类体能的主要来源( ~75%)
酸性水解——产物为高级脂肪酸和甘油
碱性水解——产物为高级脂肪酸盐和甘油(皂化反应)
油具有烯烃的性质——加成反应、氧化反应
某些蛋白质能发生颜色反应
人体从食物蛋白质中获得氨基酸,再在体内合成蛋白质的同时,体内的各种组织蛋白质也在不断分解,最后主要生成尿素,排出体外。
——人体氨基酸的主要来源
酶是一类特殊的蛋白质,是生物体内的重要催化剂,其催化作用具有高度的专业性。
对于同系物而言,必须同时满足①“结构相似”,②“分子组成上差一个或若干个CH2原子团”这两个条件。在判断“结构相似”时关键是分析在结构上是否具有相同的化学键类型和相似的碳链结构。在判断组成关系时,是以分子式分析,而不是从结构上看去是否差“CH2”原子团。同时,在书写可能的结构时要注意碳原子满足4个价键,氢原子满足1个价键,氧原子满足2个价键,氮原子满足3个价键,卤原子满足1个价键……。
下列各组物质中一定属于同系物的是( ) A.CH4和C2H4 B.烷烃和环烷烃; C.C2H4和C4H8 D.C5H12 和C2H6
下列各组物质中,两者互为同分异构体的是 ( )①CuSO4·3H2O和CuSO4·5H2O ②NH4CNO和CO(NH2)2③C2H5NO2和NH2CH2COOH ④[Pu(H2O)4]Cl3和[Pu(H2O)2Cl2]·2H2O·ClA.①②③ B.②③④ C.②③ D.③④
1 ml有机物能与1 ml H2发生加成反应,其加成后的产物是异戊烷,试写出该有机物可能有的结构简式。
怎样以H2O、H218O、空气、乙烯为原料制取CH3C18OOCH2CH3?写出有关反应的化学方程式。
1ml某烷烃可与8 mlCl2完全取代,求此烷烃的分子式。
该烷烃的分子式为C3H8
思路:可采用从最终的目标产物倒推原料(或中间产物)的方法
下列说法中,正确的是 ( )A.乙烯分子里的碳碳双键的键长是乙烷分 子里碳碳单键键长的二分之一 B.乙烯分子里的碳碳双键的键能是乙烷分子里碳碳单键键能的2倍 C.乙烯分子里的碳碳双键只需要较少的能量可使其中的一个键断裂 D.苯中碳碳键的键能大于乙烯中碳碳双键 的键能
证明淀粉已部分水解不需要用的试剂是 ( )A.碘水 B.新制Cu(OH)2悬浊液 C.碘化钾溶液 D.NaOH溶液
下列叙述中不正确的是 ( )A.天然蛋白质水解的最终产物是多种α-氨基 酸B.所有蛋白质遇到硝酸后加热都会变黄C.蛋白质盐析是可逆的物理过程,利用该性 质可提纯和分离蛋白质D.肥皂液、淀粉液、蛋白质溶液都可以产生 丁达尔效应
在实验室制取的乙烯,常含少量的SO2,有人设计下列实验图以确认上述混合气体中有C2H4和SO2。(1)Ⅰ、Ⅱ、Ⅲ、Ⅳ 装置可盛放的试剂是Ⅰ____,Ⅱ____,Ⅲ______,Ⅳ______,A.品红溶液 B.NaOH溶液 C.浓H2SO4 D.酸性KMnO4溶液(2)能说明SO2气体存在的现象是_________________________;(3)使用装置Ⅱ的目的是_________________________________;(4)使用装置Ⅲ的目的是_________________________________;(5)确定含有乙烯的现象是____________________________________________________________________________。
装置Ⅰ中品红溶液褪色
除去SO2,以免干扰乙烯的检验
装置Ⅲ中的品红溶液不褪色,装置Ⅳ中的酸性KMnO4溶液褪色
第四章 化学与可持续发展复习课
如:酸雨、光化学烟雾……
目前, 全球有三大块酸雨地区:西欧, 北美和东南亚。我国长江以南也存在连片的酸雨区域。在酸雨区域内, 湖泊酸化, 渔业减产, 森林衰退, 土壤贫脊, 粮菜减产, 建筑物腐蚀, 文物面目皆非。
光化学烟雾 大气污染物一氧化氮、二氧化氮和某些碳氢化合物在太阳光紫外线的照射下,在低空大气中发生复杂的光化学反应(大气中的氧气也参加了反应),形成白色或浅兰色有特殊气味的光化学烟雾。 光化学烟雾中主要含二次污染物如醛类、酮类、臭氧、过氧硝酸、乙酰酯等。光化学烟雾严重危害人体健康,损害植物及橡胶制品等。
1、酸雨: 指pH值小于5.6的降水,主要是硫氧化物和氮氧化物等酸性气体转化而成 SO2+H2O H2SO3 2H2SO3+O2 2H2SO4 3NO2+H2O 2HNO3+NO结果: 1 建筑物 2 树木 3 鱼类
2、臭氧层受损: 在距离地面15~50km的大气平流层中集中了臭氧中的90%(臭氧层)可以吸收来自太阳的大部分紫外线,使地球上的生物免遭伤害。(地球的保护伞) 但是由于某些人为的原因,从20世纪80年代开始,出现了臭氧层空洞
3、温室效应与全球气候变暖
2、减少汽车等机动车尾气污染 1)推广无铅汽油 2)在汽车尾气系统中装置催化转化器 3)其他措施
3、减少室内空气污染——材料使用 1)减少厨室污染:CO CO2 NO NO2 SO2和尼古丁等… 2)减少装饰材料引起的污染 a.如甲醛(HCHO)——0.08mg/M3 b.苯、甲苯、二甲苯… c.氡气(Rn)——隐形杀手 d.其他…
新房——100Bq/M3
旧房——200Bq/M3
案例一: 日本的水俣病和痛痛病
水中的重金属污染物主要是:汞(Hg)、镉(Cd)、铅(Pb)和铬(Cr)等。
水中的某些重金属污染物还可以被微生物转化为毒性更大的有机化合物。例如:
甲基氯化汞的毒性比氯化汞的更大,日本的水俣病就是无机汞转变为有机汞而引起的汞中毒事件。
我国工业废水中几种污染物最高允许排放浓度
2. 植物营养物质污染
案例二: 赤潮
~6.2,渤海辽东湾的葫芦岛海域接连发生两起赤潮。赤潮总面积我140平方公里,其中约有60平方公里在该市的水产养殖海洋监控区内。在赤潮区的海面上,飘浮着大量死鱼,给渔业生产带来严重损失。
近年来,赤潮在我国近海呈现频发之势,赤潮灾害一种威胁我国海域生态环境,并给海洋经济带来巨大损失。据统计,2000年我国近海共发生28次赤潮,面积累计超过1万平方公里。仅辽宁、浙江两次较大的赤潮造成的渔业损失就近3亿元。
生活污水和某些工业废水中,含有N、P的化合物,它们是植物生长、发育的养料,称为植物营养素。其中:
N —— 来自蛋白质和农业滥用氮肥等;
P —— 来自含磷洗涤剂和农业滥用磷肥等;
蛋白质在水中的分解过程是:
由于含N、P的物质在分解的过程中,大量消耗溶解在水中的氧,并产生大量的养分,使藻类和其他浮游生物大量繁殖。由于占优势的浮游生物的颜色不同,使水面呈现蓝色、绿色红色或棕色等。这种现象在江河、湖泊中出现称为“水华”,在海湾出现叫做“赤潮”。
这种由于水体中植物营养物质过多蓄积而引起的污染叫做水体的富营养化。当水体发生富营养化时,由于缺氧,致使大多数水生动、植物不能生存。它们的遗骸在水底腐烂沉积,使水质不断恶化,影响渔业生产,并通过食物链危害人体健康。
阅读P.92 科学史话: 杀虫剂DDT的功与过
要防止水体污染,改善水质,最根本的措施是控制工业污水和生活污水的排放。例如:重复使用废水,回收废水中污染成分,减少废水的排放量;采用革新工艺,降低水中污染物的浓度;加强污水处理,使污水达到国家规定的标准以后再排放;加强对水体及污染源的监测和管理等。
有什么样的污水处理方法呢?
具体污水处理的程度是根据水质状况和处理后水的去向来确定。(详见P.94)
—— 向污水中加入混凝剂,使污水中细小的悬浮颗粒聚集成较大颗粒而沉淀,与水分离的方法。
常用的混凝剂是:明矾 [K2SO4 · Al2(SO4)3 · 24H2O]
水中的悬浮颗粒大多带有负电,当其遇到Al(OH)3(胶体)时,就会发生凝聚,达到净水的目的。
—— 对于酸性废水和碱性废水,就要采用中和法进行处理。
使用的中和剂一般是:熟石灰[Ca(OH)2]、硫酸H2SO4和CO2。
酸性废水: 2H+ + Ca(OH)2 = Ca2++2H2O
碱性废水:2OH- + H2SO4 = 2H2O + SO42-
或: 2OH- + CO2 = H2O + CO32-
对于高浓度的酸、碱废水,应优先考虑回收利用。
—— 采用某些化学物质作沉淀剂,与废水中的污染物(主要是重金属离子)发生化学反应,生成难溶于水的沉淀析出的方法 。
例如:利用HgS极难溶于水的性质,向含Hg2+的废水加入Na2S:
Hg2+ + S2- = HgS↓
用此法处理后,污水中Hg2+的浓度下降到几乎对人体无毒。
由于各种方法都有其特点和适用范围,实际处理时往往需要配合使用才能达到最好的效果。例如,处理重金属离子的废水常常综合应用氧化还原法和沉淀法。
指对没有回收价值或一时不能回收的垃圾做直接、简单的处理。
1.垃圾处理的基本原则 无害化、减量化、资源化
2.垃圾做一般处理的主要方法:露天堆放、卫生填埋、堆肥、焚烧…
2.垃圾做一般处理的主要方法
影响城市景观,同时污染了与我们生命至关重要的大气、水和土壤,对城镇居民的健康构成威胁
避免了露天堆放产生的问题,其缺点是建填埋场占地面积大,使用时间短(一般十年左右),造价高,垃圾中可回收利用的资源浪费了 ;而且填埋场的渗出液容易污染其周围的土壤和水体…
这种方法是利用自然界的微生物对垃圾中的有机物进行分解,使之形成肥料,作为农作物的营养,从而达到垃圾处理,净化城市环境,又提高土壤肥力的目的,但堆肥中的重金属有可能对土壤造成污染.并且这种方法需要人们将有机垃圾与其它垃圾分开才行,它具有很好的发展前景
优点:占地少,能大大减少排放量,使垃圾体积缩小50%~95%;焚烧温度高,能彻底消灭病原体;焚烧过程中产生的热量可用于城市供暖、发电等。 缺点:投资大,烧掉了可回收的资源,释放出有毒气体,如二恶英、电池中的汞蒸汽等,并产生有毒有害炉渣和灰尘 …
1)电池垃圾的危害与治理2)医疗垃圾的危害与治理
医疗垃圾焚烧温度高达800~1100℃,能将病毒全部杀死,二恶英等有害物质的排放量可以达标…
二、白色污染的危害与治理
(1)涵义:废塑料制品造成的环境污染
(2)危害:101页(学生阅读)
动物会因吞食塑料而死亡…
A.治理的基本思路 a.改进塑料的配方和生产工艺,研制一些易分解的新型塑料,在一定条件下,经过一定时间会降解为简单物质或被生物分解。
b.3R运动:即减量化(Reduce)再利用(Reuse)、再循环(Recycle)
人教版 (新课标) / 必修2 高中化学期末复习课件: 这是一份人教版 (新课标) / 必修2 高中化学期末复习课件,共9页。PPT课件主要包含了期末复习的策略,化学2的三大主题,复习的内容,期末复习的内容,物质结构基础,原子与离子结构,粒子半径的比较规律,化学键,元素非金属性的判断,化学反应与能量等内容,欢迎下载使用。
人教版 (新课标) / 必修2 期末复习常考知识点复习课件: 这是一份人教版 (新课标) / 必修2 期末复习常考知识点复习课件,共9页。PPT课件主要包含了HLiNa,BeMgHe,BeAr,HBeAl,LiSi,LiP,例题14,知识点14电子式,知识点31苯的性质,分液漏斗等内容,欢迎下载使用。
高中化学人教版 (新课标)必修2第三章 有机化合物综合与测试复习课件ppt: 这是一份高中化学人教版 (新课标)必修2第三章 有机化合物综合与测试复习课件ppt,共9页。PPT课件主要包含了有机物,什么叫有机物,化学式CH4,甲烷最简单的烃,甲烷的性质,②化学性质,各氯代甲烷结构式,二氯甲烷的结构式,常见烷烃的结构式,同分异构体等内容,欢迎下载使用。













