




【期末复习课件】人教版(2019)高一化学必修1期末备考-化学实验课件
展开离子检验 物质提纯 微型实验 溶液配制
1.向某溶液中滴加氯水后再加入KSCN溶液,溶液呈红色。则溶液中一定含有Fe2+。 2.检验Fe(NO3)2晶体是否氧化变质的方法是将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液,观察溶液是否变红。 3.因为Fe3+具有氧化性,所以KSCN溶液可以鉴别Fe3+。
判断以下说法是否正确:
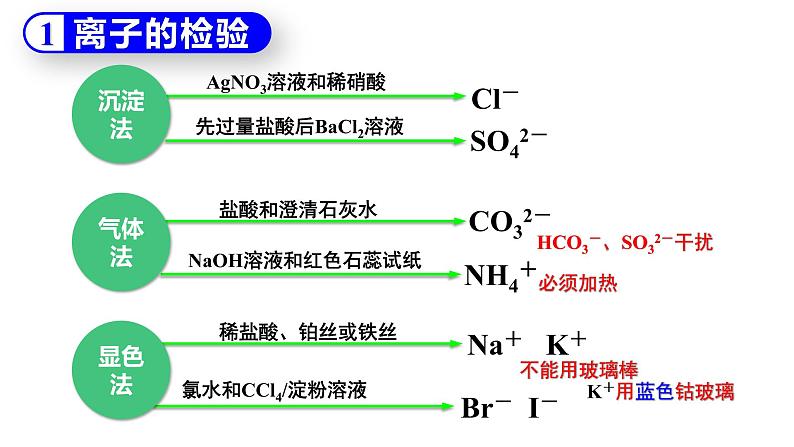
离子的检验
AgNO3溶液和稀硝酸
先过量盐酸后BaCl2溶液
NaOH溶液和红色石蕊试纸
HCO3-、SO32-干扰
氯水和CCl4/淀粉溶液
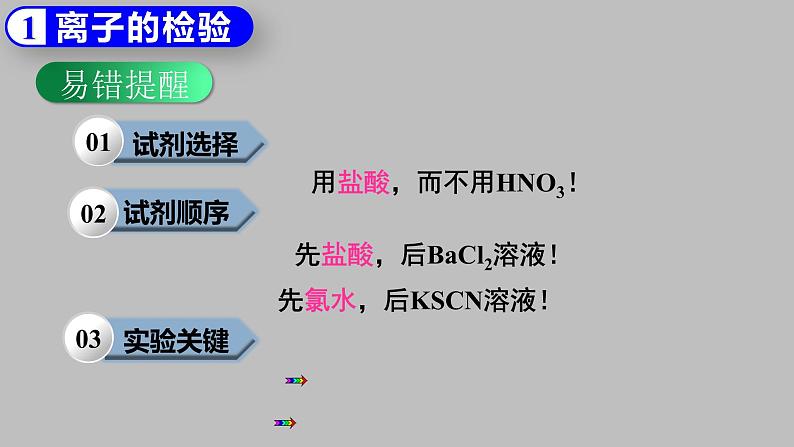
用盐酸,而不用HNO3!
先盐酸,后BaCl2溶液!
先氯水,后KSCN溶液!
如何检验Cl-、SO42-的混合溶液中是否含有Cl-? 选用什么试剂? 请写出有关反应的离子方程式。
如何检验NaOH、Na2CO3的混合溶液中含有NaOH? 选用 什么试剂? 请写出有关反应的离子方程式。
下列依据相关实验得出的结论正确的是
A.向某溶液中加入稀盐酸,产生的气体通入澄清石灰水,石灰水变浑浊,该溶液一定是碳酸盐溶液 B.用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,该溶液一定是钠盐溶液 C.硫酸亚铁溶液中加入KSCN溶液后,溶液变红色,则该溶液一定全部变质 D.向某溶液中滴加KSCN溶液,溶液不变色,滴加氯水后溶液显红色,该溶液中一定含Fe2+
纳米氧化铝在陶瓷材料、电子工业、生物医药等方面有广阔的应用前景,它可通过硫酸铝铵晶体热分解得到。[已知:硫酸铝铵晶体的化学式为Al2(NH4)2(SO4)4·24H2O,相对分子质量为906]
制备硫酸铝铵晶体的实验流程如下:
①检验上述流程中“过滤”后杂质是否除尽的实验方法是_______________________。
②上述流程中,“分离”所包含的操作依次为:________、________、过滤、洗涤、干燥。
取少量滤液于试管中,加几滴KSCN溶液,若溶液不变红,则杂质已除尽
③FeCl3(FeCl2):
加过量NaOH溶液,过滤,再加酸充分溶解
②Mg2+(Al3+):
①NaHCO3(Na2CO3)固体:
溶于水,通入过量的CO2 ,蒸发浓缩,冷却结晶
Separatin and purificatin f substance
2.1 物理性质
蒸发结晶 (除NaCl中的KNO3)
溶解 过滤(除粗盐中的泥沙)
水银球位置、冷却水方向
2.2 化学性质
Na2CO3(NaHCO3)
Fe2O3(Al2O3)
NaCl(AlCl3)
NaCl(Na2CO3)
FeCl2(FeCl3)
下列除杂(括号内是杂质)所选用的试剂及操作方法均正确的一组是
由下列实验及现象能推出相应结论的是
Micr experiment design
微型实验方案判断
以下实验设计能达到实验目的的是
还原性:Fe2+>Br-,加入适量氯水,先氧化成Fe2+,因此不能用氯水除去FeCl2中FeBr2,故D错误。
用固体样品配制一定物质的量浓度的溶液,下列图示对应的有关操作规范的是
溶液的配制
天平(量筒)、玻璃棒、小烧杯、胶头滴管、××mL容量瓶
4.2 考查方式或注意点
配480 mL溶液,按500 mL计算
托盘天平、量筒的精度为0.1
烧杯内壁及玻璃棒要洗涤2~3次
容量瓶液面接近刻度线1~2 cm
液面低于刻度线,不需加水
实验室用密度为1.84 g·cm-3、质量分数为98%的浓硫酸配制230 mL、0.5 ml·L-1的稀硫酸,可供选用的仪器有: ①胶头滴管;②10 mL量筒;③50 mL量筒;④托盘天平;⑤烧瓶;⑥玻璃棒;⑦小烧杯。 请回答下列问题
(1)配制稀硫酸时,上述仪器中不需要使用________(选填序号),尚缺的玻璃仪器有 _________________(写名称)。
(2)该浓硫酸中H2SO4的物质的量浓度为 _______ ml·L-1。 (3)配制0.5 ml·L-1的稀硫酸需要上述浓硫酸的体积为 ______ mL。
用量筒量取_______mL。
A.往容量瓶内小心加蒸馏水,直到液面接近刻度线l~2 cm处 B.盖好容量瓶的瓶塞,上下颠倒摇匀 C.改用胶头滴管加蒸馏水,至溶液的凹液面恰好与刻度线相切 D.将己冷却的硫酸沿玻璃棒慢慢注入到容量瓶中 E.用蒸馏水洗涤烧杯和玻璃棒2~3次,将每次洗涤液都注入到容量瓶中,轻轻振荡 F.用量筒准确量取一定体积的浓硫酸,慢慢加入到盛有水(约30 mL)的烧杯中,用玻璃捧不断搅拌,使其混合均匀
(4)将下列操作按正确的操作顺序排列(用字母绵号表示,每个字母只能用一次)_____________
(5)下面操作造成所配稀硫酸溶液浓度偏高的是 _______ (填序号) A.浓硫酸稀释后溶液没有冷却到室温就转移 B.容量瓶中原有少量蒸馏水 C.向容量瓶加水定容时眼睛俯视液面 D.定容时加水超过刻度线,立即用滴管吸出多余液体
4.3 误差分析
(2021年河北省保定市期中节选)下列操作中,会导致所配溶液的物质的量浓度偏低的有________(填标号,下同),对所配溶液的物质的量浓度无影响的有________A.将溶液往容量瓶中转移时,有少量液体溅出B.未洗涤稀释浓醋酸的烧杯C.容量瓶未干燥即用来配制溶液D.定容时俯视刻度线 E.定容后经振荡、摇匀、静置后,发现液面下降,再加入适量的蒸馏水
这节课我学到了什么?(用一句话表示)
氯水和CCl4/淡粉溶液
溶解性: 过滤 蒸发浓缩 冷却结晶沸点 蒸馏
热稳定性沉淀性气体性酸碱性氧化性还原性
实验操作、现象与结论的错误类型
描述与所学“化学知识”相悖不
推理存在“逻辑关系”错误不
物质的量浓度溶液之配制
1 000 mL 500 mL 250 mL100 mL 50 mL
容量瓶使用前的第一步操作是:
容量瓶不能用所配溶液润洗!
配480 mL溶液,要用500 mL容量瓶,且计算不能按0.48 L!
下列实验方案能达到目的的是A.用排水集气法收集HCl气体B.用燃烧的木条检验N2和CO2C.用KSCN溶液检验溶液中的Fe3+ D.用丁达尔效应鉴别Na2CO3溶液和NaHCO3溶液
判断以下操作是否错误:
① 容量瓶和分液漏斗使用前均需要检漏
② 用容量瓶配溶液时,若加水超过刻度线,立即用滴管吸出多余液体
③用固体NaCl配制0.5 ml·L-1的溶液,所用的仪器有:烧杯、玻璃棒、胶头滴管、容量瓶
④向容量瓶转移液体时,导流用玻璃棒可以接触容量瓶内壁
判断下列实验操作能否达到实验目的的
⑤为准确配制一定物质的量浓度的溶液,定容过程中向容量瓶内加蒸馏水至接近刻度线时,改用滴管滴加蒸馏水至刻度线
⑥配制浓度为0.010 ml·L-1的KMnO4溶液 ,其操作是称取KMnO4固体0.158 g,放入100 mL容量瓶中,加水溶解并稀释至刻度
⑦如图配制一定物质的量浓度的NaNO3溶液
某硫酸厂产生的烧渣(主要含Fe2O3、FeO,还有一定量的SiO2)可用于制备FeCO3,其流程如下:
已知:“还原”时,FeS2与H2SO4不反应,Fe3+通过反应Ⅰ、Ⅱ被还原,其中反应Ⅰ如下:
FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+
(1)加入FeS2还原后,检验Fe3+是否反应完全的试剂为____________。
(2)所得FeCO3需充分洗涤,检验是否洗净的方法是_____________________________________________________________________。“沉淀”时,pH不宜过高,否则制备的FeCO3中可能混有的杂质是__________。
取最后一次洗涤液少许放入试管中,滴加稀盐酸,待无明显现象后,再滴加BaCl2溶液,若无白色沉淀生成,表明已洗涤干净。反之,则说明没洗干净
(3)①写出“还原”时反应Ⅱ的离子方程式:_________________________。
【期末复习课件】人教版(2019)高一化学必修1期末备考-考前指导课件: 这是一份【期末复习课件】人教版(2019)高一化学必修1期末备考-考前指导课件,共48页。PPT课件主要包含了期末考前指导,考试目标,基础题得满分,中档题不失分,较难题多得分,容易题先抢分,会做全做对,一分不浪费,试一试,化学方程式规范等内容,欢迎下载使用。
【期末复习课件】人教版(2019)高一化学必修1期末备考-无机框图题与化工流程题解题策略课件: 这是一份【期末复习课件】人教版(2019)高一化学必修1期末备考-无机框图题与化工流程题解题策略课件,共35页。PPT课件主要包含了无机框图题,找特征,作假设,再验证,分享答题规范注意点,送你一个成功的故事,化工流程题,1构成,2审题,3名词等内容,欢迎下载使用。
【期末复习课件】人教版(2019)高一化学必修1期末备考-化学计算课件: 这是一份【期末复习课件】人教版(2019)高一化学必修1期末备考-化学计算课件,共42页。PPT课件主要包含了化学计算,学习目标,学习任务一,阿伏加德罗常数判断,NaCl,学习任务二,巧用守恒法解题,守恒法,质量守恒法,电子守恒法等内容,欢迎下载使用。












