




高中化学必修2期末复习(苏教版)
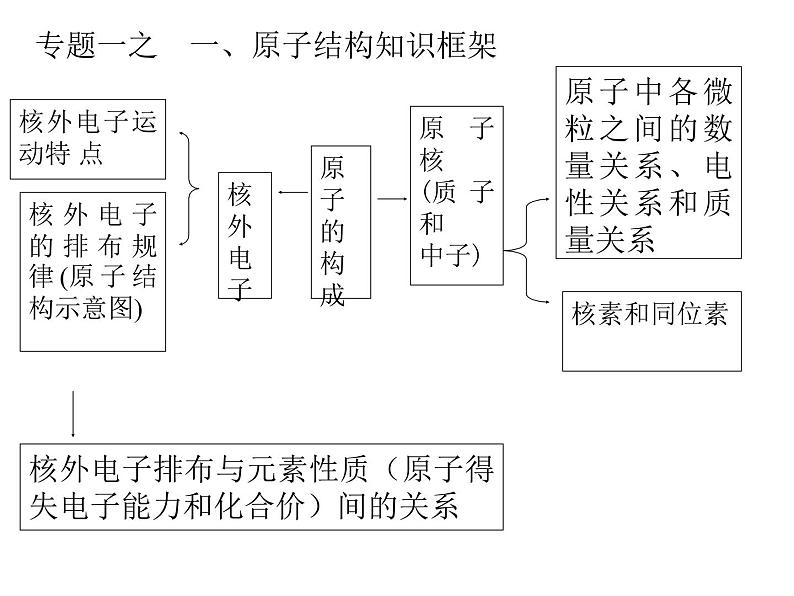
展开原子中各微粒之间的数量关系、电性关系和质量关系
核外电子的排布规律(原子结构示意图)
核外电子排布与元素性质(原子得失电子能力和化合价)间的关系
专题一之 一、原子结构知识框架
(一)、原子核 核素
、数量关系:核内质子数=核外电子数2、电性关系: 原子 核电荷数=核内质子数=核外电子数阳离子 核内质子数>核外电子数阴离子 核内质子数<核外电子数3、质量关系:质量数(A)=质子数(Z)+中子数(N)
3、核素核素:人们把具有一定数目质子和一定数目中子的一种原子称为核素。同位素:质子数相同而中子数不同的同一元素的不同核素互为同位素
二、核外电子排布的规律: 1.电子是在原子核外距核由近及远、能量由低至高的不同电子层上分层排布; 2.每层最多容纳的电子数为2n2(n代表电子层数); 3.电子一般总是尽先排在能量最低的电子层里,即最先排第一层,当第一层排满后,再排第二层,等等。 4.最外层电子数则不超过8个(第一层为最外层时,电子数不超过2个)。
▲构成原子的各种微粒之间的关系及相关知识如下图所示。 原子中各微粒间的数量关系、原子结构 原子核 电性关系和质量关系 (质子、中子 ) 核素、同位素的含义 元素与原子的关系 核外电子
核外电子 排布规律 电子排布与元素性质间的关系
相关知识请好好复习必修2教材!
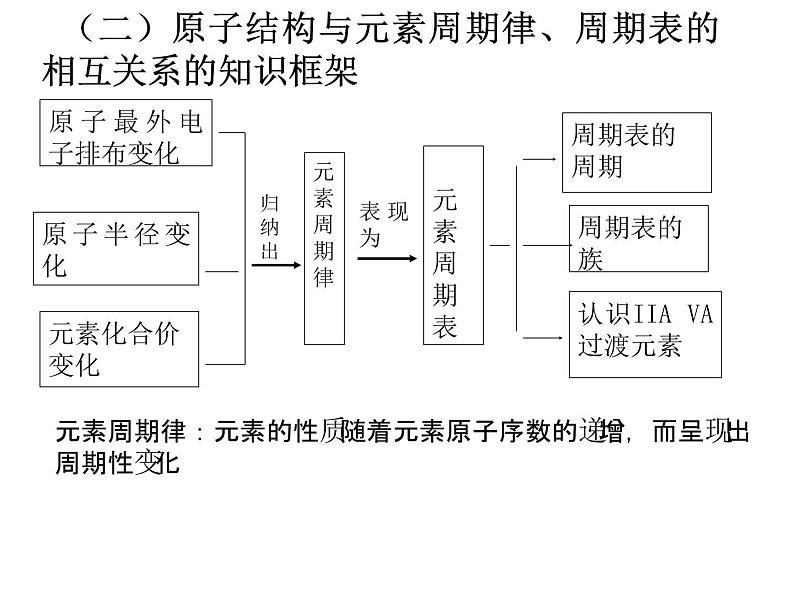
认识IIA VA过渡元素
(二)原子结构与元素周期律、周期表的相互关系的知识框架
元素周期律:元素的性质随着元素原子序数的递增,而呈现出周期性变化
【概括总结】族 副族(3、4、5、6、7、11、12列)B族 零族(18列)、 第VIII族(8、9、10列)
元素周期表结构
短周期(一、二、三行)(元素有2、8、8种)
周期 长周期(四、五、六行)(元素有18、18、 32种)
主族(1、2、13、14、15、16、17列) A族
不完全周期(七行)(元素有26种多)
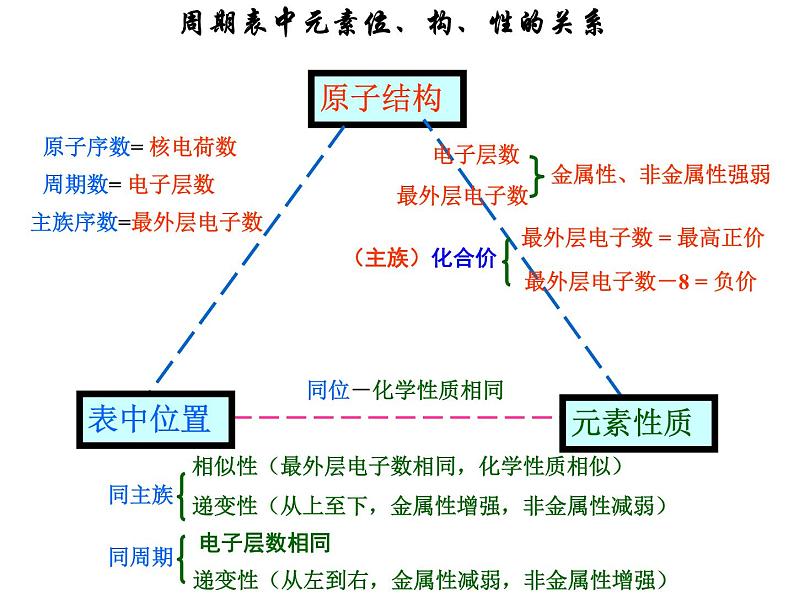
同一周期从左到右,元素原子失去电子能力逐渐减弱,得电子能力逐渐增强,即金属性渐弱,非金属性渐强。
同主族元素从上到下,随着原子核外电子层数增多,原子半径增大,原子核对最外层电子的引力减小,元素原子得电子能力减弱,失电子能力增强,即非金属性渐弱,金属性渐强。
周期表中元素位、构、性的关系
⑴ 同周期元素的原子或最高价离子(相同电荷)半径从左到右渐小
Na >Mg >Al >Si Na+ >Mg2+ >Al3+
⑵ 同主族元素的原子或离子半径从上到下渐大
Li < Na < K F- < Cl- < Br-
⑶ 核外电子排布相同的离子半径随电荷数的增加而减小
O2 > F- > Na+ > Mg2+ > Al3+
⑷ 同种元素的微粒:阳离子<中性原子<阴离子 价态越高,微粒半径越小。
Fe+3 < Fe2+ < Fe H+ < H < H-
(三)、分子结构要求掌握“一力、二键、三晶体”1、化学键注意记住概念,化学键类型(离子键、共价键、金属键)2、离子键(1) 记住定义(2)形成离子键的条件:活泼金属元素(ⅠA、ⅡA)和活泼非金属元素(ⅥA、ⅦA)之间化合(3)离子半径大小的比较:(电子层与某稀有元素相同的离子半径比较)电子层结构相同的离子,半径随原子序数递增,半径减小
3、共价键(1)定义(2)共价键的类型: 非极性键(同种元素原子之间)共价键极性键(同种元素原子之间)(3)共价键的几个参数(键长、键能、键角):4、电子式(1)定义(2)含共价键和含离子键电子式的异同点
5、晶体(1)离子晶体、分子晶体、原子晶体(2)三晶体的比较(成键微粒、微粒间的相互作用、物理性质)(3)注意几种常见晶体的结构特点 参考发给大家的必修2总复习知识网络的表3微粒间作用力及晶体类型(184页)
专题二、化学反应与能量变化(选修中我们已进一步学习)
(一)化学反应速率与反应限度
用单位时间里反应物浓度的减少或生成物浓度的增加来表示。
单位:ml/(L·s)或ml/(L·min)
数学表达式:v = 2、外界条件对化学反应速率的影响
其它条件不变,温度升高,反应速率加快。温度每升高10度,反应速率增大为原来的2-4倍.
适当的催化剂能加快化学反应速率 。
当其他条件不变时,增加反应物的浓度,可以增大化学反应速率。此规律适用于溶液或有气体参加的反应。
对于有气体参加的反应来说,当其他条件不变时,增大压强,化学反应速率加快。
反应物颗粒大小、溶剂;
1.可逆反应:在相同条件下,同时向两个相反方向进行的反应属于可逆反应. (1)表示:反应物 生成物
(2)在一定条件下,可逆反应的进行有一定限度.
是指在一定条件下的可逆反应里,正反应和逆反应的速率相等,反应混合物中各组分的浓度保持不变的状态.化学平衡状态简称为化学平衡.
3.化学平衡状态的特征
c.动: V正=V逆≠0,即是一个动态平衡
d.定:平衡混合物中各组分的百分含量一定
e.变:条件改变,平衡改变,直到建立新的平衡
4. 化学平衡的判断依据和方法
判断依据: a. V正=V逆 b.反应混合物中各组分的浓度保持不变
5.关于化学平衡的计算
(二)化学反应中的热量包括燃料燃烧、热效应(放热和吸热反应)、热化学方程式等。
(三)化学能与电能的转化 包括原电池、化学电源、电解池等。 (四)太阳能、生物质能和氢能的利用
2、燃烧的本质—氧化还原反应
①含一个 C=C键②链烃
①含一个 C C键②链烃
①含一个苯环②侧链为烷烃 基
一般随分子中碳原子数的增多沸点升高,液时密度增大,气态碳原子数为1~4 。不溶于水,液态烃密度比水小。
简单的同系物常温下为液态不溶于水,密度比水小。
专题三、有机化合物的获得与应用(一)、烃类概述
①与卤素取代(光照)②燃烧③裂化反应
①与X2 H2 H2O等发生 加成反应②加聚反应③氧化反应 燃烧 被酸性 KMnO4 溶液氧化
①加成反应②氧化反应 燃烧 被酸 性 KMnO4 溶液氧化
①取代反应 卤代 硝化 磺化②加成反应③氧化反应 燃烧 苯的 同系物被酸 性KMnO4 溶液氧化
(二)烃的衍生物知识总结
(三)各类有机物的衍变关系
(四)有机反应常见基本类型∶1、取代反应 5、还原反应(得氢或失氧) 定义:(教材56页) 6、酯化反应(实质为取代) 类型: (教材68页)2、加成反应 7、水解反应(实质为取代) 定义:(教材60页) (含皂化反应教材71页) 基团:(有不饱和双键)3、聚合反应(有加聚和缩聚) 定义:(教材79到80页) 基团:4、氧化反应(得氧或失氢)
专题四化学科学与人类文明
一、化学是认识和创造物质的科学 二、化学是社会可持续发展的基础 理解教材中有关合成氨技术、青霉素发现、化学合成和分离技术、环境保护、二氧化碳的回收、绿色化学等知识内容。
高中化学人教版 (新课标) / 必修2 期末复习(详细): 这是一份高中化学人教版 (新课标) / 必修2 期末复习(详细),共9页。PPT课件主要包含了期末复习,第四章保护生存环境,怎样进行治理呢等内容,欢迎下载使用。
人教版 (新课标) / 必修2 高中化学期末复习课件: 这是一份人教版 (新课标) / 必修2 高中化学期末复习课件,共9页。PPT课件主要包含了期末复习的策略,化学2的三大主题,复习的内容,期末复习的内容,物质结构基础,原子与离子结构,粒子半径的比较规律,化学键,元素非金属性的判断,化学反应与能量等内容,欢迎下载使用。
高中化学苏教版必修二第二单元 化学反应中的热量授课课件ppt: 这是一份高中化学苏教版必修二第二单元 化学反应中的热量授课课件ppt,共21页。












