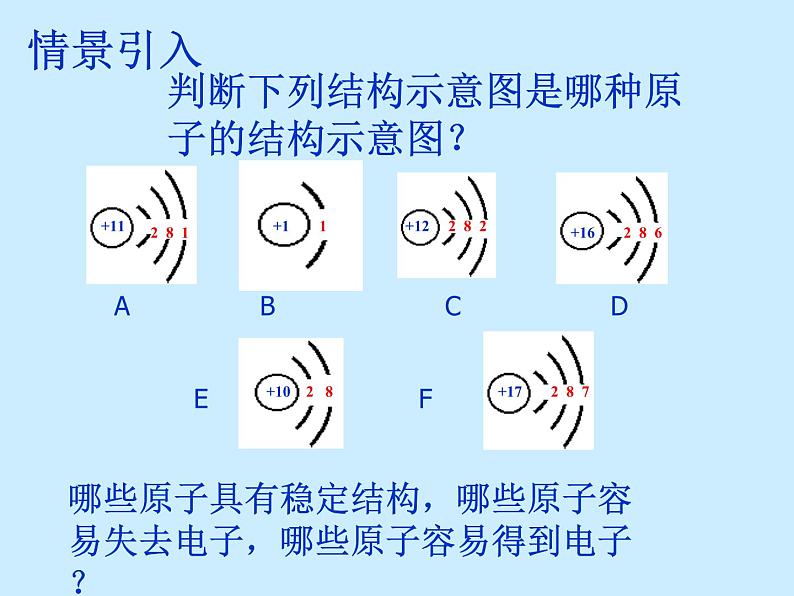



人教版九年级上册课题4 化学式与化合价教课内容课件ppt
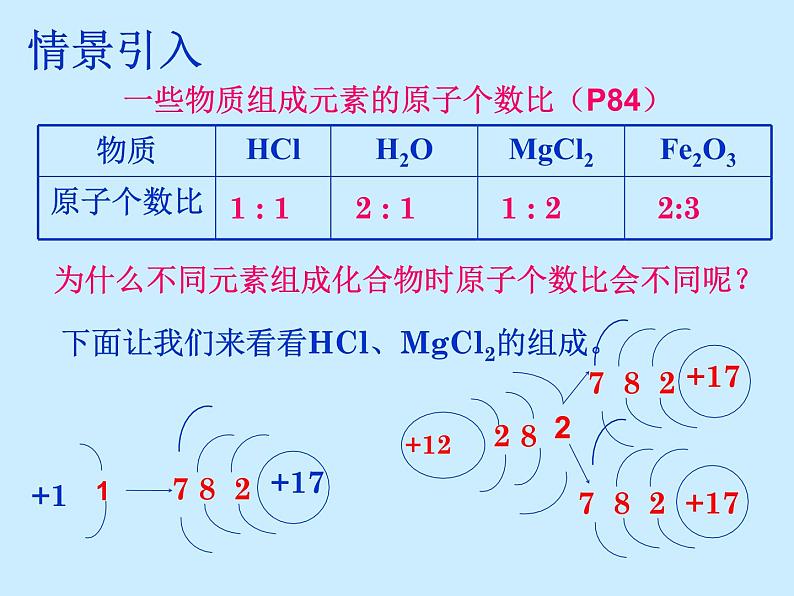
展开一些物质组成元素的原子个数比(P84)
为什么不同元素组成化合物时原子个数比会不同呢?
下面让我们来看看HCl、MgCl2的组成。
1.知道一些常见元素和根的化合价并了解化合价规律2. 能用化学式表示某些物质的组成,并能利用化合价推求化学式3.了解化合价与离子所带电荷的关系,知道怎么用粒子结构示意图得出元素的化合价。
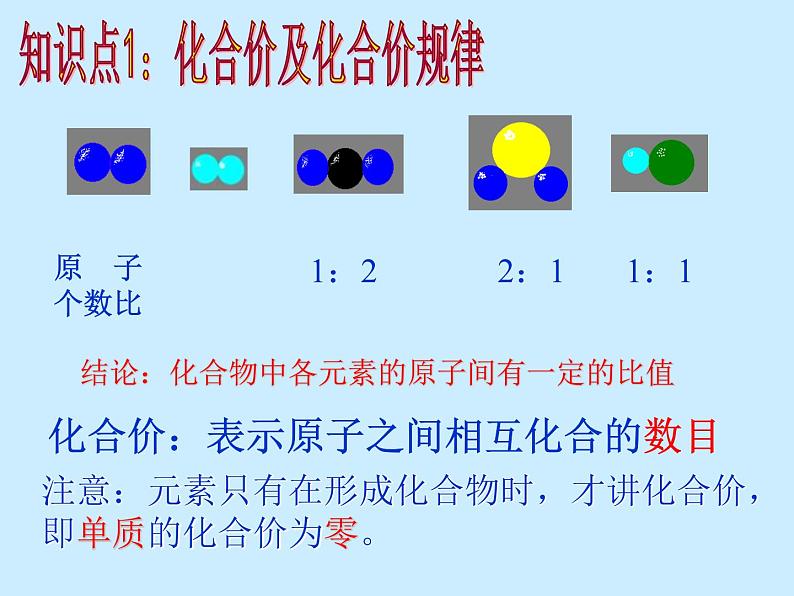
1:2 2:1 1:1
结论:化合物中各元素的原子间有一定的比值
注意:元素只有在形成化合物时,才讲化合价, 即单质的化合价为零。
化合价:表示原子之间相互化合的数目
知识点1:化合价及化合价规律
注意:1.化学式中各原子间个数比为最简整数比。2.若根有两个或多个时,应先用括号括起,再在右下方标上数字,若为一个时,括号和数字“1”都省略。
3、化合物的正、负化合价代数和为零
4、原子团(根)的化合价为负或正
2、非金属元素为负或正
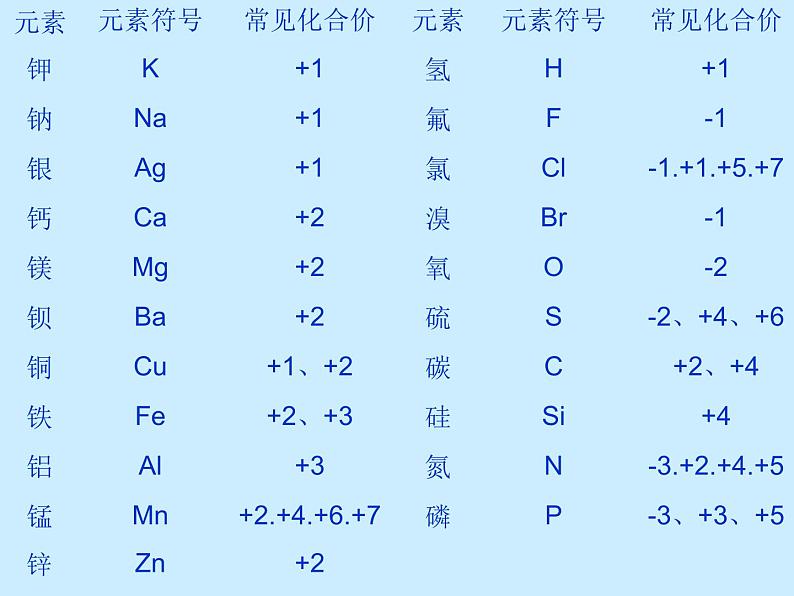
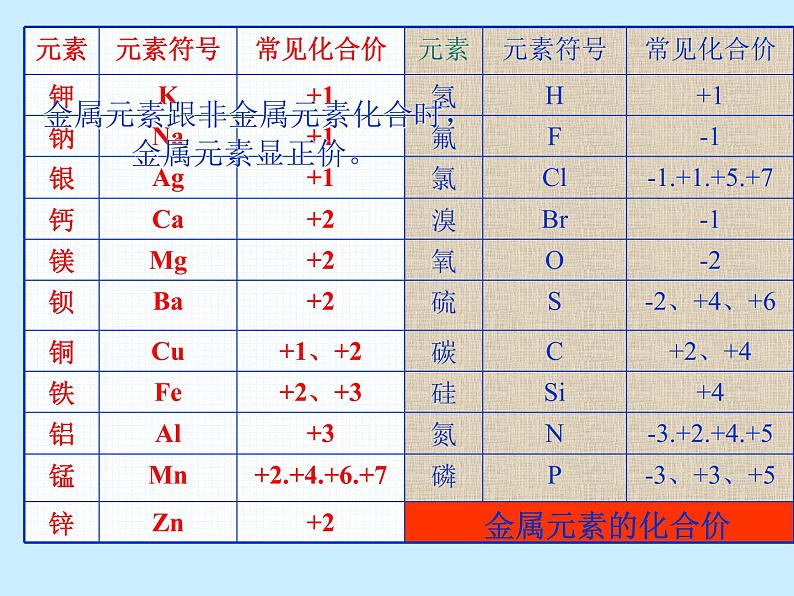
1.常见元素的化合价(课本P86 )
+2.+4.+6.+7
-3.+2.+4.+5
-1.+1.+5.+7
金属元素跟非金属元素化合时,金属元素显正价。
金属元素跟非金属元素化合时,非金属元素显负价。
原子团是在化合物中和在化学反应中常作为一个整体的原子的集团。又叫根。
2.常见原子团的化合价
3.主要元素化合价口诀
钾钠氢银正一价,钙镁锌钡正二价; 通常氧是负二价; 铜汞正一和正二, 铁有正二和正三, 碳有正二和正四 正三铝,正四硅,正五还有氮和磷
常见原子团的化合价
负一硝酸氢氧根,负二硫酸碳酸根, 负三记住磷酸根,正一价的是铵根。
一,化合价有正价和负价,在化合物里:氧元素通常显 ( )价,,氢元素通常显( )价,金属通常显( )价,非金属通常显 ( )价二,一些元素在不同物质中可显不同的化合价三,在化合物里元素正负化合价的代数和为 ( )四,在单质里元素的化合价为( )
元素的化合价是一个原子在形成化合物时表现出来的性质,通常在元素符号或原子团的正上方标出其化合价,一般把“+,-”号写在前面,价数写在后面。价数为1时,1不能省略。
+1 +1 +1 +2 +2 +2 +2 +3
常见正价元素: H K Na Ca Cu Ba Zn Al
化合价与离子符号书写异同
化合价: +2 -2 Mg O
离子符号:Mg2+ O2-
MgO CaCO3 NO2
(正价先,负价后,标出价,找最小公倍数)
课本P86例题:已知磷有种氧化物,其中磷元素的化合价为+5,写出这种磷的氧化物的化学式
注意:只有确实知道某种化合物存在,才能根据元素的化合价写出它的化学式,切不可就用化合价写出实际上不存在物质的化学式。
依据:在化合物中正负化合价的代数和为零。
知识点2:根据化合价书写化学式
题目:已知磷有种氧化物,其中磷元素的化合价为+5,写出这种磷的氧化物的化学式
①写出组成化合物的元素符号,正价的在前,负价的在后。
②求出正负化合价绝对值的最小公倍数。
③求出各元素的原子个数。
④把原子个数在各元素符号的右下角
(方法二、简易法——十字交叉):
1.正的写左边 负的写右边
2.化合价绝对值交叉放置在元素符号右下方。
(+5)×2+(-2)×5=0
(+4)×1+(-2)×2=0
练一练,根据元素的化合价写出下列物质的化学式 1、氧化铁 2、硫酸铝 3、氧化铜
书写方法 正左负右, 标价交叉, 约简复查。
验证:(+3)×2 +(-2)×3 = 0
+3 - 2
验证:(+3)×2 + (-2)×3 = 0
验证:(+2) ×1 +(-2) ×1 = 0
① 写出元素符号,正价在左边,负价在右边, 化合价标在元素的正上方。
② 你的写到我的右下方,我的写到你的右下方。
③ 能约分的一般要约分。
根据化合价求化学式的一般步骤:
④按正价与负价的代数和为0的原则检查化学式书写是否正确。
根据化学式能否求出元素或根的化合价 增补例题1.已知:O为-2价,求Fe2O3中铁元素的化合价。解: X -2 Fe2O3 2X+(-2) ×3=0 X=+3答:在Fe2O3中铁元素的化合价为+3。
知识点3:根据化学式求化合价
例2、试确定氯酸钾(KClO3)中氯元素的化合价
1+ X +(-2)×3=0
答:在氯酸钾里,氯元素的化合价为+5。
归纳:根据化学式求化合价的依据
化合物中元素化合价代数和为0
X×1+(2)×2=0
+1 X -2
(+1)×1+X+(2)×4=0
应用1:根据化学式写化合价
ZnCl2 Zn NaOH H2SO4
+2 0 -1 –2
3、标出下列物质中各元素化合价
记住单质组成元素化合价为0
思考:如何求NH4NO3中带横线元素的化合价
设原子团NH4中氮元素的化合价为X
设原子团NO3中氮元素的化合价为Y
X +(+1)×4 = +1
Y + (-2)×3 = -1
求KMnO4和K2MnO4中Mn元素的化合价
(+1)×1+X+(-2) ×4=0
(+1)×2+Y+(-2) ×4=0
解:设KMnO4中Mn的化合价为X
K2MnO4中Mn的化合价为Y
答: KMnO4和K2MnO4中Mn元素的化合价分别为+7、+6。
【解析】:氮化镓虽没有学过,但可通过粒子结构示意图根据粒子在形成化合物中,可能得失电子的数目,确定元素的化合价,写出其化学式。镓原子最外层有3个电子,易失去,化合价显+3价,氮原子最外层有5个电子,易得到3个电子形成稳定结构,化合价显-3价。根据化合物里化合价代数和为零的原则应为GaN。
【例2】:高铁酸钠(化学式为Na2FeO4)是一种“绿色、环保、高效”的饮用水消毒剂.高铁酸钠中铁元素的化合价是( )A.+4 B.+5 C.+6 D.+7
【解析】:在Na2FeO4中,Na元素的化合价为+1价,O元素的化合价为-2价,设该化合物中Fe元素的化合价为x,由化学式和化合物中正负化合价的代数和为0,则(+1)×2+x+(-2)×4=0,解得x=+6.
1、将下列物质按氯元素的化合价由高到低的顺序排成一列:
Cl2、NaClO4、 NaCl 、KClO3、 NaClO NaClO2
NaClO4、 KClO3、 NaClO2 、 NaClO、Cl2 NaCl
+7 +5 +3 +1 0 -1
2、写出下列离子构成化合物的化学式
3.在NH4NO3、N2、NO2、NO这四种物质中,N元素表现出的化合价共有 ( ) A.3种 B.4种 C.5种 D.6种
4.根据化合价判断化学式正误
下列化学式有无错误,有错误的请改正 氧化铝 氧化镁 氧化钠 氯化亚铁 氯化铜 Al O MgO 2 Na 2O FeCl2 硫酸铝 硫酸 硫酸钠 碳酸钠 Al2 SO4 SO4 Na SO4 Na CO3 氢氧化钠 氢氧化铜 氢氧化铁 NaOH Cu OH 2 Fe(OH) 2
( )3
人教版九年级上册课题4 化学式与化合价课文课件ppt: 这是一份人教版九年级上册课题4 化学式与化合价课文课件ppt,共36页。PPT课件主要包含了Water,H2O,化学式,观察下列物质的化学式,化合价,化合价的有关规律,比较并找规律,原子团的化合价,化合价口诀,试一试等内容,欢迎下载使用。
初中化学人教版九年级上册课题4 化学式与化合价教学ppt课件: 这是一份初中化学人教版九年级上册课题4 化学式与化合价教学ppt课件,共48页。
人教版九年级上册课题4 化学式与化合价教学课件ppt: 这是一份人教版九年级上册课题4 化学式与化合价教学课件ppt,文件包含第1课时化学式pptx、第2课时化合价pptx、第3课时有关相对分子质量的计算pptx、氯化镁书写动画swf、硫酸铝书写动画swf等5份课件配套教学资源,其中PPT共53页, 欢迎下载使用。













