





初中化学人教版九年级下册课题2 酸和碱的中和反应课堂教学课件ppt
展开知识点一 中和反应
1.概念:酸与碱作用生成盐和水的反应。
2.实质:酸溶液中的氢离子和碱溶液中的氢氧根离子结合生成水。 图10-2-1
易错警示 (1)中和反应不是基本反应类型,它特指酸和碱作用生成盐和水 的反应。(2)中和反应生成盐和水,但生成盐和水的反应不一定是中和反 应,如Fe2O3+6HCl 2FeCl3+3H2O、2NaOH+CO2 Na2CO3+H2O等,虽然生成了盐和水,但这些都不是中和反应。
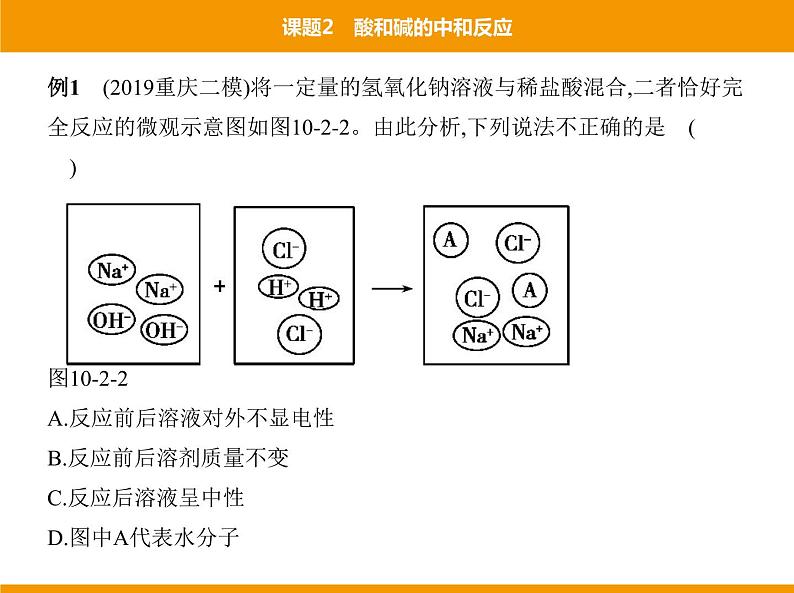
例1 (2019重庆二模)将一定量的氢氧化钠溶液与稀盐酸混合,二者恰好完 全反应的微观示意图如图10-2-2。由此分析,下列说法不正确的是 ( ) 图10-2-2A.反应前后溶液对外不显电性B.反应前后溶剂质量不变C.反应后溶液呈中性D.图中A代表水分子
解析 反应前后溶液中阳离子所带的电荷和阴离子所带的电荷电量相 等、电性相反,溶液对外不显电性;反应后有水生成,溶剂质量增加;恰好完 全反应时,溶液中溶质为氯化钠,溶液呈中性;该反应的实质是氢离子和氢 氧根离子结合生成水分子,题图中A代表水分子。
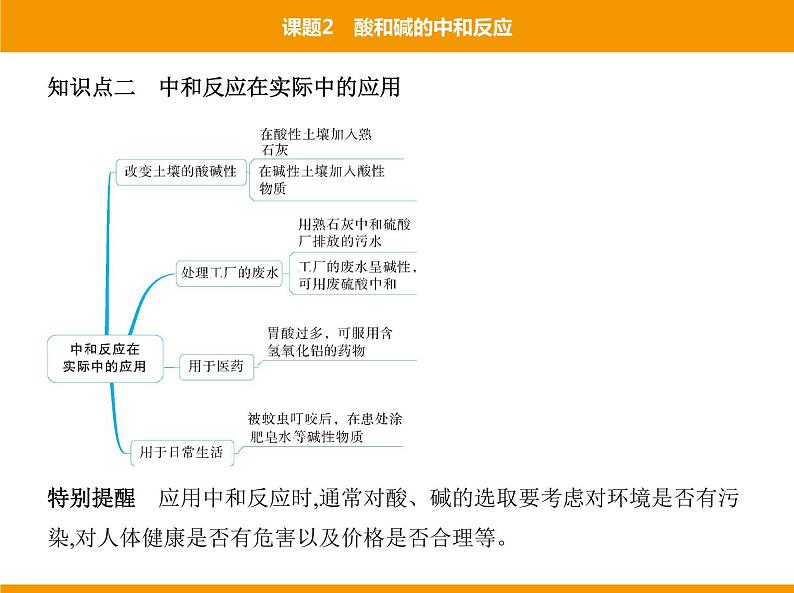
知识点二 中和反应在实际中的应用
特别提醒 应用中和反应时,通常对酸、碱的选取要考虑对环境是否有污 染,对人体健康是否有危害以及价格是否合理等。
例2 (2019四川宜宾一模)下列实例不属于中和反应的是 ( )A.用熟石灰改良酸性土壤B.用氢氧化铝治疗胃酸过多C.被蚊虫叮咬后涂抹肥皂水减轻痛痒D.用稀盐酸清除铁锈
解析 用熟石灰改良酸性土壤,利用的是中和反应原理,属于中和反应;用 氢氧化铝治疗胃酸过多,氢氧化铝与盐酸反应生成氯化铝和水,该反应属于 中和反应;被蚊虫叮咬后涂抹肥皂水减轻痛痒,该反应是酸与碱反应生成盐 和水的反应,属于中和反应;用稀盐酸清除铁锈,该反应的反应物是金属氧 化物与酸,不属于中和反应。
知识点三 溶液的酸碱度
1.溶液的酸碱性和酸碱度(1)溶液的酸碱性是指溶液呈酸性、中性或碱性,可以用酸碱指示剂来粗略 测定。(2)溶液酸碱性的强弱程度叫溶液的酸碱度,常用pH表示。pH的范围通常 为0~14。
2.pH与溶液酸碱性的关系
特别提醒 pH与溶液的酸碱性 图10-2-4
3.pH的测定方法(1)粗略测定(用pH试纸)在玻璃片或白瓷板上放一小片pH试纸,用玻璃棒蘸取溶液滴在试纸上,再 将试纸显示的颜色与标准比色卡比较,就能得出溶液的pH。只能粗略地测 定溶液的酸碱度,测得的pH是整数。(2)精确测定(用pH计)pH计又叫酸度计,是用来精确测定溶液pH的仪器,pH计有不同的型号,在精 度和外观等方面有所不同。
特别提醒 (1)测定溶液的pH时,试纸不可直接浸入溶液,以免污染溶液。 (2)试纸不可事先用蒸馏水润湿,因为润湿试纸相当于稀释被检验的溶液, 可能导致测量不准确,若被测溶液为酸性溶液,则pH偏高;若被测溶液为碱 性溶液,则pH偏低。
4.溶液酸碱度的应用(1)了解土壤的酸碱性,农作物一般适宜在pH为7或接近7的土壤中生长。(2)测定雨水的pH(因溶解有二氧化碳,正常雨水的pH约为5.6,酸雨的pH<5. 6),了解空气的污染情况。(3)测定人体体液的pH,了解人体的健康状况。
例3 (2019湖南株洲中考)一些重要作物最适宜生长的土壤的pH范围如 下:
下列说法中正确的是 ( )A.水稻和薄荷生长都适宜酸性土壤B.草莓生长只适宜酸性土壤C.马铃薯生长不适宜碱性土壤D.以上作物都不适宜碱性土壤
解析 薄荷适宜生长的土壤的pH为7~8,土壤显弱碱性,A错误;草莓适宜生 长的土壤的pH为5~7.5,也适宜显弱碱性的土壤,B错误;马铃薯适宜生长的 土壤的pH为4.8~5.5,其不适宜在碱性土壤中生长,C正确;薄荷适宜生长的 土壤的pH为7~8,土壤显弱碱性,D错误。
题型一 中和反应的实验探究
例1 (2018山东菏泽东明一模)在研究酸和碱的化学性质时,某小组想证明 稀硫酸和氢氧化钠溶液混合后,虽然无明显现象,但确实发生了化学反应。 试与他们一起完成实验方案的设计、实施和评价,并得出有关结论。(1)探究稀硫酸和氢氧化钠溶液的反应:图10-2-5当滴入几滴酚酞溶液后,溶液由无色变为 色。根据上述实验中的颜色
变化,可确定稀硫酸和氢氧化钠溶液发生了化学反应,反应的化学方程式为 。(2)探究上述稀硫酸和氢氧化钠溶液反应后烧杯中的硫酸是否过量:根据上述反应过程中溶液变成无色,不能确定稀硫酸是否过量。同学们又 分别选取氯化钡溶液、紫色石蕊溶液设计实验方案,请你判断并分析:
上述设计的实验方案中,正确的是 (填“方案一”或“方案 二”)。另外一个实验方案错误的原因是 。若请你再设计一个确定稀硫酸是否过量的实验方案,你选用的药品是 ,实验现象及结论是 。
解析 (1)酚酞遇碱变红;氢氧化钠与稀硫酸反应生成硫酸钠和水。(2)因 为氢氧化钠和硫酸反应后生成的硫酸钠也能和BaCl2反应产生白色沉淀 BaSO4,所以方案一不正确。活泼金属与酸反应生成氢气,所以可以取样加 入锌粒等活泼金属,若有气体放出,证明稀硫酸过量,反之稀硫酸不过量。
答案 (1)红 2NaOH+H2SO4 Na2SO4+2H2O (2)方案一:出现白色沉淀 方案二:溶液变红 方案二 NaOH和H2SO4反 应后生成的硫酸钠也能和BaCl2反应产生白色沉淀BaSO4 锌粒(合理即 可) 若有气体放出,证明稀硫酸过量,反之稀硫酸不过量(合理即可)
点拨 判断中和反应是否发生的方法及注意事项
题型二 对pH变化曲线的理解及应用
例2 (2019山东泰安模拟)某校化学兴趣小组利用数字化传感器探究稀盐 酸和氢氧化钠溶液的反应过程,测得烧杯中溶液的pH随滴加液体体积变化 的曲线如图10-2-6所示。下列说法正确的是 ( )图10-2-6A.向图中c点所示溶液中滴加无色酚酞,溶液不变色B.该实验是将盐酸逐滴滴入到盛有氢氧化钠溶液的烧杯中C.图中a点所示溶液中,含有的溶质是NaCl和NaOH
D.由a点到b点的pH变化过程证明酸和碱发生了中和反应
解析 c点溶液显碱性,滴加无色酚酞,溶液变为红色;实验过程中,溶液pH 由小于7逐渐升高至大于7,是将氢氧化钠溶液逐滴滴入到盛有稀盐酸的烧 杯中;图中a点所示溶液中,含有的溶质是NaCl和HCl;由a点到b点的pH变化 过程证明酸和碱发生了中和反应,这是因为该过程中溶液由酸性变成了中 性。
点拨 (1)酸性溶液加水稀释pH变大,但只能接近7,不会大于或等于7,如图 10-2-7中A所示。(2)酸性溶液中不断加碱,pH变大,最终pH会大于7,如图10 -2-7中B所示。(3)碱性溶液加水稀释pH变小,但只能接近7,不会小于或等 于7,如图10-2-7中C所示。(4)碱性溶液中加酸pH变小,最终pH会小于7,如 图10-2-7中D所示。 图10-2-7
易错点 pH的测定及pH 与溶液酸碱性的关系
例 下列说法中正确的是 ( )A.pH大于7的溶液,一定是碱溶液B.向pH=1的酸溶液中不断加水,其pH能达到8C.将pH试纸伸入某溶液中测定其pHD.某溶液的pH=10,向其中滴入几滴酚酞溶液后,溶液呈红色
解析 有些溶液的pH大于7,但不是碱溶液,如碳酸钠溶液。pH=1的酸溶液 在稀释过程中pH不断增大,但不会大于或等于7。用pH试纸测溶液的pH 时,不能把pH试纸直接伸入待测液中,而应用玻璃棒蘸取少量待测液滴在 pH试纸上,把试纸显示的颜色与标准比色卡比较。
纠错点睛 酸性溶液不一定是酸溶液,碱性溶液不一定是碱溶液,盐溶液不 一定呈中性。pH可以反映溶液的酸碱度,但不能反映是否是酸或碱溶液。
中和反应的实验探究与微观实质素养呈现 通过对实验过程的分析与探究,能发现和提出有探究价值的化 学问题,并能依据探究目的设计并优化实验方案。能对观察记录的实验信 息进行加工并获得结论;能对实验过程出现的与理论不相符的情况进行讨 论、交流;能尊重事实和证据,具有独立思考、敢于质疑和批判的创新精 神。
素养解读 能运用所学过的化学知识独立地去解决问题,从而达到培养综 合运用化学理论知识的能力、独立实验的能力和创新能力。化学实验可 以深化学生对化学知识的理解、迁移和创新,对化学原理规律的发现、认 识和运用,以培养化学学科素养、化学信息素养、化学思维素养和化学语 言素养等。有关中和反应的实验探究及对微观实质的理解与应用也一直 是中考的热点内容。
例1 (2019内蒙古赤峰月考)在研究酸和碱的化学性质时,某小组同学想证 明:稀H2SO4与NaOH溶液混合后,虽然仍为无色溶液,但确实发生了化学反 应。请与他们一起完成实验方案的设计、实施和评价。(1)方案一:测定稀H2SO4与NaOH溶液混合前后的pH(20 ℃)①将pH试纸伸入某NaOH溶液中,测定NaOH溶液的pH,pH 7(选填 “大于”“等于”或“小于”);实验操作中的错误是 。②将一定量的稀H2SO4加入该NaOH溶液中,混合均匀后测定其pH,pH小于 7。结论:稀H2SO4与NaOH溶液发生了化学反应,并且 (填写溶质的化学 式)过量。(2)方案二:向盛有NaOH溶液的烧杯中先滴加酚酞试液,后滴加稀H2SO4至
过量,观察到 的现象。 图10-2-8结论:稀H2SO4与NaOH溶液发生了化学反应,反应的化学方程式为 。(3)上述两个方案在设计思想上的相同点是 。(4)为了进一步获取稀H2SO4与NaOH溶液确实发生了化学反应的证据,依据
中和反应是 (选填“放热”“吸热”或“无热量变化”)的 反应,采用同温下的稀H2SO4与NaOH溶液进行实验,整个实验中至少需要 测定溶液温度 次。(5)实验室存放的常见的碱除了氢氧化钠外,还有氢氧化钙,它们存放时都 需密封保存,请用化学方程式解释澄清石灰水必须密封保存的原因: 。
解析 (1)①氢氧化钠溶液呈碱性,其pH大于7;测定溶液的pH时,不能将pH 试纸伸入待测溶液中,以免污染试剂。②将一定量的稀H2SO4加入该NaOH 溶液中,混合均匀后测定其pH,pH小于7,说明稀H2SO4与NaOH溶液发生了 化学反应,并且稀硫酸过量。(2)因为无色的酚酞试液在酸性与中性溶液中 均不变色,所以向盛有NaOH溶液的烧杯中先滴加酚酞试液,后滴加稀硫酸 至过量,可观察到溶液由红色变成无色。(3)两个方案在设计思想上的相同 点是都采用了间接观察的方法。(4)中和反应为放热反应,可以通过测定反 应前后溶液的温度变化来进行确定,反应前测定起始温度,反应中测定温度 是否升高,加入过量的硫酸再测定溶液的温度是否降低,故最少需要测定3 次。(5)氢氧化钙能与空气中的二氧化碳反应生成碳酸钙白色沉淀和水。
答案 (1)①大于 将pH试纸伸入NaOH溶液中 ②H2SO4 (2)溶液由红 色变成无色 2NaOH+H2SO4 Na2SO4+2H2O (3)都采用了间接观察的方法 (4)放热 3 (5)CO2+Ca(OH)2 CaCO3↓+H2O
例2 (2018山东滨州无棣模拟)某化学兴趣小组的三位同学在学习了盐酸 与氢氧化钙的反应后,分别结合自己在实验室中所做的实验,从不同方面对 其进行图像描述。 图10-2-9 图10-2-10
图10-2-11图10-2-9是实际操作图,图10-2-10是反应过程中溶液的温度变化图,图10-2- 11是微观粒子结合过程的示意图。请结合图示回答下列问题。(1)图10-2-9中未滴加稀盐酸时,烧杯中溶液呈 色。(2)如图10-2-10所示,稀盐酸与氢氧化钙溶液的中和反应是 (填“吸
热”“放热”或“无热量变化”)反应,该反应的化学方程式为 。(3)如图10-2-10所示,在C点溶液中加入碳酸钙,现象为 。(4)图10-2-11表示该反应前后溶液中存在的主要离子,写出下列图形代表 的离子。 , 。(填离子符号)
解析 (1)未滴加稀盐酸时,烧杯中溶液是滴有酚酞的氢氧化钙溶液,氢氧 化钙溶液显碱性,能使酚酞溶液变红。(2)稀盐酸与氢氧化钙溶液发生中和 反应时温度升高,说明反应放热。(3)C点稀盐酸过量,稀盐酸和碳酸钙反应 生成氯化钙、水和二氧化碳,因此现象为碳酸钙溶解,产生气泡。(4)氢氧 化钙和稀盐酸反应生成氯化钙和水,其中氢氧根离子和氢离子结合生成水 分子,而钙离子和氯离子仍然存在于溶液中,因此 表示OH-, 表示H+。
答案 (1)红 (2)放热 Ca(OH)2+2HCl CaCl2+2H2O (3)碳酸钙溶解,产生气泡 (4)OH- H+
1.(2019湖北襄阳模拟)下列反应属于中和反应的是 ( )A.Mg+2HCl MgCl2+H2↑B.CaO+2HCl CaCl2+H2OC.K2CO3+H2SO4 K2SO4+H2O+CO2↑D.KOH+HNO3 KNO3+H2O
答案 D 中和反应是酸与碱作用生成盐与水的反应,题给四个反应中只 有D是中和反应。
2.(2019北京海淀模拟)下列关于“酸和碱的中和反应实验”的说法中,正 确的是 ( ) 图10-2-1A.若不使用酚酞,HCl就无法和NaOH反应B.酚酞由红色变为无色,说明发生了中和反应C.滴加酚酞前溶液为无色,加入稀盐酸后溶液仍为无色,说明没有发生反应
D.若将酚酞换成石蕊,则不能达到实验目的
答案 B 无论有没有酚酞的存在,HCl和NaOH都会反应生成氯化钠和水, 故A错误;酚酞由红色变成了无色,说明溶液中能使酚酞变红的氢氧化钠与 盐酸发生了中和反应,故B正确;氢氧化钠溶液和滴有酚酞溶液的氯化钠溶 液都是无色的,不能根据溶液的颜色没有改变就认为没有发生反应,故C错 误;紫色石蕊溶液在碱性溶液中呈蓝色,在中性溶液中呈紫色,在酸性溶液 中呈红色,可以通过紫色石蕊溶液的颜色变化判断反应是否发生,故D错 误。
3.(2018重庆江津期中)探究酸与碱的反应。(1)稀盐酸与氢氧化铜反应,可以直接观察现象来确认。该反应现象为 ,证明稀盐酸与氢氧化铜发生了反应。(2)稀盐酸与氢氧化钠溶液反应时无明显现象,可借助酸碱指示剂使反应现 象外显可见。如图10-2-2所示,通过观察 的现象,证明氢氧 化钠溶液与盐酸发生了反应。本实验选用无色酚酞溶液比紫色石蕊溶液 更合适的原因是 ,其反应的化学方程式 为 。 图10-2-2
(3)若要证明盐酸与氢氧化钠溶液反应后,盐酸是否过量,下列所给的药品 中,可以选择 。①无色酚酞溶液 ②紫色石蕊溶液 ③铁粉 ④铜粉 ⑤氧化铁
答案 (1)蓝色固体溶解,得到蓝色溶液 (2)溶液由红色变为无色 颜色 变化明显,便于观察 NaOH+HCl NaCl+H2O (3)②③⑤
解析 (1)氢氧化铜是一种蓝色固体,能与稀盐酸反应得到氯化铜蓝色溶 液,所以可观察到蓝色固体溶解,得到蓝色溶液。(2)氢氧化钠溶液呈碱性, 能使酚酞溶液变红,而酸性和中性溶液不能使酚酞溶液变色,故若溶液由红 色变为无色,则证明氢氧化钠溶液和稀盐酸发生了反应。用紫色石蕊溶液 作指示剂时,溶液颜色由蓝色变成紫色,颜色变化不明显。(3)酸性和中性 溶液均不能使无色酚酞溶液变色;若盐酸过量,则能使紫色石蕊溶液变红; 若盐酸过量,则能与铁粉反应产生气体;盐酸不与铜粉反应;若盐酸过量,则 能与氧化铁反应得到黄色的溶液。
知识点二 中和反应在实际中的应用
4.(独家原创试题)中和反应在工农业生产和日常生活中有着广泛的应用。 下列应用与中和反应原理无关的是 ( )A.使用熟石灰改良酸性土壤B.用消石灰和硫酸铜溶液配制波尔多液C.用含氢氧化铝的药物治疗胃酸过多D.用烧碱溶液洗涤石油产品中残余的硫酸
答案 B 用熟石灰改良酸性土壤、用含氢氧化铝的药物治疗胃酸过 多、用烧碱溶液洗涤石油产品中残余的硫酸,利用的都是中和反应原理。
5.(独家原创试题)研究发现,多吃碱性食物有利于身体健康。下面是一些 食物pH范围,其中显碱性的是 ( )
A.柠檬汁 B.葡萄汁 C.牛奶 D.豆浆
答案 D 柠檬汁、葡萄汁、牛奶的pH都小于7,显酸性;豆浆的pH为7.4~ 7.9,大于7,显碱性。
6.(2019天津中考)一些物质的近似pH如图10-2-3,下列有关说法正确的是 ( ) 图10-2-3A.苹果汁的酸性比纯鲜牛奶的酸性弱B.肥皂水的碱性比炉具清洁剂的碱性强C.厕所清洁剂与炉具清洁剂能混用D.人被某些蚊虫叮咬后可涂抹肥皂水以减轻痛痒
答案 D 苹果汁的pH比纯鲜牛奶的小,即苹果汁酸性比纯鲜牛奶的酸性 强;炉具清洁剂的pH比肥皂水的大,即肥皂水的碱性比炉具清洁剂的碱性 弱;厕所清洁剂显酸性,炉具清洁剂显碱性,厕所清洁剂不能与炉具清洁剂 混用;蚊虫分泌的蚁酸显酸性,人被某些蚊虫叮咬后可涂抹显碱性的肥皂水 减轻痛痒。
7.图10-2-4表示的是一些物质在常温下的近似pH,回答下列问题: 图10-2-4(1)厨房清洁剂显 性,在少量厨房清洁剂中滴入几滴酚酞,溶液呈 色;(2)酸雨的酸性比正常雨水的酸性 (填“强”或“弱”);(3)测量苹果汁pH时,pH试纸是否需要先用蒸馏水润湿 (填“是” 或“否”)。
答案 (1)碱 红 (2)强 (3)否
解析 (1)厨房清洁剂的pH大于7,呈碱性,能使酚酞溶液变红;(2)酸雨的pH 比正常雨水的pH小,酸性更强;(3)测溶液的pH时,若pH试纸先用水润湿,则 相当于将待测液稀释,可能导致结果出现偏差。
1.(2019山东淄博沂源一模)将40 g溶质质量分数2%的氢氧化钠溶液和40 g 溶质质量分数2%的稀硫酸混合,向所得溶液中滴加少量紫色石蕊试液,试 液显示的颜色是 ( )A.红色 B.紫色 C.蓝色 D.不确定
答案 C 硫酸与氢氧化钠反应的质量比如下:H2SO4+2NaOH Na2SO4+2H2O98 80可知,98份质量的硫酸与80份质量的氢氧化钠恰好完全反应,则40 g溶质质 量分数2%的氢氧化钠溶液和40 g溶质质量分数2%的稀硫酸混合,完全反 应后氢氧化钠有剩余,所得溶液显碱性,能使紫色石蕊试液变蓝。
2.(2017安徽合肥二模)下图为氢氧化钠溶液和稀硫酸反应的微观示意图, 下列说法不正确的是 ( ) A.反应前后原子的数目减少B.该反应属于中和反应C.甲表示Na+D.反应前后元素的种类没有改变
答案 A 由质量守恒定律可知,反应前后原子的数目不变;氢氧化钠能与 硫酸发生中和反应生成硫酸钠和水;由微观示意图可知,甲表示钠离子;反 应前后元素的种类没有改变。
1.(2019山东潍坊中考)已知生活用品中厕所清洁剂的pH=1,厨房清洁剂的 pH=12。下列说法不正确的是 ( )A.厕所清洁剂加水稀释,溶液pH升高B.厨房清洁剂可能含有氢氧化钠C.两者混合使用能提高清洁效果D.厕所清洁剂可能使铁制下水道腐蚀
答案 C 厕所清洁剂的pH=1,呈酸性,加水稀释酸性减弱,pH升高,故A正 确;厨房清洁剂的pH>7,呈碱性,可能含有氢氧化钠,故B正确;厕所清洁剂呈 酸性,厨房清洁剂呈碱性,二者混合会发生反应,降低清洁效果,故C错误;厕 所清洁剂的pH=1,呈酸性,能和铁反应,故D正确。
2.(2019北京房山二模)实验小组用传感器探究NaOH溶液与稀盐酸反应过 程中pH的变化。测定结果如图10-2-5所示。下列说法正确的是 ( ) 图10-2-5A.在0 s至40 s之间,溶液中的溶质为HCl、NaCl和H2OB.20 s时,溶液显碱性C.60 s时,取适量所得溶液加入锌粒,有气泡产生D.该实验是将NaOH溶液滴入稀盐酸中
答案 D 在0 s至40 s之间,溶液的pH小于7,显酸性,溶液中的溶质为 HCl、NaCl;20 s时,溶液的pH小于7,显酸性;60 s时溶液的pH大于7,显碱性, 取适量溶液加入锌粒,没有气泡产生;图像中pH的变化是从小于7逐渐增大 到大于7,可知原溶液显酸性,然后不断地加入碱性溶液,使pH增大,说明是 把氢氧化钠溶液滴加到稀盐酸中。
3.某工厂排放的废水中含有硫酸,原来采用氢氧化钠溶液处理,通过调节流 量阀,使最终排出的溶液呈中性(如图10-2-6 所示)。现改用氢氧化钾溶液 处理以得到钾肥,若氢氧化钾溶液的溶质质量分数与原来所用氢氧化钠溶 液的溶质质量分数相同(假设两种碱液的密度相同),在废水流量不变的情 况下,碱液的流量阀应做的调节为 ( ) 图10-2-6A.保持不变 B.加大流量C.减小流量 D.无法确定
答案 B 两个反应的化学方程式及酸与碱的质量关系如下:2NaOH+H2SO4 Na2SO4+2H2O 80 982KOH+H2SO4 K2SO4+2H2O 112 98中和等质量的H2SO4需要KOH的质量大于NaOH的质量,故改用KOH溶液 后应加大碱液的流量。
4.(2019安徽滁州三模)某校化学小组在利用盐酸和氢氧化钠溶液探究酸碱 中和反应时,利用数字化传感器测得烧杯中溶液pH的变化图像如甲所示, 溶液的温度变化如乙所示(不考虑反应过程中热量损失)。下列说法中错 误的是 ( ) 图10-2-7
A.当加入20 g氢氧化钠溶液时恰好完全反应B.a点时溶液中的溶质为氢氧化钠和氯化钠C.温度上升是因为中和反应放热,温度下降是因为增加液体降温D.B点时溶液中的溶质为氯化钠
答案 A 由题图可知,随着溶液不断加入,pH逐渐变小,所以横坐标是加 入盐酸的质量,而不是氢氧化钠溶液的质量,A说法不正确;a点时溶液的pH 大于7,显碱性,溶质为氢氧化钠和氯化钠,B说法正确;由溶液的温度变化图 可知,温度上升是因为中和反应放热,温度下降是因为增加液体降温,C说法 正确;B点时溶液放出的热量最高,此时氢氧化钠和盐酸恰好完全反应,溶液 中的溶质为氯化钠,D说法正确。
5.生活中常用洁厕灵的主要成分是盐酸,炉具清洁剂的主要成分是氢氧化 钠。将洁厕灵滴入炉具清洁剂中,如图10-2-8 甲所示。 图10-2-8
图10-2-9(1)甲中发生反应的化学方程式为 。(2)若反应后溶液呈红色,则反应后溶液中的溶质是(酚酞除外) ,此时溶液可用图10-2-8乙中 (选填“A”“B”或“C”)点表 示。(3)图10-2-9所示反应没有明显现象,为证明反应发生,可选用的试剂有
A.无色酚酞溶液 B.硝酸钾溶液 C.硝酸银溶液图10-2-9中a代表 。
答案 (1)NaOH+HCl NaCl+H2O (2)NaCl、NaOH A (3)A H2O
解析 (1)氢氧化钠与盐酸反应生成氯化钠和水。(2)若反应后溶液呈红 色,说明氢氧化钠有剩余,故此时溶质为氯化钠和氢氧化钠,此时溶液可用 乙中的A点表示。(3)氢氧化钠可以和盐酸反应生成氯化钠和水,但没有明 显现象,为证明反应发生,可在反应前向碱溶液中加入无色酚酞溶液,随着 不断加酸,溶液由红色逐渐变为无色,可证明发生了反应。
6.(2019浙江金华中考)某兴趣小组对氢氧化钡溶液和稀盐酸混合后是否发 生了化学反应展开了系列实验。【实验操作】用试管取6毫升氢氧化钡溶液,往试管中加入6毫升稀盐酸,等分成两份。 图10-2-10【实验证明】(1)往其中一份混合液中滴入几滴酚酞试液,发现溶液呈无色。说明溶液中 不存在的离子是 ,证明两者发生了反应。【继续探究】(2)能否再设计一个实验证明盐酸中H+参加了反应?于是往混合液中滴入
石蕊试液,发现溶液变成红色,溶液呈酸性,这不能证明盐酸中H+参加了反 应。讨论后,形成了新的对照实验方案,将步骤补充完整:①往盛有另一份混合液的试管中,加入足量的镁片;② ,加入等量的镁片。(3)证明原混合液的盐酸中H+参加了反应的现象是 。【微观解释】(4)从微观上分析:氢氧化钡溶液和稀盐酸反应的实质是 。
答案 (1)氢氧根离子(或OH-) (2)②另用试管取3 mL相同质量分数的稀 盐酸和3 mL水混合 (3)第①步产生的气体比第②步少 (4)氢氧根离子和 氢离子结合生成水分子
解析 【实验证明】往混合液中滴入酚酞试液,溶液呈无色,说明溶液中不 存在的离子是氢氧根离子,证明氢氧化钡和稀盐酸发生了反应。【继续探 究】要证明稀盐酸中的氢离子发生了反应,可以往盛有另一份混合液的试 管中加入足量的镁片,另用试管取3 mL相同质量分数的稀盐酸和3 mL水混 合,加入等量的镁片,根据第①步产生的气体比第②步少,可证明氢离子部 分参加了反应。【微观解释】从微观上分析,氢氧化钡溶液和稀盐酸反应 的实质是氢氧根离子和氢离子结合生成水分子。
1.图Ⅰ中甲、乙、丙、丁表示相邻两物质相互混合过程中溶液酸碱度的 变化,其中可能符合图Ⅱ所示变化关系的是 ( ) 图Ⅰ 图ⅡA.甲 B.乙 C.丙 D.丁
答案 D 图Ⅱ中pH从大于7逐渐减小到小于7,说明是把酸性溶液滴加到 碱性溶液中,故只有丁符合。
2.向盛有10 mL NaOH溶液(其中滴有少量无色酚酞溶液)的烧杯中逐滴加 入稀盐酸,用pH计(用来精确测定溶液pH的仪器)测定溶液的pH,所得数据 如下:
(1)当加入稀盐酸的体积为 mL时,NaOH溶液和稀盐酸恰好完全反 应。(2)当加入稀盐酸的体积为3 mL时,溶液呈 色;当加入稀盐酸的体积 为14 mL时,溶液呈 色。
(3)当烧杯中溶液的pH=2.1时,溶液中的溶质有 (指示剂 除外)。
答案 (1)10 (2)红 无 (3)氯化钠、氯化氢
解析 由表中数据可知:当加入稀盐酸10 mL时,溶液呈中性,酸、碱恰好完 全反应;当加入稀盐酸3 mL时,溶液显碱性,溶液为红色;当加入稀盐酸14 mL时,溶液显酸性,溶液为无色;当加入稀盐酸12 mL时,溶液的pH=2.1,盐酸 过量,此时溶液中的溶质除酚酞外有氯化钠和氯化氢。
1.(2019吉林长春一模,3,★☆☆)一些物质的pH范围如下,其中呈碱性的是 ( )A. 油污净(12~13) B. 西瓜汁(5~6)C. 洁厕灵(1~2) D. 橘子汁(3~4)
答案 A 油污净的pH大于7,呈碱性;西瓜汁的pH小于7,呈酸性;洁厕灵的 pH小于7,呈酸性;橘子汁的pH小于7 ,呈酸性。
2.(2019山东淄博淄川模拟,7,★☆☆)同样是清洁剂,炉具清洁剂有强碱性, 而厕所清洁剂则有强酸性,用这两种清洁剂进行实验得到的结果一定有误 的是 ( )A. 测得炉具清洁剂pH=13B. 测得厕所清洁剂pH=8C. 炉具清洁剂使无色酚酞溶液变红D. 厕所清洁剂使紫色石蕊溶液变红
答案 B pH大于7时,溶液呈碱性,且pH越大,碱性越强,炉具清洁剂有强 碱性,则炉具清洁剂的pH可能为13;pH小于7时,溶液呈酸性,厕所清洁剂有 强酸性,测得的pH应该小于7;炉具清洁剂呈碱性,能使无色酚酞溶液变红; 厕所清洁剂呈酸性,能使紫色石蕊溶液变红。
3.(2019江苏南京高淳二模,9,★☆☆)一些食物的近似pH如下:
下列说法不正确的是 ( )A.鸡蛋清显碱性B. 酱油和苹果汁显酸性C.牛奶比酱油酸性强D. 胃酸过多的人不宜多饮苹果汁
答案 C 鸡蛋清的pH大于7,显碱性;苹果汁、酱油的pH都小于7,都显酸 性;牛奶和酱油的pH都小于7,且酱油pH更小,所以牛奶比酱油酸性弱;胃酸 过多的人不适宜吃酸性食物,苹果汁呈酸性,不宜多饮。
4.(2018江苏徐州一模,16,★★☆)同学们在实验室将5%的NaOH溶液逐滴 加入14 g 稀盐酸中,边加边搅拌,随着NaOH溶液的不断加入,溶液pH的变 化如图10-2-11所示。请回答: 图10-2-11(1)a点溶液中含有的阳离子有 。(2)当pH=7时,消耗NaOH的质量为 g。(3)求恰好完全反应时所得溶液中溶质的质量分数(写出计算过程,最后结
答案 (1)Na+、H+ (2)0.8(3)解:设生成NaCl的质量为xNaOH+HCl NaCl+H2O40 58.50.8 g x = x=1.17 g恰好完全反应时所得溶液中溶质的质量分数为 ×100%=3.9%答:恰好完全反应时所得溶液的溶质质量分数为3.9%。
解析 (1)a点时溶液的pH小于7,呈酸性,溶质除生成的氯化钠外还有氯化 氢,所以溶液中含有的阳离子为钠离子和氢离子。(2)由题图可知,当pH=7 时,消耗NaOH的质量为16 g ×5%=0.8 g。(3)恰好完全反应时,消耗NaOH的 质量为0.8 g,根据氢氧化钠与盐酸反应的化学方程式,由氢氧化钠的质量可 以计算出生成氯化钠的质量,从而计算出恰好完全反应时所得溶液的溶质 质量分数。
1.(2019河北唐山古冶一模,12,★☆☆)小强同学想将某稀硫酸的pH升高,他 采取的方法有:(1)不发生化学反应的方法: ;(2)有化学反应发生的方法:加入 (答一种试剂名称)。
答案 (1)加水 (2)锌粒(合理即可)
解析 (1)稀硫酸的酸性越弱,pH越大,所以用不发生化学反应的方法将稀 硫酸的pH升高,可加水稀释。(2)有化学反应发生的方法,就是减少稀硫酸 中氢离子的含量,可加入金属或金属氧化物或碱或盐。
2.(2017北京门头沟一模,20,★★☆)向一定量的氢氧化钠溶液中逐滴加入 pH=2的稀盐酸至过量。下列图像中,能正确反映对应变化关系的是 ( )
答案 D A项,由于稀盐酸中有水,随着稀盐酸的加入,水的质量会一直增 加,故错误;B项,溶液的pH会随着稀盐酸的加入而减小,但不会小于或等于 2,只会接近2,故错误;C项,随着反应的进行,氯化钠的质量会不断增加,当反 应停止后不变,但是其质量分数由于稀盐酸的加入,会先增大后减小,故错 误;D项,随着反应的进行,氢氧化钠的质量不断减小直至为0,氢氧化钠的质 量分数也会不断减小直至为0,故正确。
1.(2019湖南邵阳中考,13,★☆☆)下列食物的pH如下:苹果汁(2.9~3.3)、葡 萄汁(3.5~4.5)、牛奶(6.3~6.6)、鸡蛋清(7.6~8.0)。其中胃酸过多的人最适 合吃 ( )A.牛奶 B.鸡蛋清 C.葡萄汁 D.苹果汁
答案 B 胃酸过多的人最适合吃显弱碱性的食物,四种食物中只有鸡蛋 清的pH大于7,呈弱碱性,故选B。
2.(2019山东滨州中考,10,★☆☆)下列有关测定氢氧化钠溶液pH的实验操 作或描述,你认为正确的是 ( )A.用镊子夹取pH试纸直接伸入氢氧化钠溶液中测量B.先用蒸馏水将pH试纸润湿,再用滴管吸取氢氧化钠溶液滴到pH试纸上 测量C.用洁净干燥的玻璃棒蘸取氢氧化钠溶液滴到pH试纸上,再与标准比色卡 对照D.用pH试纸测得该氢氧化钠溶液的pH=12.6
答案 C 将pH试纸伸入待测液中,会污染试剂,A错误;用蒸馏水湿润pH 试纸,稀释了待测溶液,使溶液的碱性减弱,会使测定结果偏小,B错误;用洁 净干燥的玻璃棒蘸取待测液,滴到pH试纸上,再与标准比色卡对照读数,C 正确;用pH试纸测量溶液的pH,所得结果均为整数,D错误。
3.(2019四川成都中考,9,★☆☆)身边一些物质的pH如图10-2-12,下列说法 正确的是 ( ) 图10-2-12A.pH试纸浸入溶液中测其酸碱度B.厕所清洁剂不会腐蚀大理石地面C.蚊虫叮咬后涂牙膏可减轻痛痒D.橘子的酸性强于柠檬
答案 C 用pH试纸测定溶液的酸碱度时,不能把试纸直接浸入待测液中, A说法错误;厕所清洁剂呈强酸性,会和大理石反应,B说法错误;蚊虫叮咬人 时,会分泌某种酸性物质,让人产生痛痒的感觉,牙膏呈碱性,可以中和酸性 物质,C说法正确;柠檬的pH小于橘子的pH,所以柠檬的酸性强于橘子。
4.(2018湖南益阳中考,17,★☆☆)某校化学小组在利用硫酸和氢氧化钠溶 液探究酸碱中和反应时,测得烧杯中溶液pH的变化如图10-2-13所示。下 列说法正确的是 ( ) 图10-2-13A.a 点所示溶液呈酸性B.向 b 点所示溶液中滴加石蕊溶液,溶液呈紫色C.该实验是将 NaOH 溶液逐滴滴入稀硫酸中D.c 点所示溶液中,含有的溶质是 Na2SO4和 NaOH
答案 B a点所示溶液的pH大于7,呈碱性;b点所示溶液的pH等于7,呈中 性,向b点所示溶液中滴加石蕊溶液,溶液呈紫色;由图像可知,起始pH>7,说 明是把稀硫酸滴加到氢氧化钠溶液中;c点所示溶液的pH小于7,呈酸性,含 有的溶质是Na2SO4和H2SO4。
5.(2019四川凉山中考,27,★☆☆)某工厂化验室用15%的氢氧化钠溶液洗 涤一定量石油产品中的残余硫酸(该产品中其他物质不与氢氧化钠反应), 消耗氢氧化钠溶液的质量与反应过程中溶液的pH关系如图10-2-14所示。 图10-2-14(1)图中A点表示的意义是 。(2)求这一石油产品中残余硫酸的质量(写出计算过程)。
答案 (1)酸、碱恰好中和(2)A点消耗的氢氧化钠的质量为40 g×15%=6 g设石油产品中残余硫酸的质量为xH2SO4+2NaOH Na2SO4+2H2O98 80 x 6 g = x=7.35 g答:石油产品中残余硫酸的质量为7.35 g。
解析 (1)题图中A点对应的pH=7,溶液呈中性,表示酸、碱恰好中和;(2)A 点消耗的氢氧化钠的质量为40 g×15%=6 g,根据氢氧化钠与硫酸反应的化 学方程式,由氢氧化钠的质量可以计算出硫酸的质量。
1.(2019山东威海中考,3,★☆☆)用pH计测得一些物质的pH如下:
下列说法正确的是 ( )A.牛奶放置一段时间后变酸,pH变大B.等量的西瓜汁比苹果汁所含氢离子数多C.炉具清洁剂的碱性比鸡蛋清的碱性强D.胃酸过多的人应该多喝苹果汁
答案 C pH<7溶液呈酸性,酸性越强,溶液的pH越小,牛奶放置一段时间 后变酸,溶液酸性增强,pH变小;等量的溶液酸性越强,含有的氢离子越多,从 题表中的数据看,苹果汁的pH小,酸性强,故等量的苹果汁比西瓜汁所含氢 离子数多;pH>7溶液呈碱性,pH越大,碱性越强,炉具清洁剂的pH大于鸡蛋 清,故炉具清洁剂的碱性强;苹果汁的pH小于7,呈酸性,胃酸过多的人不宜 多喝苹果汁。
2.(2015山东德州中考,13,★☆☆)将稀盐酸慢慢滴入盛有氢氧化钠溶液的 烧杯中,用温度计测量烧杯中溶液的温度,温度随加入稀盐酸的质量变化曲 线如下图所示: (1)在滴加的过程中,烧杯中溶液的pH逐渐 (填“增大”“减小” 或“不变”)。(2)由图可知,稀盐酸与氢氧化钠溶液发生的反应是 (填“放热”或 “吸热”)反应。
(3)图中B点时,溶液中的溶质是 (填化学式)。
答案 (1)减小 (2)放热 (3)NaCl
解析 (1)向氢氧化钠溶液中逐滴滴加稀盐酸,溶液的pH会逐渐减小;(2)由 题图可知,稀盐酸与氢氧化钠发生的反应是放热反应;(3)B点时稀盐酸和氢 氧化钠恰好完全反应,溶液中的溶质为氯化钠。
(2019四川雅安中考节选)某化学兴趣小组用实验室常用药品(或溶液)对 “NaOH溶液与稀盐酸是否恰好完全反应”进行探究。【知识卡片】:氯化钠溶液显中性。氯化铜易溶于水。【实验探究】:(1)方案Ⅰ:某同学先向试管中加入约2 mL NaOH溶液,再滴入几滴酚酞溶 液,溶液变红。然后慢慢滴入稀盐酸,边滴边振荡,直至溶液恰好变为无 色。①实验结论: 。②从微观的角度分析,该反应的实质是 。
【实验反思】:(3)另有同学提出方案Ⅱ不能证明NaOH溶液与稀盐酸恰好完全反应,其原 因是 。(4)除以上方案外,下列哪些物质单独使用,也能证明“NaOH溶液与稀盐酸 是否恰好完全反应” (填序号)。A.铜片 B.pH试纸C.氧化铜 D.紫色石蕊试液
答案 (1)①NaOH溶液与稀盐酸已恰好完全反应 ②H+和OH-反应生成H2O分子(或H++OH- H2O) (2)有气泡产生 (3)稀盐酸量不足的情况下,也无明显现象 (4)B、D
解析 本题通过对中和反应的探究,考查了能依据探究目的设计并优化实 验方案,完成实验操作的核心素养。(1)①向试管中加入约2 mL NaOH溶 液,再滴入几滴酚酞溶液,溶液变红。然后慢慢滴入稀盐酸,边滴边振荡,直 至溶液恰好变为无色,从而证明NaOH溶液与稀盐酸恰好完全反应。②中 和反应的实质是H+和OH-反应生成H2O分子。(2)由结论可知稀盐酸过量, 则加入镁条后会有气泡产生。(3)方案Ⅱ若没有明显现象,则有两种可能: 一是恰好完全反应,二是稀盐酸量不足。(4)铜片与稀盐酸及氢氧化钠都不 反应,故A不能证明。用pH试纸测pH, 当pH=7时,溶液呈中性,即恰好完全反应;当pH>7时,溶液呈碱性,即碱有剩 余;当pH<7时,溶液呈酸性,即酸有剩余,故B可以证明。当溶液呈中性或碱 性时,加入氧化铜都无明显现象,故C不能证明。加入紫色石蕊试液,若仍为 紫色,则恰好完全反应;若变为红色,则酸有剩余;若变为蓝色,则碱有剩余,
稀硫酸和氢氧化钠反应没有明显现象,老师在课堂上欲带领同学们设计 实验证明它们之间发生了化学反应。(1)化学反应过程中通常有能量变化,查阅资料发现中和反应是放热反应, 刘梅同学提出可以在氢氧化钠固体中滴加稀硫酸,测量反应过程中温度的 变化情况以达到实验的目的。这一方案立即被其他同学认为不完善,你认 为方案不完善的原因是 。大家一起 讨论了实验改进方案,大家都认为该实验要得到科学的结论需要控制相等 的量是 。随后大家根据科学的方案重新 进行了实验,实验中温度随滴加稀硫酸体积的变化情况记录如下表:
分析以上数据,氢氧化钠完全反应时消耗的稀硫酸的体积是 mL; 继续滴加稀硫酸,温度降低的原因是 。(2)请设计出一种不同的实验方法证明氢氧化钠溶液中加入稀硫酸时两者 发生了化学反应 。
答案 (1)氢氧化钠固体溶解放热,给实验带来干扰反应前酸、碱溶液温度相同 6 硫酸过量,存在热传递(2)向氢氧化钠溶液中滴入几滴酚酞溶液,再逐滴加入稀硫酸,溶液由红色 变为无色,说明二者发生了化学反应(合理即可)
人教版九年级下册课题2 酸和碱的中和反应图片课件ppt: 这是一份人教版九年级下册课题2 酸和碱的中和反应图片课件ppt,共17页。PPT课件主要包含了中和反应,内容提要,奇妙的“变色花”,猜想与假设,设计实验方案,新知学习,盐酸与氢氧化钾,盐酸与氢氧化钙,硫酸与氢氧化钾,硫酸与氢氧化钠等内容,欢迎下载使用。
化学九年级下册课题2 酸和碱的中和反应集体备课ppt课件: 这是一份化学九年级下册课题2 酸和碱的中和反应集体备课ppt课件,共24页。PPT课件主要包含了Cl-,SO42-,Na+,OH-,Ca2+,碱→金属离子+OH-,想一想,实验10-8,H+和OH-,发生了中和反应等内容,欢迎下载使用。
初中化学人教版九年级下册第十单元 酸和碱课题2 酸和碱的中和反应评课课件ppt: 这是一份初中化学人教版九年级下册第十单元 酸和碱课题2 酸和碱的中和反应评课课件ppt,共60页。PPT课件主要包含了关注生活,知识点一中和反应,H2O,处理突发事件,课堂练习,反思提升,综合练习等内容,欢迎下载使用。














