






人教版九年级下册课题2 酸和碱的中和反应图文课件ppt
展开酸溶液中都含有大量的H+,表现出酸性;碱溶液中都含有大量的OH-,表现出碱性。那么,酸与碱能发生反应吗?
1、掌握中和反应的概念和实质;2、了解中和反应在实际生活中的应用;3、知道溶液酸碱度的表示方法——PH;4、学会利用PH试纸测定溶液的酸碱度;5、了解溶液酸碱度的意义。
酸和碱之间会发生什么反应?
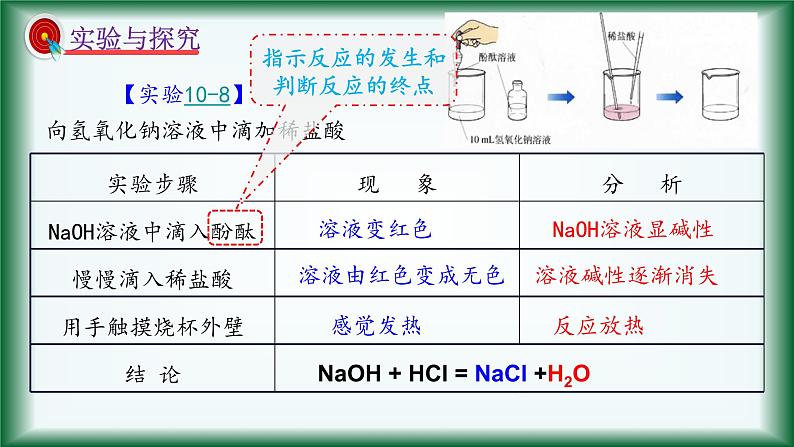
稀盐酸与氢氧化钠溶液直接混合
你能设计出可行的方案证明稀盐酸和氢氧化钠之间发生了化学反应吗?
化学变化时常伴有颜色变化、放出气体、生成沉定、能量的变化(放热、吸热、发光)等。
【实验10-8】向氢氧化钠溶液中滴加稀盐酸
NaOH + HCl = NaCl +H2O
指示反应的发生和判断反应的终点
仿照NaOH与HCl的反应写出下列反应的化学方程式
KOH + H2SO4
Ca(OH)2 + HCl
Ca(OH)2 +H2SO4
酸和碱作用生成盐和水的反应
2NaOH + H2SO4 = Na2SO4 + 2H2O
酸 + 碱 = 盐 + 水
注意(1)酸碱中和反应生成盐和水,但有盐和水生成的反应不一定是中和反应,例如:
CO2+2NaOH=Na2CO3+H2O CuO+H2SO4=CuSO4+H2O
== K2SO4 + H2O
==CaCl2 + H2O
== CaSO4 + H2O
NaOH = Na+ + OH-
HCl = H+ + Cl-
氢氧化钠与盐酸反应的本质:盐酸与氢氧化钠溶液混合后,氢离子(H+)和氢氧根离子(OH-)结合成了水分子,导致溶液原有的酸、碱性相互“中和”
H+ + OH- = H2O
想一想: H+与 OH- 在同一溶液中能够共存吗?
反应前后溶液中离子发生了怎样的变化?
2.下列各组物质通常借助指示剂才能证明是否反应的是( )A.氢氧化铜和稀盐酸B.石灰石和稀盐酸C.氢氧化钙与二氧化碳反应D.烧碱和稀硫酸
提示:氢氧化铜是一种难溶的碱
1.下列反应,属于中和反应的是( )A.Zn +2HCl == ZnCl2 + H2↑B.CuO + 2HCl == CuCl2 + H2OC.Cu(OH)2 + H2SO4 == CuSO4 + 2H2OD.AgNO3 + HCl == AgCl↓ + HNO3
利用中和反应原理,向土壤中加入酸性或碱性物质,将土壤pH控制在最适宜农作物生长的范围之内。如撒熟石灰中和酸性土壤。
二、中和反应在实际中的应用
能用生石灰代替熟石灰吗?为什么?
酸性或碱性废水必须先进行处理,达标后才可以排放,否则会造成水体污染。
Ca(OH)2 + H2 SO4 == CaSO4 + 2H2O
硫酸厂的污水中含有硫酸等杂质,可以用熟石灰进行中和处理
印染厂的废水呈碱性,可加入硫酸进行中和
思考:化学实验产生的酸性或碱性废液能否直接倒入下水道中?应如何处理?
不能直接倒入下水道中,应该用相应试剂将溶液调节为中性,再倒入指定的容器中统一处理。
中和蚊虫叮咬时“注射”的蚁酸可以用含碱性物质的溶液,如肥皂水、稀氨水。
氢氧化铝能中和胃酸,你能写出化学方程式吗?
Al(OH)3 + 3HCl = AlCl3 + 3H2O
想一想:能用氢氧化钠来代替氢氧化铝吗?
胃酸的主要成分是 。胃药的主要成分氢氧化铝。
科学实验需将溶液的pH控制在一定范围内。若溶液酸碱性太强或太弱,都可用适当的碱或酸调节溶液pH。
【讨论】根据你的生活经验或查阅资料,举出利用中和反应的实例。
魔芋豆腐在烹制前需要和醋煮,以便除去涩味
皮蛋有涩味,呈碱性,在食用前可用食醋中和
实验室中含有酸液的废水直接到入下水道会造成铸铁管道腐蚀,可用碱液将废液中和后再排放
开水壶内的水垢【主要成分是CaCO3和Mg(OH)2】可用醋酸来洗涤
1.下列实际应用中,利用中和反应原理的是( )①用氢氧化钠溶液洗涤石油产品中的残余硫酸;②用碳酸氢钠治疗胃酸过多;③用熟石灰改良酸性土壤;④用稀氨水涂抹在蚊子叮咬处止痒。A.①② B.①②③④ C.②③ D.①③④
2.用下列物质的序号填空:①食醋 ②熟石灰 ③稀盐酸 ④碳酸钙 ⑤氢氧化铝(1)农业上用来改良酸性土壤的是 ;(2)常用来治疗胃酸过多的药物是 ;(3)芋头中含有一种生物碱,沾到手上后会奇痒难忍,使用 涂抹手部可消除痒感。
4.失去标签的三瓶无色液体,分别是稀HCl、蒸馏水、NaOH溶液,若只有酚酞,能否将它们鉴别出来?简述你的实验方案。
①分别取样滴加几滴酚酞试液,变红色的则是氢氧化钠,不变色的则是蒸馏水和稀盐酸。
②另取不变色的两种试剂(足量)分别加入上述变红色的氢氧化钠溶液中,若能使红色消失的,则是稀盐酸。不能使红色消失的则是蒸馏水。
3.填写下表(类别选填酸、碱、盐、氧化物)
5.小松同学在进行酸碱中和反应的实验时,向烧杯中的氢氧化钠溶液中滴加稀盐酸一会儿后,发现忘记了滴加指示剂。为了确定盐酸与氢氧化钠是否恰好完全反应,小松同学从烧杯中取少量反应后的溶液于一支试管中,并向试管中滴加几滴无色酚酞试液,振荡,观察到酚酞试液不变色。于是他得出“两种物质已恰好完全中和”的结论。
如果盐酸滴加过量,滴入酚酞试液也不变色
(2)请你另设计一个实验,证明第二种可能性。(可供选用的药品有:紫色石蕊试液、锌粒、石灰石)
(1)你认为他得出的结论是否正确 ,理由是 。
同学们都知道判断溶液是酸性还是碱性一般用酸碱指示剂(紫色石蕊溶液、无色酚酞溶液)
酸碱度:溶液的酸碱性强弱程度
如何判断溶液酸碱性的强弱程度呢?
三、溶液酸碱度的表示方法——PH
1.溶液酸碱度常用pH表示,pH的范围通常在0~14之间。
pH<7;溶液呈酸性,
pH>7;溶液呈碱性,
①粗略测定——pH试纸
测定时,在玻璃片或白瓷板上放一片pH试纸,用玻璃棒蘸取待测溶液滴在pH试纸上,半分钟后把试纸显示的颜色跟标准比色卡对照,即可得出溶液的pH。
一放、二蘸、三滴、四比
注意: a.不能直接把试纸浸入待测液,否则会污染试液。 b.不能先用蒸馏水湿润PH试纸,否则会稀释试液的浓度,测出来的PH值就不准确。c.PH试纸测定的精确度为1,不取小数。
②精确测定——pH计(酸度计)
(1)测定几种酸、碱、盐的稀溶液的pH
酸的溶液一定呈酸性,碱的溶液一定呈碱性,盐溶液不一定呈中性。
显碱性的不一定是碱溶液,显酸性的也不一定是酸溶液
观察上述溶液的PH值,你能得到什么结论?
(2)测定生活中一些物质的pH,说明它们的酸碱性。
⑶测定雨水的pH(因溶解有二氧化碳,正常雨水的pH约为5.6,酸雨的pH小于5.6),可以了解空气的污染情况;
⑷测定人体内或排出的液体的pH,可以了解人体的健康状况。
⑵在农业生产中,农作物一般适宜在pH为7或接近7的土壤中生长;
4.了解溶液的酸碱度有重要的意义。
⑴化工生产中许多反应必须在一定pH溶液里才能进行;
血液、组织间液和细胞内液的酸碱度都接近于中性,而且变化极小;
胃液的pH在0.9~1.5之间,在这样的环境中铁屑都可被溶解,但胃本身却能安然无恙。因为胃里有一层胶冻状粘液,在胃粘膜表面构成一个保护膜,用来保护胃,防止胃酸对其本身的腐蚀及胃蛋白酶对胃本身的消化,还能防止粗糙的食物对胃的机械性损伤。
答:碱性物质对头发有损坏作用。所以洗发液应选接近中性的,不要选碱性大的洗发液。然后再用微酸性的护发素来保护头发。
溶液酸碱度对头发的影响
讨论:溶液的酸碱度对头发有什么影响?对你选择洗发液有什么启示?
头发的主要成分是蛋白质,容易受碱性溶液的侵蚀。
1、下列各pH值表示溶液酸性最强的是( ) (A)pH=14 (B)pH=7 (C)pH=1 (D)pH=0
2、酸雨是指pH ( ) A.小于5.6的降水 B.等于5.6的降水 C.大于5.6的降水 D.小于7的降水
3、一些食物的近似pH如下:番茄4.0-4.4,苹果是2.9-3.3,牛奶是6.3-6.6,蛋清是7.6-8.0,下列说法不正确的是 ( )A.胃酸过多的人应少食苹果 B.番茄汁属酸性食品C.牛奶和鸡蛋清均属碱性食品 D.苹果汁酸性比牛奶强
4、测得生活中一些物质的pH如下表所示,下列说法正确的是( )
A.人体血液呈酸性 B.用NaOH可以治疗胃酸过多C.洗涤剂比肥皂水的碱性强 D.肥皂水能使蓝色石蕊试纸变红
5、某学生在研工业废水的利用中,把一瓶含氢氧化钠的废水的pH值调至小于7,所采取的下列方法中一定正确的是( )
A.往废水中滴加石蕊试液,再加入适量的蒸馏水稀释至无色 B.往废水中滴加石蕊和盐酸,至溶液显紫色 C.往废水中滴加石蕊和盐酸,至溶液显红色 D.往废水中滴加石蕊和盐酸,至溶液显蓝色
6、在盐酸和氢氧化钠反应的过程中,下图是利用数字化传感器得到的溶液pH变化图像。⑴反应的化学方程式为 ;⑵当溶液呈中性时,所消耗氢氧化钠溶液的体积是 mL; ⑶图中b点所示溶液中,含有的溶质是 。
NaOH + HCl = NaCl + H2O
7、把10g质量分数为10%的盐酸和10g质量分数为10%的烧碱溶液混合均匀后,再滴入石蕊试液,则溶液呈 色。
HCl + NaOH === NaCl + H2O
36.5 40
人教版九年级下册课题2 酸和碱的中和反应图片课件ppt: 这是一份人教版九年级下册课题2 酸和碱的中和反应图片课件ppt,共17页。PPT课件主要包含了中和反应,内容提要,奇妙的“变色花”,猜想与假设,设计实验方案,新知学习,盐酸与氢氧化钾,盐酸与氢氧化钙,硫酸与氢氧化钾,硫酸与氢氧化钠等内容,欢迎下载使用。
化学九年级下册课题2 酸和碱的中和反应集体备课ppt课件: 这是一份化学九年级下册课题2 酸和碱的中和反应集体备课ppt课件,共24页。PPT课件主要包含了Cl-,SO42-,Na+,OH-,Ca2+,碱→金属离子+OH-,想一想,实验10-8,H+和OH-,发生了中和反应等内容,欢迎下载使用。
初中化学人教版九年级下册第十单元 酸和碱课题2 酸和碱的中和反应评课课件ppt: 这是一份初中化学人教版九年级下册第十单元 酸和碱课题2 酸和碱的中和反应评课课件ppt,共60页。PPT课件主要包含了关注生活,知识点一中和反应,H2O,处理突发事件,课堂练习,反思提升,综合练习等内容,欢迎下载使用。














