






化学人教版 (2019)第三节 化学键课堂教学ppt课件
展开从元素周期表可以看出,到目前为止,已经发现的元素有一百多种。然而,由这一百多种元素的原子构成的物质已超过1亿中。那么,元素的原子之间通过什么作用形成如此丰富的物质呢?
从微观的角度看,化学反应的本质是原子的重新组合。
在化学反应的原子组合中,原子结合成物质时的相互作用发生了什么变化?
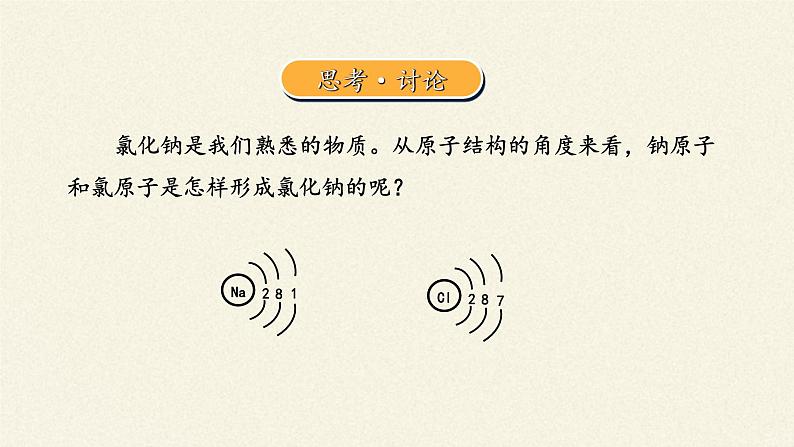
氯化钠是我们熟悉的物质。从原子结构的角度来看,钠原子和氯原子是怎样形成氯化钠的呢?
根据钠原子和氯原子的核外电子排布,钠原子要达到8电子的稳定结构,就需要失去1个电子;而氯原子要达到8电子稳定结构则需要获得1个电子。
钠与氯气反应时,钠原子的最外电子层上的1个电子转移到氯原子的最外层上,形成带正电荷的钠离子和带负电荷的氯离子。
带相反电荷的钠离子和氯离子,通过静电作用结合在一起,从而形成与单质钠和氯气性质完全不同的氯化钠。人们把这种带相反电荷粒子之间的相互作用叫离子键。
像氯化钠这样,由离子键构成的化合物叫做离子化合物。
通常,活泼金属与活泼非金属形成离子化合物
氯化钾的化学式是KCl,其中K是活泼金属,Cl是活泼非金属,因此氯化钾是离子化合物;氯化镁的化学式是MgCl2,其中Mg是活泼金属,Cl是活泼非金属,因此氯化镁是离子化合物;氯化钙的化学式是CaCl2,其中Ca是活泼金属,Cl是活泼非金属,因此氯化钙是离子化合物;
氯化钾、氯化镁、氯化钙、硫酸锌、氢氧化钠是离子化合物吗?
硫酸锌的化学式是ZnSO4,其中Zn和SO42-之间是离子键,因此硫酸锌是离子化合物;氢氧化钠的化学式是NaOH,其中Na和OH-之间是离子键,因此氢氧化钠是离子化合物。
一般来说,化合物中只要含有离子键就是离子化合物
为方便起见,我们在元素符号周围用“·”或“×”表示原子的最外层电子(价电子)。这种式子叫做电子式。
你知道金属元素镁的电子式怎么书写吗?
你知道非金属元素硫的电子式怎么书写吗?
书写电子式的步骤①观察该元素的原子结构。即观察最外层有几个电子。②写出该元素的元素符号,在该元素符号周围用“×”或“·”标出相应的最外层电子个数。注:如果是金属元素,通常用“×”表示;如果是非金属元素,通常用“·”表示。
离子化合物的形成,可以用电子式表示,如氯化钠的形成过程可以表示为:
(1)原子、离子都要标出最外层电子,离子必须标明电荷(2)阴离子要用方括号括起来(3)相同的原子可以合并谢,相同的粒子要单个写(箭头左边相同的微粒可以合并,箭头右边相同的微粒不可以合并)(4)不能把“—>”写成“=”
你能用电子式写出离子化合物氯化镁的形成过程吗?
[ ] Mg [ ]
1、填写下列空格:带相反电荷的钠离子和氯离子,通过________结合在一起,从而形成与单质钠和氯气性质完全不同的氯化钠。人们把这种带相反电荷粒子之间的相互作用叫______。像氯化钠这样,由离子键构成的化合物叫做___________。
解析:带相反电荷的钠离子和氯离子,通过静电作用结合在一起,从而形成与单质钠和氯气性质完全不同的氯化钠。人们把这种带相反电荷粒子之间的相互作用叫离子键。像氯化钠这样,由离子键构成的化合物叫做离子化合物。
2、写出下列(非)金属元素的电子式:①S_______;②K_______;③H_______。
解析:首先思考元素的原子结构,例如“S”的最外层电子数为6,因此在“S”周围应该有6个电子,非金属元素的电子用“·”表示。所以“S”的电子式如上所示;“K”的最外层电子数为1,因此在“K”周围应该有1个电子,金属元素的电子用“×”表示。所以“K”的电子式如上所示; “H”的最外层电子数为1,因此在“H”周围应该有1个电子,非金属元素的电子用“·”表示。所以“H”的电子式如上所示。
3、写出下列物质的电子式:①KCl_________________;②MgCl2_________________;③NaCl_________________。
解析:钾失去1个电子形成钾离子,氯原子得到1个电子形成氯离子,其电子式如上所示;镁失去2个电子形成镁离子,氯原子得到1个电子形成氯离子,其电子式如上所示;钠失去2个电子形成钠离子,氯原子得到1个电子形成氯离子,其电子式如上所示。
4.下列物质属于离子化合物的是( )A.CO2 D.NaF
解析:选项A中,CO2分子只含有共价键,是共价化合物,故A错误;选项B中,H2SO4中只含有共价键,是共价化合物,故B错误;选项C中, SO2分子只含有共价键,是共价化合物,故C错误;选项D中, NaF分子只含有离子键,是离子化合物,故D正确。因此选D。
带相反电荷的钠离子和氯离子,通过静电作用结合在一起,从而形成与单质钠和氯气性质完全不同的氯化钠。人们把这种带相反电荷粒子之间的相互作用叫离子键。像氯化钠这样,由离子键构成的化合物叫做离子化合物。
用电子式表示离子化合物的形成过程注意事项
为什么2个氢原子结合成氢分子,2个氯原子结合成氯分子,而不是3个,4个呢?
原子个数: 1 1
为什么1个氢原子和1个氯原子结合成氯化氢分子,氯原子和氢原子的个数比是1:1,而不是以其他个数比相结合呢?
原子个数:1 1
氯分子是如何形成的呢?
氯原子的最外层有7个电子,要达到8电子稳定结构,都需要获得1个电子,所以氯原子之间难以发生电子的得失。如果2个氯原子各提供1个电子,形成共用电子对,2个氯原子就形成了8电子稳定结构:
像氯分子这样,原子间通过共用电子对形成的相互作用叫做共价键。不同种非金属元素化合时,它们的原子之间也能形成共价键。例如,HCl的形成过程可以用下式表示:
像HCl这样,以共用电子对形成分子的化合物叫做共价化合物。例如H2O、CO2等都是共价化合物。
分子具有一定的空间结构。如:CO2是直线形, H2O呈V形,CH4呈正四面体形等。 通过现代实验手段(如X射线衍射法等)可以测定某些分子的结构。
在H2、Cl2这样的单质分子中,由同种原子形成共价键,两个原子吸引电子的能力相同,共用电子对不偏向任何一个原子,成键的原子因此而不显电性,这样的共价键叫做非极性共价键,简称非极性键。
因为原子吸引电子的能力不同,共用电子对偏向吸引电子能力强的一方,所以吸引电子能力强的原子一方显负电性,吸引电子能力弱的原子一方显正电性。
在化合物分子中,不同种原子形成共价键时有什么特点呢?
例如,HCl分子中,Cl吸引电子的能力比H强,共用电子对偏向Cl一方,Cl一方相对显负电性,H一方则相对显正电性。
像HCl这样,共用电子对偏移的共价键叫做极性共价键,简称极性键。H2O、CO2中的共价键也是极性键。
共价键分为极性键和非极性键。
原子结合成分子时存在相互作用。这种作用存在于分子内相邻原子之间,也存在于非直接相邻的原子之间,而相邻原子之间的相互作用比较强烈。我们把这种相邻的原子之间强烈的相互作用叫做化学键。
化学键的形成与什么有关?
化学键的形成与原子结构有关,它主要通过原子的价电子间的转移或共用来实现。一般的化学物质主要由离子键或共价键结合而成。
H—H Cl—Cl H—Cl
化学反应是反应物中原子重新组合成产物分子的一种过程吗?
表面上看,化学反应是反应物中原子重新组合成产物分子的一种过程,其实,化学反应过程中,包含着反应物分子内化学键的断裂和产物分子中化学键的形成。其中包含两个步骤:①H2和Cl2中的化学键(旧化学键)断裂,生成H和Cl;②H和Cl结合成HCl,形成了H和Cl之间的化学键H—Cl(新化学键)。
研究证实,化学反应的过程,本质上就是旧化学键断裂和新化学键形成的过程。
分子内相邻的原子之间存在着化学键。分子间还存在一种把分子聚集在一起的作用力,即分子间作用力。荷兰物理学家范德华最早研究分子间作用力,所以最初也将分子间作用力称为范德华力。范德华力比化学键弱得多,对物质的熔点、沸点等有影响。
NH3、Cl2、CO2等气体在降低温度、增大压强时能凝结成液态或固态,就是由于存在范德华力。分子间形成的氢键也是一种分子间作用力,它比化学键弱,但比范德华力强。氢键会使物质的熔点和沸点升高,这是因为固体熔化或液体汽化时必须破坏分子间的氢键,消耗较多能量。
1、填空原子间通过共用电子对形成的相互作用叫做________。共用电子对不偏向任何一个原子,成键的原子因此而________,这样的共价键叫做非极性共价键,简称_________。共用电子对偏移的共价键叫做极性共价键,简称_________。
解析:原子间通过共用电子对形成的相互作用叫做共价键;共用电子对不偏向任何一个原子,成键的原子因此而不显电性,这样的共价键叫做非极性共价键,简称非极性键;共用电子对偏移的共价键叫做极性共价键,简称极性键。
2.写出下列物质的电子式:①Cl2_______________②H2O_______________③CH4_______________
解析:首先思考元素的原子结构,例如“Cl”的最外层电子数为7,因此在“Cl”周围应该有7个电子,非金属元素的电子用“·”表示。所以两个“Cl”结合成的“Cl2”的电子式如上所示;“H”的最外层电子数为1,“O”的最外层电子数为6,两个“H”都失掉一个电子,正好可以使“O”周围的电子数达到8个,金属元素的电子用“×”表示。所以“H2O”的电子式如上所示; “H”的最外层电子数为1, “C”的最外层电子数为4,四个“H”都失掉一个电子,正好可以使“C”周围的电子数达到8个。所以“CH4”的电子式如上所示。
3.下列变化过程中,共价键被破坏的是( )A.烧碱固体溶于水B.氯化氢气体溶于水C.CO2气体变成干冰D.碘溶于酒精
解析:选项A中,氢氧化钠是离子化合物,溶于水电离出阴阳离子,破坏的是离子键,故A错误;选项B中,氯化氢溶于水,电离出阴阳离子,破坏的是共价键,故B正确;选项C和D中,CO2气体变成干冰、碘溶于酒家中都是物理变化,破坏的是分子间作用力,故D错误。因此选B。
4.下列物质中,含有极性共价键的是 ( ) A.单质碘 B.氯化镁C.溴化钾D.水
解析:选项A中,非金属单质分子含有非极性共价键,A项错误;选项B中,氯化镁只含有离子键,B项错误;选项C中,溴化钾只含有离子键,C项错误;选项D中,水所含化学键为不同非金属原子之间形成的,为极性共价键,D项正确。因此选D。
像氯分子这样,原子间通过共用电子对形成的相互作用叫做共价键。不同种非金属元素化合时,它们的原子之间也能形成共价键。例如HCl。像HCl这样,以共用电子对形成分子的化合物叫做共价化合物。
像HCl这样,共用电子对偏移的共价键叫做极性共价键,简称极性键。在H2、Cl2这样的单质分子中,由同种原子形成共价键,两个原子吸引电子的能力相同,共用电子对不偏向任何一个原子,成键的原子因此而不显电性,这样的共价键叫做非极性共价键,简称非极性键。
分子具有一定的空间结构。如:CO2是直线形, H2O呈V形,CH4呈正四面体形等。通过现代实验手段(如X射线衍射法等)可以测定某些分子的结构。
化学反应的过程,本质上就是旧化学键断裂和新化学键形成的过程
高中化学人教版 (2019)必修 第一册第三节 化学键示范课ppt课件: 这是一份高中化学人教版 (2019)必修 第一册第三节 化学键示范课ppt课件,文件包含432共价键pptx、课件1431离子键pptx、导课视频化学键mp4等3份课件配套教学资源,其中PPT共60页, 欢迎下载使用。
高中化学人教版 (2019)必修 第一册第三节 化学键课堂教学课件ppt: 这是一份高中化学人教版 (2019)必修 第一册第三节 化学键课堂教学课件ppt,共23页。PPT课件主要包含了Na+,Cl-,失去1e-,得到1e-,NaCl,MgCl2,H2Ol,100℃,H2Og,2000℃等内容,欢迎下载使用。
高中化学人教版 (2019)必修 第一册第三节 化学键说课课件ppt: 这是一份高中化学人教版 (2019)必修 第一册第三节 化学键说课课件ppt,共18页。PPT课件主要包含了化学键,注意不包括分子,离子键,成键要素,阴阳离子,静电作用,②明显带离子的物质,2二个“不一定”,1三个“一定”,离子化合物等内容,欢迎下载使用。













