




高中化学人教版 (新课标)必修1第二节 富集在海水中的元素--氯授课ppt课件
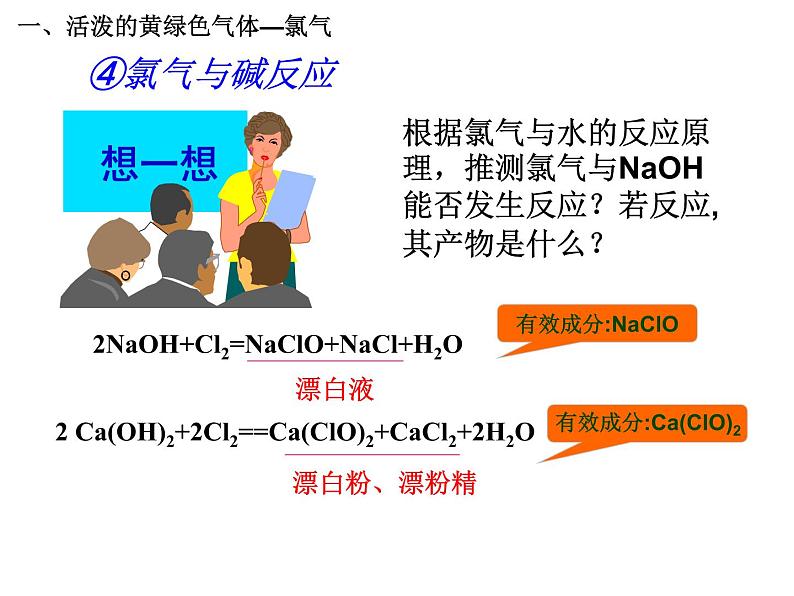
展开根据氯气与水的反应原理,推测氯气与NaOH能否发生反应?若反应,其产物是什么?
2NaOH+Cl2=NaClO+NaCl+H2O
2 Ca(OH)2+2Cl2==Ca(ClO)2+CaCl2+2H2O
有效成分:Ca(ClO)2
一、活泼的黄绿色气体—氯气
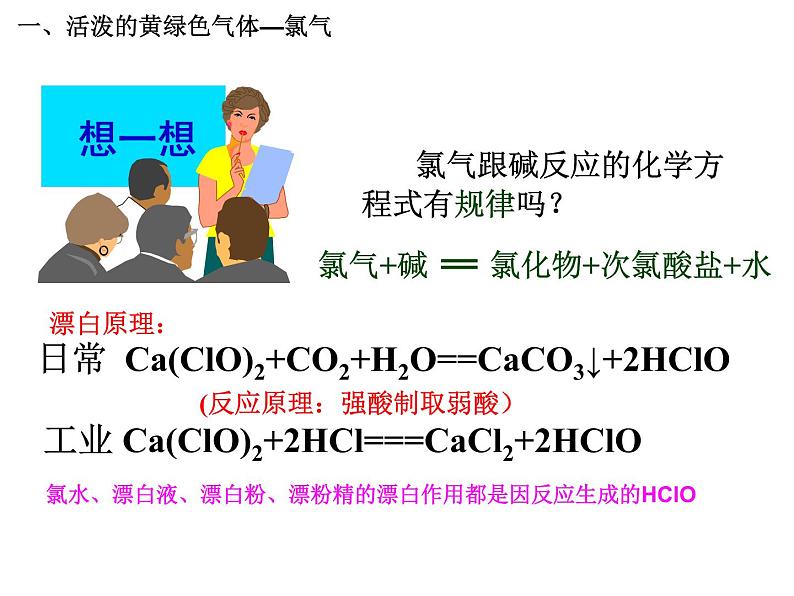
氯气跟碱反应的化学方程式有规律吗?
日常 Ca(ClO)2+CO2+H2O==CaCO3↓+2HClO
工业 Ca(ClO)2+2HCl===CaCl2+2HClO
(反应原理:强酸制取弱酸)
氯水、漂白液、漂白粉、漂粉精的漂白作用都是因反应生成的HClO
漂白液和漂白粉的漂白原理A.NaClO+HCl=NaCl+HClO 2NaClO+CO2+H2O=Na2CO3 + 2HClOB.Ca(ClO)2+2HCl=CaCl2+2HClO Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO(漂白粉在潮湿的空气中容易失效)
注:此处为“强酸制弱酸,弱酸可以制更弱的酸”。
与FeCl2 、NaBr、KI等盐溶液反应(表现氯气的强氧化性)
2Fe2+ + Cl2 = 2Fe3+ + 2Cl-Cl2 + 2Br- = 2Cl- + Br2Cl2 + 2 I- = 2Cl- + I2
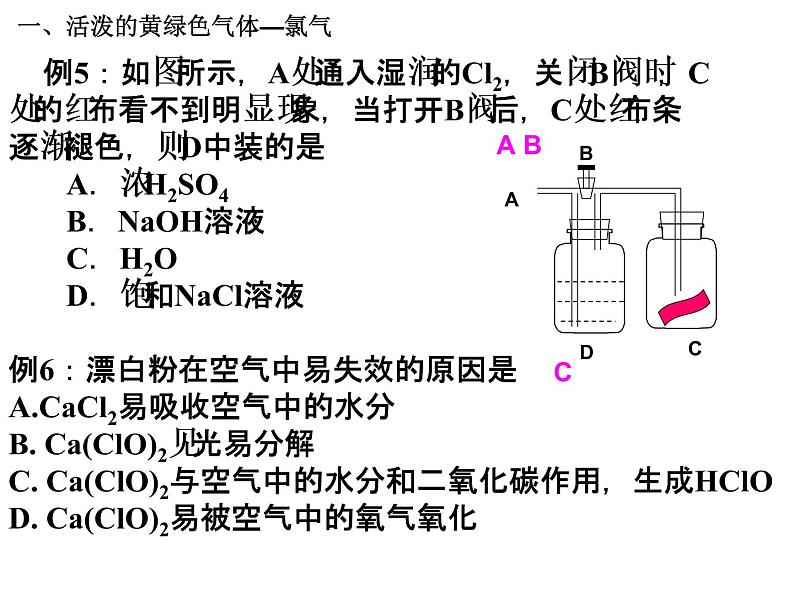
例6:漂白粉在空气中易失效的原因是CaCl2易吸收空气中的水分 B. Ca(ClO)2见光易分解C. Ca(ClO)2与空气中的水分和二氧化碳作用,生成HClO D. Ca(ClO)2易被空气中的氧气氧化
例5:如图所示,A处通入湿润的Cl2,关闭B阀时,C处的红布看不到明显现象,当打开B阀后,C处红布条逐渐褪色,则D中装的是 A.浓H2SO4 B.NaOH溶液 C.H2O D.饱和NaCl溶液
[思考与交流]氯水如何保存?为什么?久置氯水和新制氯水有何区别?
答:棕色玻璃瓶密封避光保存新制氯水:H+ 、 Cl- 、 ClO- 、 HClO、Cl2 、 H2O,有强氧化性。久置氯水:盐酸溶液,无强氧化性。
杀菌消毒制漂白粉(液)作制高纯硅、锗和钛的中间物质合成塑料、橡胶、农药、药品等
有关反应的离子方程式是:Ag+ + Cl– == AgCl 2Ag+ + CO32- == Ag2CO3 Ag2CO3 + 2H+ == 2Ag+ + CO2 + H2O
某溶液中加入AgNO3溶液产生白色沉淀,则可确定该溶液中一定有氯离子,这种说法对不对?
在被检验的溶液中加入稀硝酸酸化,再滴入AgNO3溶液,若产生白色沉淀,则被检液中含有Cl-。
(1)试剂:AgNO3溶液、稀硝酸
或 在被检验的溶液中滴入AgNO3溶液,若产生白色沉淀,再加入稀硝酸,沉淀不溶,则被检液中含有Cl-。
二、氯离子(Cl-)的检验
氟 F 9
氯 Cl 17
溴 Br 35
碘 I 53
砹 At 85
卤素原子结构有何相似点和不同点?由此推测它们化学性质有何相似性和递变性?
①对比Cl2,写出Br2与 Na 、Fe 反应的化学方程式。
1.与金属反应:F2 Cl2 Br2 的氧化性强,能把可变化合价 的金属氧化成高价的金属卤化物,I2 的氧化能力最弱, 跟铁反应只夺取铁的2个电子,生成FeI2。
②对比Cl2,写出F2 、Br2、I2与 H2 反应的化学方程式。 它们发生反应的条件相同吗?
③对比Cl2,写出Br2与 H2O 反应的化学方程式。
I2 +Fe=FeI2
Br2+2Na=2NaBr3Br2+2Fe=2FeBr3
F2 冷暗处爆炸 H2+F2=2HF HF很稳定
Cl2 光照或点燃 H2+Cl2=2HCl HCl稳定
Br2 高温 H2+Br2=2HBr HBr较不稳定
I2 高温、持续加热 H2+I2=2HI HI很不稳定 缓慢进行
2. 卤素与氢气的反应
结论: F Cl Br I 随着核电荷数的增多,原子半径的增大,(1)卤素单质与H2化合的难易关系:F2 >Cl2> Br2> I2
(2)卤化氢的稳定性关系:HF > HCl > HBr > HI
Br2+ H2O=HBr+HBrO
2F2+2H2O=4HF+O2 (特例)
Cl2 +H2O=HCl+HClO
通式:X2 + H2O=HX+HXO(X:Cl、Br、I)
I2 +H2O=HI+HIO
1. Cl2+ 2Br- =2Cl-+Br2 2. Cl2+ 2I- = 2Cl-+I2 3. Br2+ 2I- = 2Br-+I2
思考:根据上述实验,排出Cl2、Br2、I2的氧化性强弱顺序及Cl-、Br-、I-的还原性强弱顺序
结论: 氧化性:Cl2>Br2>I2 还原性:I->Br->Cl-
卤素原子结构的相似性,决定了单质化学性质的相似性:
与金属反应,生成卤化物。
与氢气反应,生成卤化氢。
与水反应,生成卤化氢和次卤酸。
卤素原子结构的差异性,决定了单质化学性质的差异性和递变性:
氟气和水的反应: 2F2 +2H2O=4HF+ O2
1.下列气体中,既有颜色又有毒性的是( ) A.N2 B.CO C.Cl2 D.CO2
2.下列叙述中能证明次氯酸是一种弱酸的是( )A.次氯酸不稳定,易分解B.次氯酸是一种强氧化剂C.次氯酸钙能与碳酸作用生成碳酸钙和次氯酸D.次氯酸能使染料和有机色质褪色
3.下列说法中正确的是( )A.用鼻子对着盛有氯气的瓶口,就可以嗅到氯气的气味B.用排水集气法便可以收集到纯净的氯气C.氯气有漂白性D.自来水常用氯气来杀菌、消毒
4.下列物质中,既含有氯分子,又含有氯离子的是( )A.氯化钠溶液 B.新制氯水C.漂白粉 D.液氯
5.下列物质中能使干燥的有色布条褪色的是( )A.氯水 B.液氯 C.氯气 D.次氯酸6. Cl2可用来消灭田鼠,使用时可将Cl2通过管子灌入洞中,这是利用Cl2下列性质中的( )A.黄绿色 B.密度比空气大C.有毒 D.较易液化
7.在未知液中加入AgNO3溶液有白色沉淀生成,加入稀硝酸后,沉淀部分溶解,有无色无味的气体生成,将气体通人澄清石灰水,石灰水变浑浊,由此判断水溶液中含有( ) A.Cl-,SO42- B.Cl-,NO3- C.Cl-,CO32- D.Cl-,OH-
8.浓盐酸和Ca(ClO)2能发生如下反应:Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑十2H2O用贮存很久的漂白粉与浓盐酸反应制得的氯气中,可能含有的杂质气体是( )①CO2 ②HCl ③H2O ④O2A.①②③ B.②③④ C.②③ D.①④
人教版 (新课标)必修1第二节 富集在海水中的元素--氯课文内容ppt课件: 这是一份人教版 (新课标)必修1第二节 富集在海水中的元素--氯课文内容ppt课件,共52页。PPT课件主要包含了制氯气的反应装置,改写成离子方程式,有效成分,NaClO,防毒的方法与途径等内容,欢迎下载使用。
高中化学人教版 (新课标)必修1第四章 非金属及其化合物第二节 富集在海水中的元素--氯课前预习课件ppt: 这是一份高中化学人教版 (新课标)必修1第四章 非金属及其化合物第二节 富集在海水中的元素--氯课前预习课件ppt,共33页。PPT课件主要包含了Cl-,原子结构,想一想,氯气的物理性质,1氯气与金属反应,2氯气与氢气反应,3氯气与水反应,4氯气与碱反应,氯气与铜反应,请看实验等内容,欢迎下载使用。
高中化学第二节 富集在海水中的元素--氯教学演示ppt课件: 这是一份高中化学第二节 富集在海水中的元素--氯教学演示ppt课件,共34页。PPT课件主要包含了一氯气的物理性质,二化学性质,②与铁反应,③与铜反应,与非金属反应,思考烟和雾的区别,思考与交流,实验探究,Cl2+H2O,氯气与水的反应等内容,欢迎下载使用。













