



高中化学人教版 (新课标)必修1第二章 化学物质及其变化第二节 离子反应教课内容ppt课件
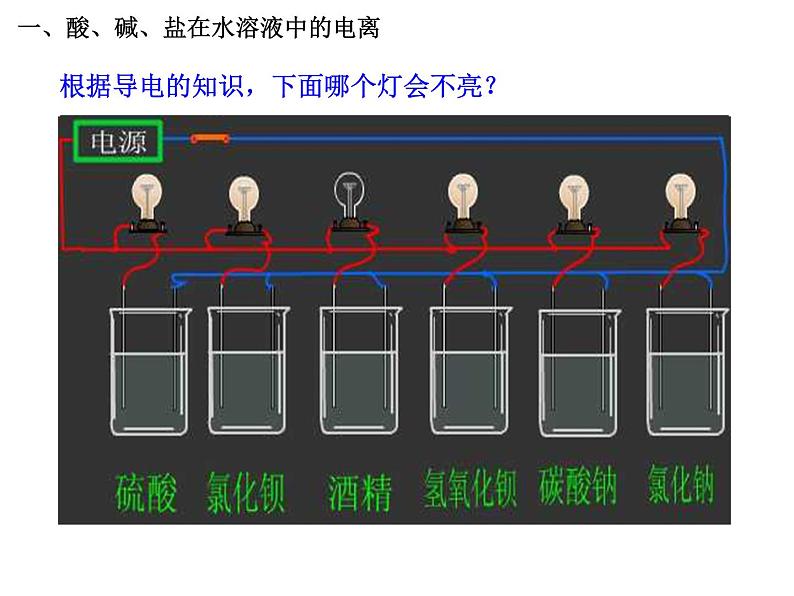
展开根据导电的知识,下面哪个灯会不亮?
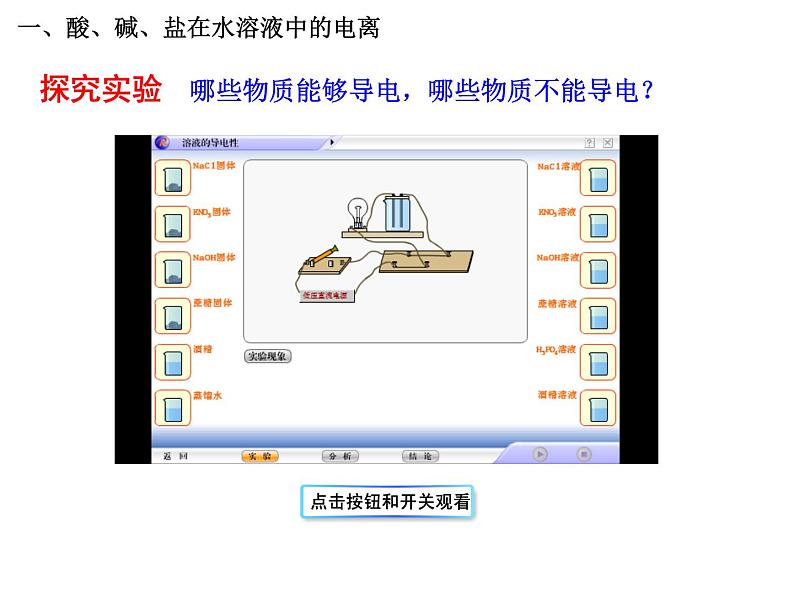
一、酸、碱、盐在水溶液中的电离
哪些物质能够导电,哪些物质不能导电?
我们知道像硝酸钾固体、氯化钠固体这样的盐不能导电,那么它们在熔融状态下可以导电吗?
熔融状态的硝酸钾的导电性实验
结论:熔融状态下的硝酸钾能导电
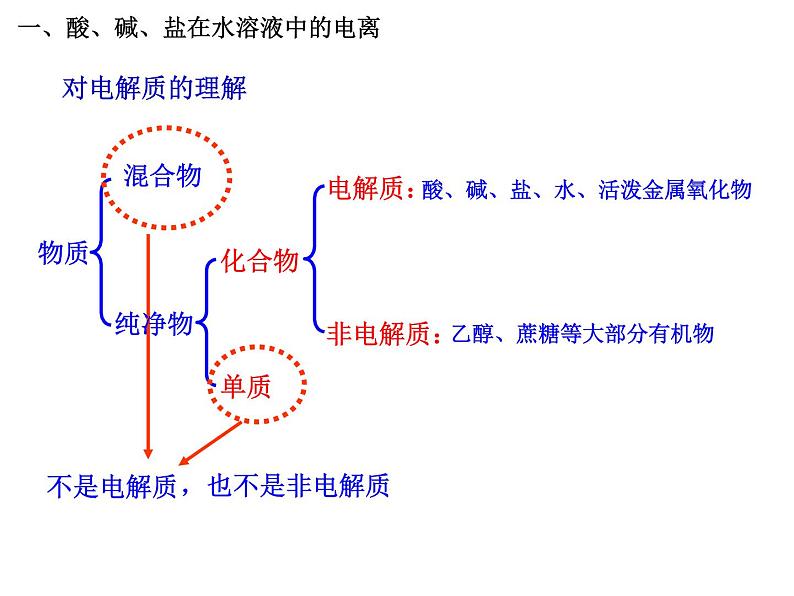
概念:在水溶液中或熔融状态下能够导电的化合物 例如:KNO3、NaOH、H3PO4等,都是电解质。酸、碱、盐、部分金属氧化物和水是电解质利用树状分类法分析
非电解质:在水溶液中和熔融状态下不能够导电
电解质:在水溶液中或熔融状态下能够导电
非金属氧化物、大部分有机物是非电解质
乙醇、蔗糖等大部分有机物
酸、碱、盐、水、活泼金属氧化物
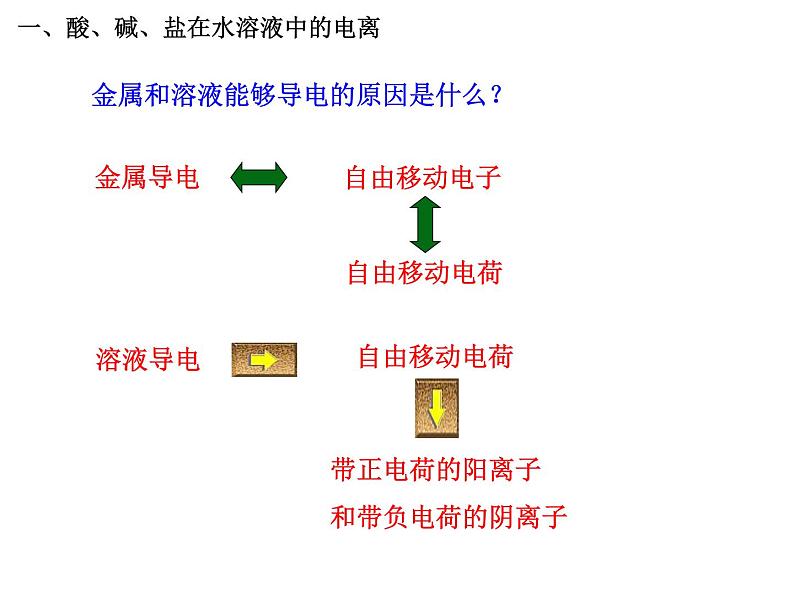
带正电荷的阳离子和带负电荷的阴离子
金属和溶液能够导电的原因是什么?
酸、碱、盐溶液导电是它们在溶液中发生了电离氯化钠在水中电离
NaCl 在水中的溶解和电离的示意图
2、电离(1)定义:电解质在水溶液中或熔融状态下产生能够自由移动的离子的过程(2)电离的表示——电离方程式用化学符号表示电解质电离成自由移动离子的过程。如:NaCl = Na++Cl- 现在你明白电解质溶液能导电和非电解质不能导电的原因了吗?
电解质和非电解质在水中电离的比较
问题探究 1SO2属于化合物,溶于水也导电,SO2属于电解质吗?电解质是指在水溶液里或熔融状态下能自身电离而导电的化合物。SO2溶于水导电是因为生成H2SO3,电离产生自由移动的离子而导电,应该理解为H2SO3是电解质,SO2属于非电解质。
1. 分析电离方程式
NaCl ==== Na+ + Cl-
离子符号(代表水合离子)
问题探究 2如何正确的书写电离方程式?
Al2 (SO4)3=2Al3+ +3SO42-
2.书写步骤: (1)阴阳离子部分拆开写,但原子团不能拆,例如NO3-、SO42-、OH-、NH4+、CO32-等不能拆。 (2)构成物质的原子或原子团的个数在书写成离子时为系数。
(1)式子左边书写化学式,表示电解质还未电离时的状态;右边书写离子符号,表示电解质电离产生的离子。
(2)离子所带的电荷数应等于元素或原子团的化合价数。
(3)电离方程式左右两边正负电荷之和相等.
练习1 写出下列酸的电离方程式: HCl 、HNO3、H2SO4
H2SO4 ==== 2 H+ + SO42-
HCl ==== H+ + Cl-
HNO3 ==== H+ + NO3-
▲酸:电离时生成的阳离子全部是H+的化合物。
练习2 写出下列碱的电离方程式: NaOH , KOH , Ba(OH)2
NaOH ==== Na+ + OH-
▲碱:电离时生成的阴离子全部是OH-的化合物。
Ba(OH)2 ==== Ba2+ + 2 OH-
KOH ==== K+ + OH-
练习3 写出下列盐的电离方程式: NaCl , KNO3 , Fe2(SO4)3 , NaHSO4
NaCl ==== Na+ + Cl-
▲盐:电离时能生成金属离子和酸根离子的化合物。
KNO3 ==== K+ + NO3-
Fe2(SO4)3==== 2Fe3+ +3SO42-
NaHSO4==== Na+ + H+ + SO42-
1.下列物质中,能导电的是___________。①盐酸 ②干冰 ③石墨 ④熔融KCl ⑤ Cu⑥Na2CO3粉末 ⑦蔗糖 ⑧ CuSO4·5H2O
导电性关键看有无自由移动的离子或自由电子
小试牛刀,先做几个试试吧。
2.下列物质中,属于电解质的是_____________。①盐酸 ② O2 ③Na2CO3 ④蔗糖⑤ AgCl ⑥Ca(OH)2 ⑦HNO3
电解质:首先是化合物,再考虑在溶液和熔融状态下能否有自由移动的离子
3.下列电离方程式书写完全正确的是 ( )A.H2SO4===H++SO42-B.Ca(OH)2===Ca2++(OH)22-C.NaCl===Na++Cl-D.Al2(SO4)3===Al23++3SO42-
4.下列说法中,正确的是 ( )A.液态HCl、固态NaCl均不导电,所以HCl、NaCl均是非电解质B.NH3、CO2的水溶液均能导电,所以NH3、CO2均是电解质C.蔗糖、酒精在水溶液里或熔融状态时均不导电,所以它们是非电解质D.铜、石墨均导电,所以它们是电解质
5. (1)判断下列物质在相应条件下能否电离,并说明理由。①液态HCl:______,____________________________________________。②熔融的NaCl:_____,___________________。③熔融的单质铁________,____________。④固体KOH:____________,_____________________。
HCl是酸,液态时不电离,只在水溶液中电离
能电离出Na+和Cl-
(2)写出下列物质在水溶液中的电离方程式:H2SO4:_______________________Ca(OH)2:_____________________KAl(SO4)2:______________________________
H2SO4===2H++SO42-
Ca(OH)2===Ca2++2OH-
KAl(SO4)2===K++Al3++2SO42-
高中化学人教版 (2019)必修 第一册第二节 离子反应课文ppt课件: 这是一份高中化学人教版 (2019)必修 第一册第二节 离子反应课文ppt课件,共51页。
人教版 (新课标)必修1第四节 氨 硝酸 硫酸图文ppt课件: 这是一份人教版 (新课标)必修1第四节 氨 硝酸 硫酸图文ppt课件,共47页。PPT课件主要包含了氨的化学性质,2氨与酸的反应,现象产生大量白烟,思考与交流,氨的用途,制铵盐,制硝酸,制尿素,制冷剂,试剂及操作等内容,欢迎下载使用。
化学人教版 (新课标)第一节 物质的分类图文课件ppt: 这是一份化学人教版 (新课标)第一节 物质的分类图文课件ppt,共21页。PPT课件主要包含了金属单质,非金属单质,化合物,稀有气体,思考与交流1,氧化物,按是否含氧,按提供氢离子数目,按挥发性,按是否可溶于水等内容,欢迎下载使用。













