





化学人教版 (新课标)第二章 化学物质及其变化第二节 离子反应评课课件ppt
展开《三国演义》中有这样一个故事:诸葛亮第四次释放孟获后,孟获逃至秃龙洞,秃龙洞的毒泉中有一个“哑泉”,“人若饮之,则不能言,不过旬日必死”。不久,蜀军先锋王平率数百军士前来探路,由于天气炎热,人马均争先恐后误喝了哑泉水。军士们个个说不出话来,生命危在旦夕,诸葛亮也毫无办法。原因是什么呢?原因是士兵喝的水中含有 CuSO4 ,造成了重金属中毒。
二、离子反应及其发生的条件
后经一老叟指点,喝了万安溪安乐泉水后转危为安。原来该泉水中含有较多的碱(一般味苦),在人体误食CuSO4后又大量饮此泉水,其中碱先中和了胃酸,然后多余的碱又会在胃肠中与CuSO4发生离子反应Cu2++2OH-====Cu(OH)2↓。致使原来会使人体吸收的可溶性铜盐变成不溶性的Cu(OH)2沉淀而不再会被吸收,因此,具有解毒作用。
1、离子反应定义:有离子参加或生成的反应叫离子反应。实际上离子反应有很多,例如BaCl 2与Na 2SO4 也发生类似的离子反应。
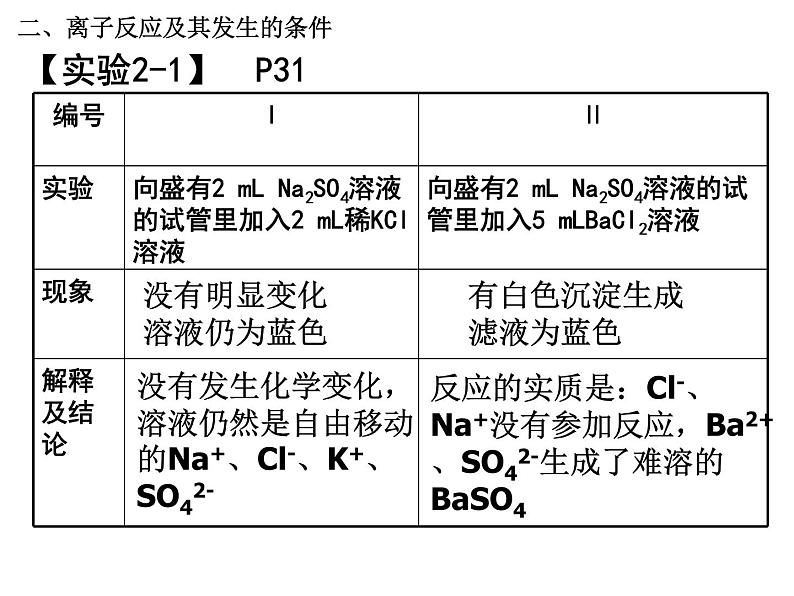
没有明显变化溶液仍为蓝色
有白色沉淀生成滤液为蓝色
没有发生化学变化,溶液仍然是自由移动的Na+、Cl-、K+、SO42-
反应的实质是:Cl-、Na+没有参加反应,Ba2+、SO42-生成了难溶的BaSO4
【实验2-1】 P31
为什么有些溶液就不能发生离子反应呢?看下面的Flash。
混合前,溶液中各存在哪些离子?请写出电离方程式
混合后,宏观上看到什么现象?
Na2SO4==== 2Na ++SO42-
BaCl2====Ba2++2Cl-
反应的实质是Ba2++ SO42-====BaSO4 ↓
定义:用实际参加反应的离子的符号来表示离子反应的式子叫做离子方程式
怎样书写一个离子反应的离子方程式呢?
3、离子方程式的书写步骤
写:写出正确的化学方程式(基础)
拆:把易溶于水、易电离的物质拆写成离子形式,难溶于水、难电离的物质(如水)以及气体、单质、氧化物等用化学式表示(关键)
删:删去方程式两边不参加反应的离子
查:①是否符合客观规律 ②原子个数是否守恒 ③电荷是否守恒 ④离子的改写是否正确
一写、二拆、三删、四查
书写离子方程式应注意的问题
(1)凡不是在溶液中进行的反应一般不能写离子方程式。
如:NH4Cl固体与Ca(OH)2固体混合加热,只能写化学方程式。2NH4Cl(固)+Ca(OH)2(固)=CaCl2+2NH3↑+2H2O
(2)离子方程式注意两易、两等、两查
两易:即易溶易电离的物质(包括强酸、强碱、大多数可溶性盐)以实际参加反应的离子符号表示。
两等:离子方程式两边的原子个数和电荷总数均对应相等
两查:检查各项是否都有公约数,是否漏写必要的反应条件。
A 单质、气体、氧化物、水B 弱酸(HF、H2S、HClO、H2SO3等)C 弱碱(NH3·H2O)等难电离物质D 难溶物(如CaCO3、FeS、BaSO4、Fe(OH)3等)
在离子方程式中写成化学式 有如下几种情况:
(1)钾钠铵盐、硝酸盐皆可溶;(2)氯盐不溶银、亚汞(AgCl、Hg2Cl2);(3)硫酸盐不溶钡和铅(BaSO4、PbSO4);(4)碳酸盐、磷酸盐只溶钾钠铵;(5)碱类可溶钾钠铵钡。
⑶多元弱酸的酸式盐的酸根离子在离子方程式中不能拆开写,而强酸的酸根离子在离子方程式中要拆开写。
例:1、NaHCO3与盐酸反应:
HCO3-+H+ H2O+CO2↑
2、KHSO4与BaCl2反应:
SO42-+Ba2+ BaSO4↓
C、当反应物里有微溶物处于悬浊液或固态时,应写成化学式。 例:在石灰乳中加入Na2CO3溶液: Ca(OH)2 + CO32- = CaCO3↓+ 2OH-
B、当反应物里有微溶物处于溶液状态(稀溶液),写成离子符号。 例:CO2气体通入澄清石灰水中: CO2 + Ca2+ + 2OH- =CaCO3 ↓+H2O
(Ag2S04、MgCO3、Ca(OH)2、CaSO4)
Ca(OH)2(反应物)
①澄清石灰水:拆为“_______”
②石灰乳或石灰浆:仍用“_______”
氢氧化钙为生成物时,仍用“_______”。
1.请写出Ca(OH)2和HCl、KOH和HCl反应的化学方程式和离子方程式。
2.请写出①硫酸和氢氧化钠 ②硝酸和氢氧化钾反应的化学方程式和离子方程式。
Ca(OH)2 + 2HCl ====CaCl2+2H2O
OH-+ H+ ====H2O
KOH+HCl ====KCl+H2O
(1)以客观事实为依据
如:铁与稀盐酸反应 2Fe+6H+ ====2Fe3++3H2↑
(2)以质量守恒为依据
如:铝与稀盐酸反应 Al+3H+ ==== Al3++H2↑
(3)以电荷守恒为依据
如:2FeCl3+Fe ==== 3FeCl2 (正确)
Fe3++Fe ====2Fe2+
(4)以物质的实际状态为依据
如:碳酸钡和稀硝酸反应
CO32-+2H+ ==== H2O+CO2↑
BaCO3+2H+ ==== Ba2++H2O+CO2↑
(5)以物质的组成为依据
Ba2++SO42-====BaSO4↓
Ba2++OH-+H++SO42-====BaSO4↓+H2O
Ba2++2OH-+2H++SO42-====BaSO4↓+2H2O
由以上的题目,你得出什么结论?
异同:化学方程式不同,但离子方程式可以相同。
2.离子方程式不仅可以表示某一个具体的化学反应,而且还可以表示同一类型的离子反应。
1.中和反应的本质是:H++OH-====H2O
H2SO4 + 2NaOH ====Na2SO4+2H2O
KOH+HNO3====KNO3+H2O
【实验2-2】 P32
酸碱反应的实质:由酸电离出来的H+与由碱电离出来 的OH- 结合生成了H2O
是否所有的酸碱中和反应都可以写成H++OH-=H2O
结论:H++OH-=H2O这一离子方程式只能表示强酸和强碱生成可溶性盐和水这一类型的中和反应。
电解质溶于水或熔融时电离成为离子,所以电解质在水溶液中发生的反应都是离子反应。
是不是所有的电解质溶液混合都会发生离子反应呢?
【实验2-3】 P33
看Flash,你能总结一下离子能够发生的条件吗?
复分解型离子反应发生的条件
(1)生成沉淀: Ag++Cl-====AgCl↓
(2)生成气体: 2H+ + CO32- ==== H2O+CO2↑
(3)生成水: H++OH-====H2O
观看flash,进一步理解离子反应的条件
1. 发生复分解反应的离子不能大量共存⑴生成沉淀:例如Ag+与Cl-,Ba2+和SO42-不能共存;⑵生成气体:例如CO32-、HCO3-、SO32-、HSO3-等易挥发的弱酸的酸根不能跟H+大量共存⑶生成难电离物质:如H+和OH-生成H2O,CH3COO-和H+生成CH3COOH,NH4+和OH-生成NH3·H2O
2.审题时应注意题中给出的附加条件 ⑴无色溶液不存在有色离子:如Cu2+、Fe3+、Fe2+、MnO4-等都有一定颜色 ⑵注意挖掘某些隐含离子:酸性溶液(或pH﹤7)中隐含有H+,碱性溶液(或pH﹥7)中隐含有OH-
1、判断下列物质之间能否进行离子反应KNO3 + NaClNa2CO3 + H2SO4 MgO + HCl BaCl2 + H2SO4
2.下列反应属于离子反应的是 ( ) A.H2和O2反应生成水B.锌片投入稀硫酸中C.KClO3加热分解制取O2D.H2还原 CuO
想一想,什么样的反应才是离子反应呢?
下列各组中的离子,能在溶液中大量共存的是( ) A. K+ H+ SO42- OH- B. Na+ Ca2+ CO32- NO3- C. Na+ H+ Cl- CO32- D. Na+ Cu2+ Cl- SO42-
做一个离子共存的练习吧。
4、下列离子方程式正确的是( )A.Cu(OH)2与稀HNO3混合 OH- + H+ ==== H2OB.CaCl2与Na2CO3反应 Ca2+ + CO32- ==== CaCO3 ↓C. MgO与 HCl反应 O2- + H+ ==== H2OD. Ba(OH)2与稀H2SO4反应 Ba2+ + SO42-==== BaSO4 ↓
高中鲁科版 (2019)第2节 电解质的电离 离子反应课堂教学课件ppt: 这是一份高中鲁科版 (2019)第2节 电解质的电离 离子反应课堂教学课件ppt,共60页。PPT课件主要包含了由红色变浅至无色,白色沉淀,不溶解,离子共存与离子检验,点击右图进入等内容,欢迎下载使用。
高中化学人教版 (2019)必修 第一册第二节 离子反应课文ppt课件: 这是一份高中化学人教版 (2019)必修 第一册第二节 离子反应课文ppt课件,共51页。
高中人教版 (2019)第二节 离子反应课文配套课件ppt: 这是一份高中人教版 (2019)第二节 离子反应课文配套课件ppt,













