




化学必修2第三节 化学反应的速率和限度示范课ppt课件
展开【考纲要求】1.了解化学反应的可逆性及化学平衡的建立。2.掌握化学平衡的特征及判断。
C+O2==CO2 C+CO2==2CO Fe2O3+3CO==2Fe+3CO2
教材:炼制1t生铁所需要的焦炭的实际用量,远高于按照化学方程式计算所需用量,且从高炉炉顶出来的气体中含有没有利用的CO气体。
启示:化学反应是有限度的,有些能进行地较彻底,有些反应是不彻底的,甚至是可逆的。
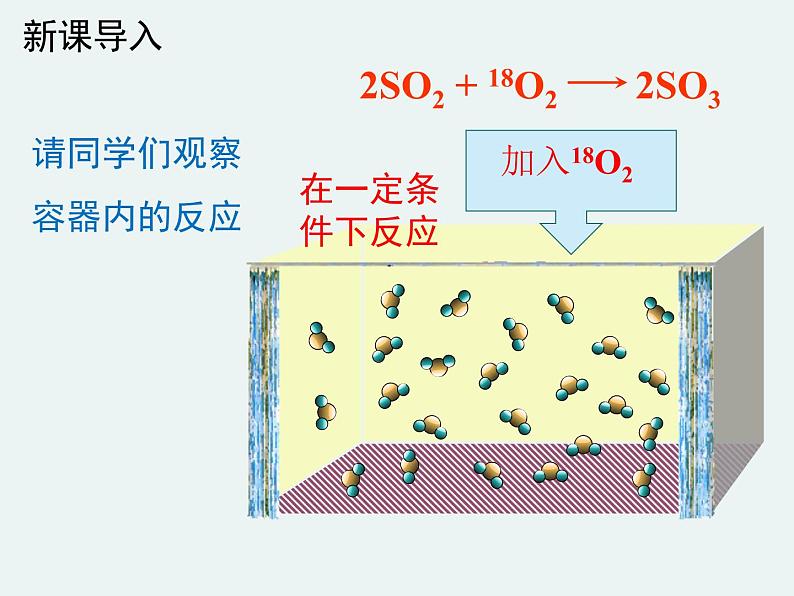
2SO2 + 18O2
请同学们观察容器内的反应
2SO2 + 18O2
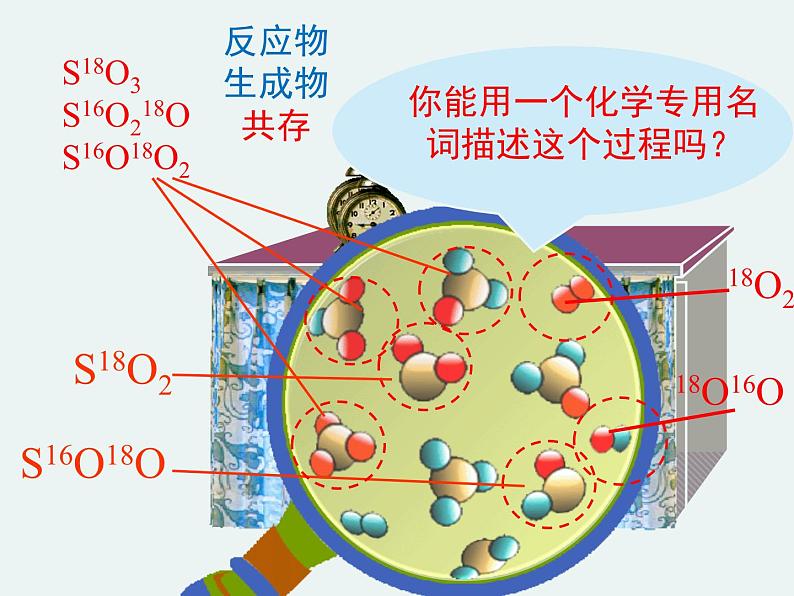
S18O3S16O218OS16O18O2
1.概念:在相同条件下,既能向 ,同时又能向 的反应。2.特征:三同: , , ; 反应不能进行完全, 即任一反应物的转化率均 100%。3.表示:化学方程式中用 表示。
反应物、生成物同时存在
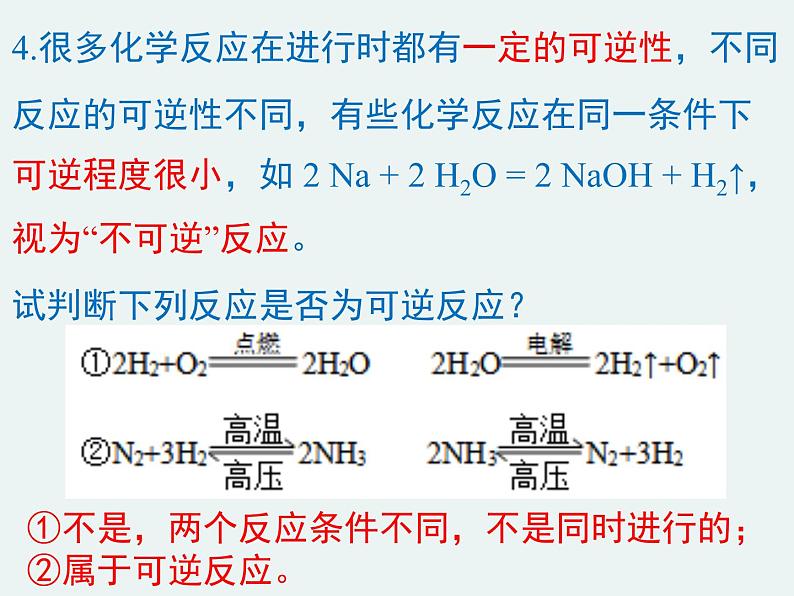
4.很多化学反应在进行时都有一定的可逆性,不同反应的可逆性不同,有些化学反应在同一条件下可逆程度很小,如 2 Na + 2 H2O = 2 NaOH + H2↑,视为“不可逆”反应。试判断下列反应是否为可逆反应?
①不是,两个反应条件不同,不是同时进行的;②属于可逆反应。
典型的可逆反应有: H2+I2⇌2HI , 2SO2+O2⇌2SO3 , SO2+H2O⇌H2SO3 ,NH3+H2O⇌NH3﹒H2O 等。
例题1.在密闭容器中进行反应X+2Y⇌2Z,已知反应中起始浓度分别为X、Y、Z,在一定条件下,当反应达到化学平衡时,各物质的浓度可能是( ) A.X为0.20ml/L B.Y为0.50ml/L C.Z为0.35ml/L D.Y为0.10ml/L【答案】C
1.化学平衡状态的建立过程
如在可逆反应2SO2+O2⇌2SO3中,反应进行之初SO2和O2的起始浓度分别为2ml·L-1、1ml·L-1
反应刚开始时,正反应速率v正最大,逆反应速率v逆为零。反应过程中,反应物浓度逐渐减小,正反应速率逐渐减小;生成物浓度逐渐增大,逆反应速率逐渐增大。最终在时刻t时,反应物浓度不再改变,生成物浓度不再改变。正反应速率和逆反应速率相等。反应是否停止?反应并没有停止,动态平衡。
2.化学平衡状态的含义
可逆反应在一定条件下进行到一定程度时,正反应速率与逆反应速率相等,反应物和生产物的浓度不在改变,此反应达到一种表面静止状态,我们称为化学平衡状态。化学平衡状态是可逆反应的一种特殊状态,是反应在一定条件下所能达到或完成的最大程度,即该反应的限度。化学反应的限度决定了反应在该条件下的最大转化率。
3.化学平衡状态的特征
4.化学平衡状态的判断方法—“两看”“两标志”
例题2.(2020·广东华南师大附中高三专题练习)可逆反应达化学平衡时,下列说法不正确的是( )A.正反应速率等于逆反应速率B.不再继续反应C.混合物的各成分的百分含量不变D.同时存在反应物和生成物【答案】B
例题3.(2020·山东高二期末)一定条件下,a L密闭容器中放入1mlN2和3mlH2发生N2+3H2⇌2NH3的反应,下列选项中能说明反应已达到平衡状态的是( )A.c(N2)∶c(H2)∶c(NH3)=1∶3∶2B.2v(H2)=3v(NH3)C.单位时间内1个N≡N键断裂同时,有6个N-H键断裂D.单位时间消耗0.1mlN2的同时,生成0.2mlNH3【答案】C
三.化学反应条件的控制
(一) 在生产和生活中,人们希望促进有利的化学反应(提高反应物的转化率即原料的利用率,加快反应速率等),抑制有害的化学反应(减缓反应速率,减少甚至消除有害物质的产生,控制副反应的发生等),即通过控制化学反应的条件,使反应向着我们有利的方向进行。
案例分析:如何提高煤的燃烧效率?1.煤的状态与煤燃烧的速率有何关系?与煤的充分燃烧有何关系?固体表面积增大,反应速率加快,能使煤燃烧更充分。2.空气用量对煤的充分燃烧及热能利用有什么影响?原因是什么?空气过少,煤不能充分燃烧;空气过多,会带走热量,热量散失增多。3.应选择什么样的炉(灶)膛材料?理由是什么?选择隔热保温耐热效果好的,减少热量散失。4.如何充分利用煤燃烧后烟道废气中的热量?回收热量,产生蒸汽,转化为动能;循环冷却水,居民供暖。
(二)基本措施①改变化学反应速率:改变反应体系的温度、物质的浓度、气体的压强、固体的表面积以及催化剂的合理使用等。②改变可逆反应进行的限度:改变可逆反应体系的温度、物质的浓度、气体的压强等。
四、有关化学平衡的简单计算
规律总结:解答有关化学反应速率和化学平衡的计算题时,一般需要写出化学方程式,列出起始量、变化量及平衡量,再根据题设其他条件和定律列方程求解。如: m A(g)+n B(g) p C(g)+q D(g) 起始/ml a b 0 0 转化/ml mx nx px qx 平衡/ml a-mx b-nx px qx
(1)关于反应物转化率的计算 A的转化率= ×100%(2)关于某组分平衡时的体积分数的计算 A的体积分数= ×100%
例题4.(2019·四川三台中学实验学校高二开学考试)在一定温度时,将1mlA和2mlB放入容积为5L的某密闭容器中发生如下反应:A(s)+2B(g)⇌C(g)+2D(g),经5min后达到平衡,测得容器内B物质的浓度减少了0.2ml·L-1。下列叙述不正确的是( )A.在5min内该反应用C的浓度变化表示的反应速率 0.02ml·L-1·min-1B.平衡时B的体积分数为33.3%C.初始压强和平衡时压强比为4:5D.平衡时B的转化率为50%
1.(2019·武汉质检)对于可逆反应2SO2+O2⇌2SO3 ΔH<0,在混合气体中充入一定量的 18O2,经足够长的时间后,下列有关说法中正确的是( )A.18O只存在于O2中B.18O只存在于O2和SO3中C.某个二氧化硫分子的相对分子质量可能为66D.三氧化硫的相对分子质量均为82【答案】C
2.下列说法中不正确的是( )A.当一个可逆反应达到平衡状态时,就是这个反应在该条件下所能达到的限度B.当一个可逆反应达到平衡状态时,这个反应的正反应速率和逆反应速率相等C.可以通过控制反应条件,使2 ml SO2与1 ml O2反应生成2 ml SO3D.化学反应的限度可以通过改变条件来改变【答案】C
3.对于可逆反应M + 3N⇌2Q达到平衡时,下列说法正确的是( )A.M、N、Q三种物质的浓度一定相等 B.M、N全部变成了QC.反应混合物各组分的浓度不再变化 D.反应已经停止【答案】C
4.对可逆反应4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g),下列叙述正确的是( )A.达到化学平衡时,4v正(O2) = 5v逆(NO)B.若单位时间内生成x ml NO的同时,消耗x ml NH3, 则反应达到平衡状态C.达到化学平衡时,若增加容器体积,则正反应速率 减小,逆反应速率增大D.化学反应速率关系是:2v正(NH3) = 3v正(H2O)【答案】A
高中化学人教版 (新课标)必修2第三节 生活中两种常见的有机物说课ppt课件: 这是一份高中化学人教版 (新课标)必修2第三节 生活中两种常见的有机物说课ppt课件,共19页。PPT课件主要包含了乙酸乙酯的制备,实验装置,反应物混合方法,酯化反应机理等内容,欢迎下载使用。
化学必修2第三节 化学反应的速率和限度评课ppt课件: 这是一份化学必修2第三节 化学反应的速率和限度评课ppt课件,共26页。PPT课件主要包含了化学反应速率,反应物浓度的减少量,生成物浓度的增加量,产生气泡速率最慢,产生气泡速率较快,产生气泡速率最快,不加任何催化剂,少量MnO2,实验2-6,气泡冒出速率增大等内容,欢迎下载使用。
人教版 (新课标)必修2第二节 化学能与电能教学演示ppt课件: 这是一份人教版 (新课标)必修2第二节 化学能与电能教学演示ppt课件,共31页。PPT课件主要包含了一能源分类,氧化还原反应,火力发电,原电池原理,将化学能转化为电能的,铜片上有气泡产生,锌片不断溶解,指针发生偏转,1原电池的电极,1书写步骤等内容,欢迎下载使用。













