





高中化学人教版 (新课标)必修2第一节 化学能与热能课文内容课件ppt
展开【考纲要求】1.了解化学反应中能量转化的原因及常见的能量转化形式。2.了解化学能与热能的相互转化。了解吸热反应、放热反应、反应热等概念。3.了解能源是人类生存和社会发展的重要基础。了解化学在解决能源危机中的重要作用。
新课导入: 700多年前,著名的意大利旅行家马可·波罗到过中国,看见中国人烧煤炼铁,这是他生平第一次看到煤做燃料,马可·波罗在他的游记里记载了这件新鲜事。书中写到,中国有一种黑色石头,能燃烧,着起火来像火柴一样,而且终夜不灭。现代科学可以这样解释,煤中含有大量的碳,燃烧时放出热能。你一定想知道,这种能量从何而来?它与化学物质和化学反应有什么关系?请随我一起走进教材第二章第一节:化学能与热能。
一.化学反应中能量变化
1、化学键与化学反应中能量变化的关系
(1)化学键与能量的关系 化学反应的本质是反应物中化学键的断裂和生成物中化学键的形成。 化学键是物质内部微粒之间强烈的相互作用,断开反应物中的化学键需要 能量,形成生成物中的化学键要 能量。
(2)化学反应中能量变化的原因
(3)键能 标况下,将1ml气态分子AB断裂成理想气态原子所吸收的能量,单位(KJ·ml-1)
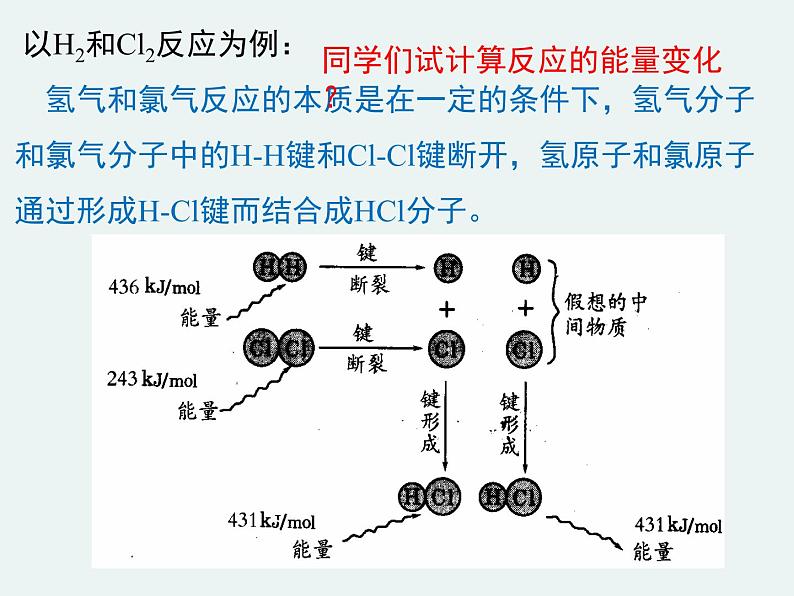
以H2和Cl2反应为例: 氢气和氯气反应的本质是在一定的条件下,氢气分子和氯气分子中的H-H键和Cl-Cl键断开,氢原子和氯原子通过形成H-Cl键而结合成HCl分子。
同学们试计算反应的能量变化?
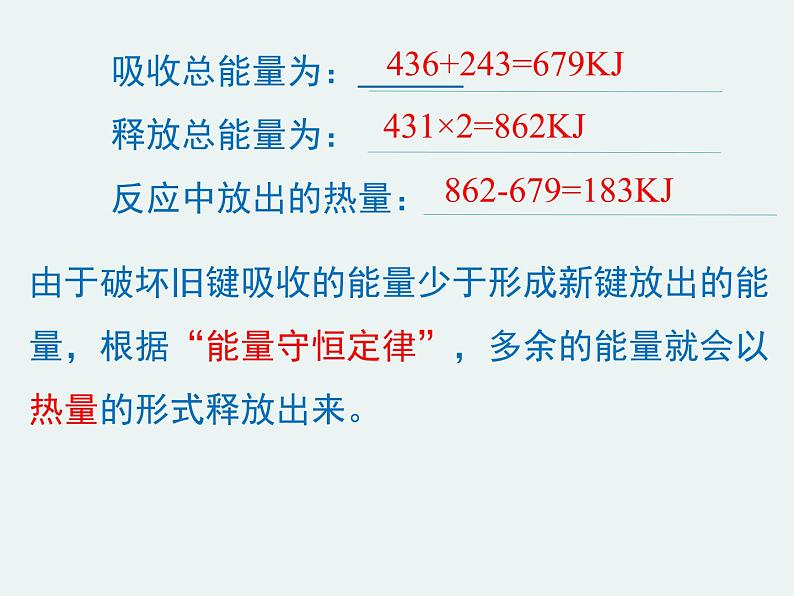
吸收总能量为: 释放总能量为: 反应中放出的热量:
436+243=679KJ
431×2=862KJ
862-679=183KJ
由于破坏旧键吸收的能量少于形成新键放出的能量,根据“能量守恒定律”,多余的能量就会以热量的形式释放出来。
(1)一个确定的化学反应在发生过程中是吸收能量还是放出能量,取决于反应物的总能量与生成物的总能量的相对大小。可表示为:
2.化学反应中能量变化的决定因素
(2)化学反应中的能量变化通常表现为 的变化,吸热或者放热。 吸热反应和放热反应与反应物和生成物总能量的关系如下: 吸热反应:反应物的总能量 生成物的总能量 放热反应:反应物的总能量 生成物的总能量
注意:任何一个化学反应均伴随能量的变化。
(3)以能量为纵坐标,画出吸热反应和放热反应的简单示意图
放热反应 吸热反应
反应物的总能量大于生成物的总能量
反应物的总能量小于生成物的总能量
二.化学能与热能的相互转化
1.两个基本的自然规律——“质量守恒”和“能量守恒”。质量守恒定律:自然界中的物质发生转化时, ___________________不变;能量守恒定律:不同形式的能量发生转换时, ___________________不变。
2.化学反应 伴随有能量的变化,化学反应中能量变化主要表现为 的变化,吸热或放热。
3.化学能与热能的实验探究
2Al+6H+===2Al3++3H2↑
Ba(OH)2·8H2O+2NH4Cl===BaCl2+10H2O+2NH3↑
OH-+H+===H2O
4.常见吸热反应和放热反应(1)常见的放热反应:①所有的燃烧反应; ②大多数的化合反应;(CO2+C 2CO为吸热反应)③酸碱中和反应; ④金属与酸或水反应置换出氢气; ⑤缓慢的氧化反应。(2)常见的吸热反应: ①大多数的分解反应; ②Ba(OH)2·8H2O与NH4Cl反应;③盐类的水解④以C、CO、H2为还原剂一些高温反应:CO2+C 2CO ;C+H2O CO+H2
注意:①放热反应和吸热反应必须是化学变化;②有热量放出未必是放热反应;③反应条件与热量变化没有必然的关系,既需要点燃或加热的反应不一定是吸热反应。
三.人类利用能源的三个阶段
1.现阶段人类获取热能的主要途径是: 使用最多的常规能源是:2.化石燃料储量有限,短期内不可再生;影响环境:煤、石油产品燃烧排放的粉尘、SO2、NOx、CO等是大气污染物的主要来源。
化石燃料(煤、石油和天然气)。
3.节能减排,提高能源的利用率;开发使用新能源,如太阳能、风能、地热能、海洋能和氢能等。4.一次能源:从自然界中直接获取的能源 二次能源:一次能源转化获取的能源
1.下列四位同学对化学反应的认识中错误的是( )
解析:化学反应中断裂旧化学键吸收能量,形成新化学键释放能量,化学变化过程中必然伴随能量变化,并有新物质产生,物质的状态变化属物理变化,C错误。
2.下列物质加入水中发生放热反应的是( )A.固体NaOH B.生石灰C.无水乙醇 D.固体NH4NO3
解析:固体NaOH加入水中放出热量,但不是化学反应,A错;生石灰(CaO)加入水发生反应CaO+H2O===Ca(OH)2,并放热,B正确;乙醇、NH4NO3固体溶于水都是物理变化,C、D错。
3.吸热反应一定是( )A.释放能量B.需要加热C.反应物总能量高于生成物总能量D.反应物总能量低于生成物总能量解析: 反应物总能量低于生成物总能量的反应属吸热反应,D正确。
4.下列变化过程中,需要吸收能量的是( )A.H+H―→H2 B.H+Cl―→HClC.Cl2―→Cl+Cl D.H2+O2―→H2O解析:H+H―→H2和H+Cl―→HCl,都属形成新化学键过程,放出热量,A、B错误;Cl2―→Cl+Cl属于破坏旧化学键过程,吸收热量,C正确;H2+O2―→H2O属于化合反应,并放出热量,D错。
5.白磷、红磷是磷的两种同素异形体。某温度下1 ml白磷转化为红磷放出29.2 kJ的热量,则下列叙述正确的是( )A.白磷比红磷稳定B.红磷比白磷稳定C.1 ml白磷比1 ml红磷含有的总能量低D.红磷转化为白磷要放热解析:1 ml白磷转化为红磷放出29.2 kJ的热量,则1 ml红磷含有的总能量低,故红磷比白磷稳定,其转化为白磷要吸热。
6.(2019·海口高一检测)对放热反应:A+B===C+D,以下说法一定正确的是(EA、EB、EC、ED分别表示物质A、B、C、D所具有的能量)( )A.EA+EB>EC+EDB.EA>EB+ECC.EA>EBD.EA+EB
判断化学反应中能量变化的一般方法
高中人教版 (新课标)第二章 化学反应与能量第一节 化学能与热能教学演示ppt课件: 这是一份高中人教版 (新课标)第二章 化学反应与能量第一节 化学能与热能教学演示ppt课件,共32页。PPT课件主要包含了能源与人类,课堂练习等内容,欢迎下载使用。
高中化学人教版 (新课标)必修2第一节 化学能与热能教案配套ppt课件: 这是一份高中化学人教版 (新课标)必修2第一节 化学能与热能教案配套ppt课件,共27页。PPT课件主要包含了反应中的能量变化,白磷的燃烧,氨的燃烧,化学反应,Al与稀盐酸反应,实验2-1,实验2-3,盐酸与氢氧化钠反应,实验2-2,刺鼻气味等内容,欢迎下载使用。
高中化学人教版 (新课标)必修2第一节 最简单的有机化合物--甲烷图文课件ppt: 这是一份高中化学人教版 (新课标)必修2第一节 最简单的有机化合物--甲烷图文课件ppt,共26页。PPT课件主要包含了有机化合物,组成与结构,结构式,正四面体,物理性质,二氯甲烷,化学性质,2稳定性,高锰酸钾,强酸强碱等内容,欢迎下载使用。













