
人教版 (新课标)必修2第一节 化学能与热能学案
展开化学能与热能
- 知道化学反应中能量变化的主要原因。
- 知道一个化学反应是吸收能量还是放出能量的决定因素。
- 通过实例和实验,了解化学能与热能的相互转化。
- 了解化学能转化为热能的应用及其对人类文明发展的贡献。
[思考] 不同的燃料其组成不同,燃烧后放出的热量也不相等。为什么不同的燃料燃烧时放出的热量会不同?燃料在燃烧反应中产生的热能来自哪里?
知识点一. 化学键与化学反应中能量变化的关系
以氢气在氯气中燃烧为例,用化学键的观点分析反应的本质过程。
H2 + Cl2 点燃 2HCl
H—H Cl —Cl H—Cl
断开 吸收能量 断开 吸收能量 形成 放出能量
2H 2Cl 2 HCl
1.在化学反应中,从反应物分子转化为生成物分子的过程中,各原子的内部并没有发生什么变化,但原子的结合方式发生了改变。在这个过程中反应物分子的化学键部分或全部遭到破坏,在生成物分子中形成新的化学键。实验证明,破坏旧的化学键时,需要从环境吸收能量来破坏原子间的相互吸引;在形成新的化学键时,由于原子间的相互吸引而对外释放能量。化学反应热就来源于旧化学键的破坏和新化学键的形成所发生的能量变化。
在25℃和101kPa的条件下,断开1molH-H键要吸收436kJ的能量,断开1mol Cl-Cl键要吸收242 kJ的能量,而形成1molHCl分子中的H-Cl键会放出431 kJ的能量。这样,由于破坏旧键吸收的能量少于形成新键放出的能量,根据“能量守恒定律”,多余的能量就会以热量的形式释放出来。
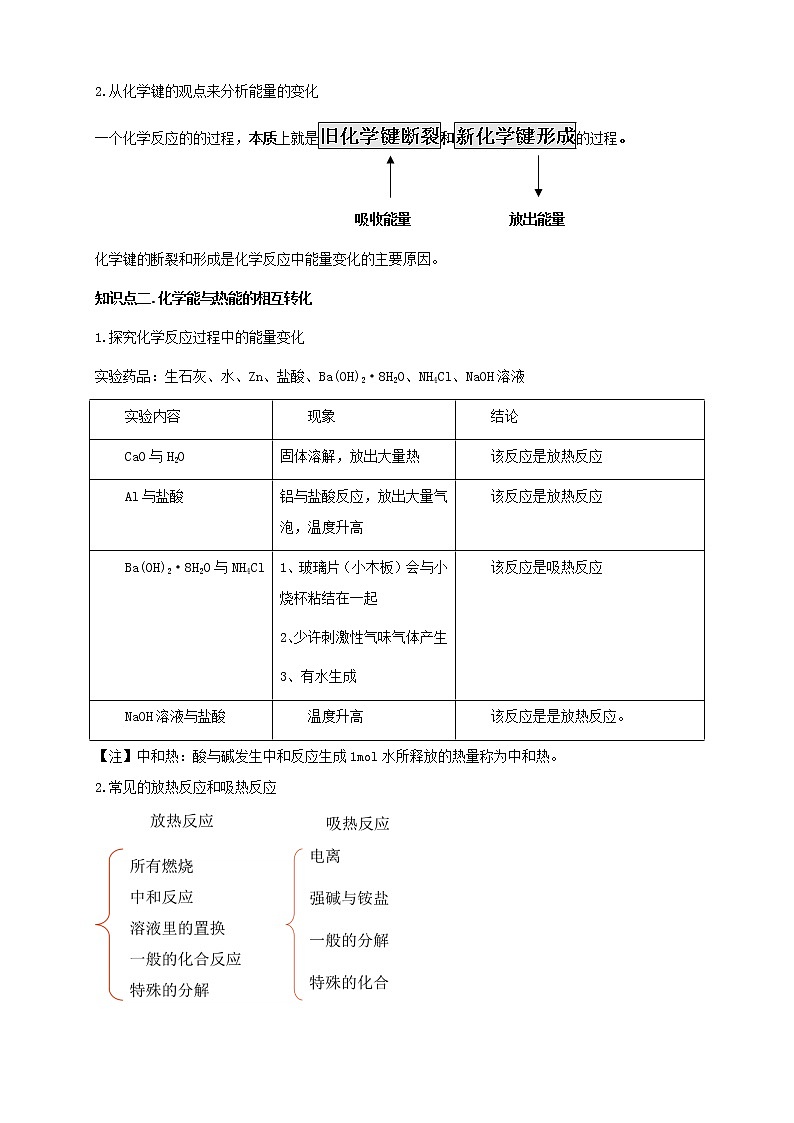
2.从化学键的观点来分析能量的变化
一个化学反应的的过程,本质上就是旧化学键断裂和新化学键形成的过程。
吸收能量 放出能量
化学键的断裂和形成是化学反应中能量变化的主要原因。
知识点二.化学能与热能的相互转化
1.探究化学反应过程中的能量变化
实验药品:生石灰、水、Zn、盐酸、Ba(OH)2·8H2O、NH4Cl、NaOH溶液
实验内容 | 现象 | 结论 |
CaO与H2O | 固体溶解,放出大量热 | 该反应是放热反应 |
Al与盐酸 | 铝与盐酸反应,放出大量气泡,温度升高 | 该反应是放热反应 |
Ba(OH)2·8H2O与NH4Cl | 1、玻璃片(小木板)会与小烧杯粘结在一起 2、少许刺激性气味气体产生 3、有水生成 | 该反应是吸热反应 |
NaOH溶液与盐酸 | 温度升高 | 该反应是是放热反应。 |
【注】中和热:酸与碱发生中和反应生成1mol水所释放的热量称为中和热。
2.常见的放热反应和吸热反应
【规律总结】
(1)键能越大,化学键越牢固,含该键的分子越稳定。
每一个化学反应都伴随有能量的改变,有的对外释放能量,有的从外界吸收能量。如果新化学键的形成所释放的能量大于破坏旧化学键所吸收的能量,该反应就是放热反应;如果新化学键的形成所释放的能量小于破坏旧化学键所吸收的能量,该反应就是吸热反应;
(2)任何化学反应除遵循质量守恒外,同样也遵循能量守恒。反应物与生成物的能量差若以热量形式表现即为放热反应或吸热反应
能量公式化:E(反应物)=E(生成物)+Q(能量守恒定律)
E(反应物)-E(生成物)=Q
Q>0为放热反应
Q<0为吸热反应
类型一:化学键与化学反应中能量变化的关系
例1. 在反应H2 + Cl2 =2HCl中,已知:H-H 键能为436kJ,Cl-Cl键能为247kJ,H-Cl键能为431kJ,判断该反应是 反应
解析:(1)化学键断裂时需要吸收能量。吸收总能量为:436kJ+247kJ=683 kJ,
(2)化学键形成时需要释放能量。释放总能量为:431kJ+431kJ=862 kJ,
(3)反应中放出的热量的计算:862kJ—683kJ=179kJ
不难看出:生成物的键能大于反应物的键能,所以,为放热反应。
答案:放热反应。
例2. 已知拆开1molH2中的化学键要吸收436kJ的能量,拆开1molO2中的化学键要吸收496 kJ的能量,形成水分子中的1mol H-O键要放出463 kJ的能量,试说明2H2+O2=2H2O中的能量变化。
解析: 反应物键能=2×436kJ+496 kJ=1368 kJ
生成物键能=2×2×463 kJ=1852 kJ
生成物键能>反应物键能,放出能量=1852 kJ-1368 kJ=484kJ
答案:该反应为放热反应,化学能转化为热能,放出能量484kJ。
类型二:化学能与热能的相互转化
例3.已知金刚石在一定条件下转化为石墨是放热的。据此,以下判断或说法正确的是( )
A.需要加热方能发生的反应一定是吸热反应
B.放热反应在常温下一定很容易发生
C.反应是放热还是吸热,必须看反应物和生成物所具有的总能量的相对大小
D.吸热反应在一定条件下也能发生
解析:需要加热方能发生的反应不一定是吸热反应,好多放热反应也需要加热如铝热反应,故A错误;放热反应在常温下不一定很容易发生,例如氢气和氧气常温下不会反应,但点燃会瞬间完成,故B错误;反应物的总能量和生成物的总能量的相对大小决定反应是吸热反应还是放热反应,故C正确;在一定条件下吸热反应也能发生,故D正确;
答案:CD.
例4.如右图所示,把试管放入盛有25℃时饱 和石灰水的烧杯中, 试管中开始放入几小块镁片,再用滴管滴入5mL盐酸于试管中. 试回答下列问题:
(1)实验中观察到的现象是___________________。
(2)产生上述现象的原因是 ___________________。
(3)写出有关反应的离子方程式___________________。
(4)由实验推知,MgCl2溶液和H2的总能量_____________。 (填“大于”、“小于”、“等于”)镁片和盐酸的总能量.
解析:镁和盐酸的反应产生氢气并放热,所以试管中有气泡产生,烧杯中的饱和石灰水由于温度升高而析出氢氧化钙;由此可知镁和盐酸的总能量大于生成的氢气和氯化镁的总能量。
答案:(1)试管中有气泡产生、饱和石灰水中有白色固体析出
(2)镁片溶于稀盐酸放出氢气,且此反应为放热反应,而温度升高,Ca(OH)2的溶解度变小
(3)Mg+2H+Mg2++H2↑
(4)小于
基础演练
一.选择题(非单选,存在一个或两个正确答案)
1.(双选)下列物质溶于水中显著放热的是( )
A.固体NaOH B.生石灰 C.无水乙醇 D.固体NH4NO3
2.下列说法正确的是( )
A.需要加热才能发生的反应一定是吸热反应
B.放热反应在常温下一定很容易发生
C.是放热反应还是吸热反应主要由反应物与生成物所具有的总能量的相对大小决定
D.是放热反应还是吸热反应只看某一反应物与某一生成物所具有的能量的相对大小
3.下列反应属于放热反应的是( )
A.铁与盐酸 B.C和CO2 C.碳酸钙的分解 D.Ba(OH)2·8H2O与NH4Cl晶体
4.下列反应过程一定吸收能量的是( )
A.化合反应 B.分解反应 C.分子拆成原子 D.原子组成分子
5.(双选)吸热反应一定是( )
A.释放能量 B.储存能量
C.反应物的总能量低于生成物的总能量 D.反应物的总能量高于生成物的总能量
6. 已物金刚石在一定条件下转化为石墨是放热的,则金刚石和石墨比较,能量“贮存”高的是( )
A.石墨 B.金刚石 C.一样高 D.无法判断
7.下列物质加入水中显著放热的是( )
A.生石灰 B.固体NaCl C.无水乙醇 D.固体NH4N03
8.对于放热反应,下列说法正确的是( )
A.产物H20所具有的总能量高于反应物H2和O2所具有的总能量
B.反应物H2和O2所具有的总能量高于产物H20所具有的总能量
C.反应物H2和O2所具有的总能量等于产物H20所具有的总能量
D.反应物H2和O2具有的能量相等
9.下列装置中能将化学能转化为热能的是( )
A.太阳能集热器 B.风力发电 C.铅蓄电池 D.燃气灶
二.填空题
1.当物质发生化学变化时,断开反应物中的化学键要 能量,而形成生成物中的化学键要 能量。1molH2中含有 H—H键,在25℃和101kPa的条件下,使1molH2变为2molH断开了 H—H键,需要 436kJ的热量,而由2molH原子生成 1mol H2,有 H—H键生成,需要 436kJ的热量。
2.化学反应中伴随着能量变化。
(1)下列反应中,属于吸热反应的是_________(填序号)。
a. 燃烧CO b. Ba(OH)2·8H2O晶体和NH4Cl晶体反应
c. 铝和稀盐酸反应 d. NaOH溶液和稀盐酸反应
(2)按图所示装置进行实验。
【实验现象】反应剧烈,火星四射,漏斗下方有红热熔融物流出。
由此判断该反应是________(填“吸热”或“放热”)反应,其反应的化学方程式是_____________________,其能量变化可用下图中的___________(填“a”或“b”)表示。
巩固提高
一.选择题
1. “摇摇冰”是一种即用即冷的饮料。吸食时将饮料罐隔离层中的化学物质和水混合后摇动即会制冷。该化学物质可能是( )。
A.氯化钠 B.固体硝酸铵 C.生石灰 D.蔗糖
2.航天飞机用铝粉与高氯酸铵(NH4C104)的混合物为固体燃料,点燃时铝粉氧化放热引发高氯酸铵反应。其方程式可表示为:
下列对此反应的叙述中错误的是( )。
A.上述反应属于分解反应
B.上述反应瞬间产生大量高温气体推动航天飞机飞行
C.反应从能量变化上说,主要是化学能转变为热能和动能
D.在反应中高氯酸铵起氧化剂作用
3.下列说法中不正确的是( )
A.化学反应中的能量变化,通常表现为热量的变化
B.反应物的总能量高于生成物的总能量时发生放热反应
C.Ba(OH)2·8H2O与NH4Cl的反应是吸热反应
D.凡是放热反应不需要加热就能发生
4.若测得盐酸和氢氧化钠溶液反生成1mol水时放出的热量为Q,则下列各反应在溶液中生成1mol水时,放出的热量也为Q的是 ( )
①醋酸和氢氧化钠溶液;②氨水和盐酸;③氢氧化钾溶液和硝酸
A.①②③ B.①③ C.②③ D.③
5.氢氯混合气体在光照的条件下可以发生爆炸。在反应过程中,假设破坏1mol氢气中的化学键需要消耗的能量为Q1kJ,破坏1mol氯气中的化学键需要消耗的能量为Q2kJ,形成1mol氯化氢可以释放出的能量为Q3kJ。下列关系正确的是 ( )
A. Q1+Q2> Q3 B.Q1+Q2> 2Q3 C.Q1+Q2< Q3 D.Q1+Q2<2Q3
6.能够用键能大小来解释现象的是 ( )
A.常温常压下,溴为液态,碘为固态 B.氮气的化学稳定性比氧气大
C.稀有气体一般情况下很难发生化学反应 D.硝酸易挥发而硫酸难挥发
7. 如下图,表示正反应是吸热反应的是( )
8.已知化学反应2C(s) +O2(g)CO2(g)、2CO(g) +O2(g)2CO2(g)都是放热反应,据此判断,下列说法错误的是
A.12gC所具有的能量一定高于28gCO所具有的能量
B.56gCO和32gO2所具有的总能量大于44gCO2所具有的总能量
C.12gC和32g O2所具有的总能量大于44gCO2所具有的总能量
D.将一定质量的碳燃烧,生成CO2比生成CO时放出的热量多
二.填空题
1.下表中的数据是破坏1mol物质中的化学键所消耗的能量(KJ):
物质 | Cl2 | Br2 | I2 | HCl | HBr | HI | H2 |
能量(KJ) | 243 | 193 | 151 | 432 | 366 | 298 | 436 |
根据上述数据回答:
(1)下列物质本身具有的能量最低的是( )
A.H2 B.Cl2 C.Br2 D.I2
(2)下列氢化物中最稳定的是( )
A.HCl B.HBr C.HI
(3)X2+H2=2HX(X代表Cl、Br、I)的反应是 (填放热或吸热)反应。
(4)相同条件下,X2(X代表Cl、Br、I)分别与氢气反应,当消耗等质量的氢气时,放出或吸收的热量最多的是 。
(5) 若无上表中的数据,你能正确回答出问题(4)吗?你的依据是什么?
_________________________________
2. 火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水.当它们混合反应时,即产生大量氮气和水蒸气,并放出大量热.已知0.4 mol液态肼与足量液态双氧水反应,生成氮气和水蒸气,放出256.652 kJ的热量。又已知H2O(l)===H2O(g),ΔH=+44 kJ·mol-1,由16 g液态肼与液态双氧水反应生成液态水时放出的热量是__________kJ.
一. 选择题
1. 下列反应中生成物总能量高于反应物总能量的是()
A.碳酸钙受热分解 B.乙醇燃烧
C.铝粉与氧化铁粉末反应 D.氧化钙溶于水
2. (双选)已知H-Cl键的键能是431.4 kJ·mol-1,下列关于键能的叙述中正确的是 ( )
A.每生成1molH-Cl键就放出431.4 kJ·mol-1的能量
B.每生成1molH-Cl键就吸收431.4 kJ·mol-1的能量
C.每拆开1molH-Cl键就放出431.4 kJ·mol-1的能量
D.每拆开1molH-Cl键就吸收431.4 kJ·mol-1的能量
3.参考下表中键能的数据,判断下列分子受热时最稳定的是 ( )
化学能 | H-H | H-F | H-Cl | H-Br |
键能(kJ·mol-1) | 436 | 565 | 431 | 368 |
A.H2 B.HF C.HCl D. HBr
4.(双选)钾可以跟水发生剧烈的反应,表现出多种实验现象,其中与该反应放热无关的是( )
A.钾浮在水面上
B.钾熔化成小球
C.产生的氢气燃烧,甚至发生轻微的爆炸
D.熔化的钾球四处游动
5.已知2H2+O22H2O。下列关于该反应的说法中错误的是( )
①该反应是一个放热反应 ②参加反应的氢气和氧气的总能量高于反应生成的水的总能量 ③该反应是一个吸热反应 ④参加反应的氢气和氧气的总能量低于反应生 成的水的总能量
A.①② B.①④ C.②③ D.③④
6. 氢气在氯气中燃烧时发出苍白色火焰,在反应过程中,破坏1 mol氢气中的化学键消耗的能量为a kJ,破坏1 mol氯气中的化学键消耗的能量为b kJ,形成1 mol HCl中的化学键释放的能量为c kJ,下列关系中正确的是( )
A.b>c B.a+b>2c C.a+b<c D.a+b<2c
7.下列变化属于吸热反应的是( )
A.将胆矾加热变成白色粉末 B.葡萄糖在人体内氧化分解
C.干冰升华 D.生石灰与水反应生成熟石灰
二.填空题
1.下列反应中,属于放热反应的是 ,属于吸热反应的是 。
①煅烧石灰石(主要成分是CaCO3)制生石灰(CaO) ②燃烧木炭取暖 ③炸药爆炸 ④酸与碱的中和反应 ⑤生石灰与水作用制熟石灰 ⑥食物因氧化而腐败
2. 化学反应中的吸热现象、放热现象,实质取决于 具有的能量;若反应是放热反应,则证明反应物具有的能量 (填>、=、<=生成物具有的能量.若反应是吸热反应,则证明反应物具有的能量 ,生成物具有的能量 。
_________________________________________________________________________________
_________________________________________________________________________________
一.选择题
1. A+B=C+D是化学反应,已知该反应为放热反应,对该反应的说法正确的是 ( )
A.A的能量一定高于C 的能量
B.B的能量一定高于D的能量
C.反应物A与B的总能量一定低于生成物C与D的总能量
D.反应物A与B的总能量一定高于生成物C与D的总能量
2. 下列反应属于放热反应的是( )
A.Al和盐酸的反应 B.灼热的碳与二氧化碳的反应
C.石灰石的受热分解 D.天燃气的燃烧
3.下列联系实际的说法正确的是( )
| A. | 可燃冰就是固态甲烷 | |||
| B. | 人类目前直接利用的能量大部分是由化学反应产生的 | |||
| C. | 煤、石油、天然气都是可再生能源 | |||
| D. | 硫和碳的氧化物是形成酸雨的主要物质 | |||
4.下列说法中,错误的是( )
| A. | 人类目前所直接利用的能量大部分是由化学反应产生的 |
| B. | 煤、石油、天然气是当今世界最重要的三种化石燃料 |
| C. | 化学变化中的能量变化主要是由化学键变化引起的 |
| D. | 化学反应中能量变化的大小与反应物的质量多少无关 |
5.(双选)下列反应属于放热反应的是( )
A.氢气还原氧化铜 B.氢气在氧气中燃烧
C.氢氧化钾和硫酸中和 D.碳酸钙高温分解成氧化钙和二氧化碳
6.下列选项中说明氢气作为燃料的优点的是( )
①燃烧时发生氧化反应 ②充分燃烧的产物不污染环境
③氢气是一种再生能源 ④燃烧时放出大量热量
A、①②③ B、①②④ C、①③④ D、②③④
7. 在25 ℃,101 kPa下,1 mol的白磷(化学式为P4)完全燃烧放出的热量比4 mol的红磷(化学式为P)完全燃烧放出的热量多。反应方程式分别为:
P4 (s) + 5O2 (g) = P4O10 (s) ;
4P (s)+ 5O2 (g) = P4O10 (s)
由此判断,下列说法正确的是……………………………………………………( )
A.由红磷转化为白磷是吸热反应,等质量时红磷能量比白磷高
B.由红磷转化为白磷是放热反应,等质量时红磷能量比白磷低
C.由红磷转化为白磷是放热反应,等质量时红磷能量比白磷高
D.由红磷转化为白磷是吸热反应,等质量时红磷能量比白磷低
二.填空题
1.已知破坏1mol N≡N键、H-H键和N-H键分别需要吸收的能量为946kJ、436kJ、391kJ。试计算1molN2(g)和3 molH2(g)完全转化为 NH3(g)的反应热的理论值。
2. 如图所示,在一个小烧杯里,加入20 g Ba(OH)2·8H2O晶体,将小烧杯放在事先已滴有3~4滴水的小玻璃片上,然后加入10 g NH4Cl晶体,并用玻璃棒迅速搅拌。
(1)实验中玻璃棒的作用是
_______________________________________________________________________
(2)写出有关反应的化学方程式:________________________________,该反应的类型属于________反应。
(3)实验中观察到的现象有________________________,________________________,混合物呈糊状。呈糊状的原因是____________________。
(4)通过________现象,说明该反应为________(填“吸”或“放”)热反应,这是由于反应物的总能量________生成物的总能量。
本讲参考答案
基础演练
一.选择题
1.A B 2.C 3.A 4.C 5.B.C 6.B 7.A 8.B 9.D
二.填空题
1.吸收,1mol,吸收,1mol
2. (1)b (2)放热 Fe2O3+2Al Al2O3+2 Fe a
巩固提高
一.选择题
1.B 2.D 3.D 4.D 5.D 6.B 7.A 8.A
二.填空题
1、(1)A (2)A (3)放热反应 (4)Cl2
(5)能,元素的非金属性越强,生成的氢化物越稳定,越易生成,放出的热量越多
2、408.815
当堂检测
一 . 选择题
1.A 2.AD 3.B 4.AD 5.D 6.D 7.A
二.填空题
1、②③④⑤⑥,①
2、反应物与生成物;>;<。
家庭作业
一.选择题
1.D 2.AD 3.B 4.D 5.BC 6.D 7.D
二.填空题
1. 92Kj
2. (1)搅拌,使混合物充分接触并起反应
(2)Ba(OH)2·8H2O+2NH4Cl===BaCl2+2NH3↑+10H2O 复分解
(3)玻璃片上结冰而与小烧杯粘在一起 有少许刺激性气味的气体放出 反应有水生成
(4)结冰 吸 小于
高中化学人教版 (新课标)选修4 化学反应原理第三节 盐类的水解学案及答案: 这是一份高中化学人教版 (新课标)选修4 化学反应原理第三节 盐类的水解学案及答案,共11页。学案主要包含了盐类的水解,电离,溶液中微粒浓度的大小比较等内容,欢迎下载使用。
人教版 (新课标)选修4 化学反应原理第四章 电化学基础第一节 原电池导学案: 这是一份人教版 (新课标)选修4 化学反应原理第四章 电化学基础第一节 原电池导学案,共11页。学案主要包含了原电池的工作原理,原电池原理的应用等内容,欢迎下载使用。
人教版 (新课标)必修2第四节 基本营养物质学案: 这是一份人教版 (新课标)必修2第四节 基本营养物质学案,共16页。