





人教版 (2019)选择性必修1第三节 盐类的水解教课课件ppt
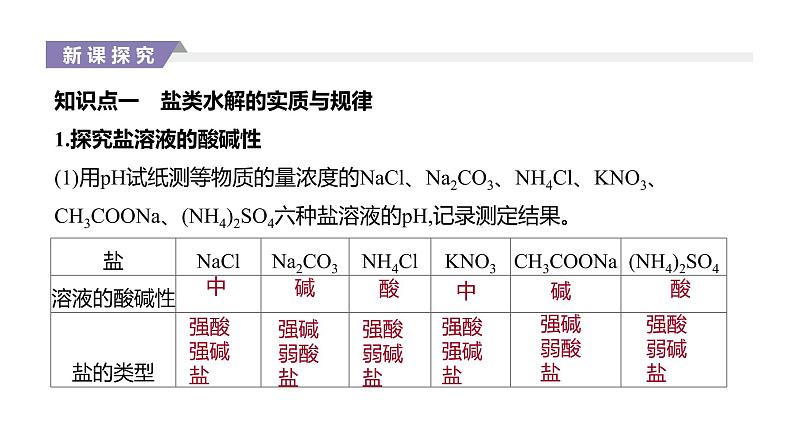
展开知识点一 盐类水解的实质与规律1.探究盐溶液的酸碱性(1)用pH试纸测等物质的量浓度的NaCl、Na2CO3、NH4Cl、KNO3、CH3COONa、(NH4)2SO4六种盐溶液的pH,记录测定结果。
2.盐溶液呈现不同酸碱性的原因(1)NH4Cl溶液
(3)NaCl溶液溶液里 弱电解质生成,H2O的电离平衡未受到影响,溶液显 性。 3.盐类水解(1)概念溶液中盐电离出来的离子跟水电离出来的 结合生成 的反应。
(5)规律①“有弱才水解、无弱不水解”盐中有 才水解。 ②“越弱越水解”弱酸阴离子对应的酸越弱,水解 ;相同浓度的Na2CO3和NaHCO3溶液中pH大的是 。弱碱阳离子对应的碱越弱,水解 ;如相同浓度的NH4Cl和FeCl3溶液中pH小的是 。
弱酸阴离子或弱碱阳离子
③“谁强显谁性,同强显中性”强酸弱碱盐 ,强碱弱酸盐 ,强酸强碱盐 。 ④“都弱都水解”弱酸弱碱盐电离出的弱酸阴离子和弱碱阳离子都发生水解,且相互促进。
[素养养成] 盐溶液发生水解,必须有“弱离子”,常见的弱碱阳离子、弱酸阴离子有哪些?
例1 下列物质溶于水因水解而呈碱性的是( )A.Na2O B.Na2CO3 C.NH4Cl D.NH3·H2O
[解析] 根据盐的水解原理结合图示的内容可以知道X离子水解显示酸性。碳酸根水解,显示碱性,A错误;钠离子不会发生水解,C错误;
碳酸氢根离子水解显示碱性,B错误;
铵根离子水解溶液显示酸性,D正确。
例3 等物质的量浓度的下列物质的溶液,其pH由小到大的顺序排列正确的是 ( )①CH3COONa ②NaOH ③NaNO3 ④HCl ⑤Al2(SO4)3A.①②③④⑤B.⑤④③②①C.④⑤③①②D.④⑤②①③
[解析] ①为强碱弱酸盐,溶液pH略大于7;②为强碱,溶液pH大于7,且pH:①<②;③为强酸强碱盐,溶液pH等于7;④为强酸,溶液pH小于7;⑤为强酸弱碱盐,溶液pH小于7,且pH:④<⑤<③;综合上述分析C项正确。
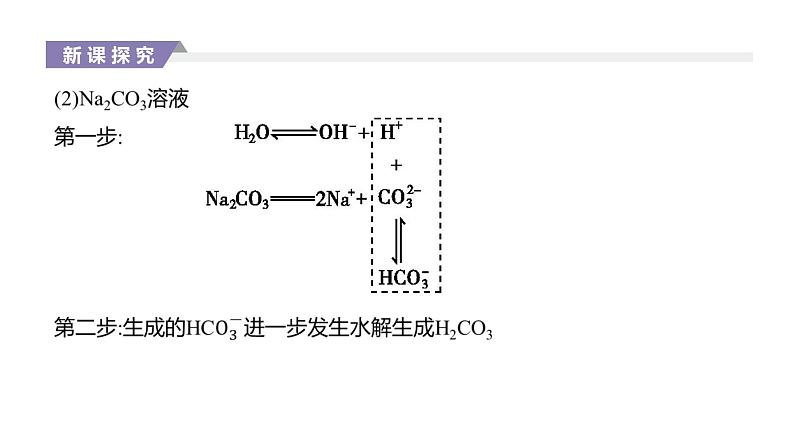
知识点二 盐类水解离子方程式的书写1.盐类水解的离子方程式一般用“ ”连接,由于水解程度通常较小,产物的量也很少,一般不标“↑”“↓”等符号。 2.多元弱酸根离子水解的离子方程式应分步书写,水解以第一步为主,如Na2CO3溶液水解的离子方程式为 (主要); (次要)。
[素养养成] 盐类水解反应是离子反应吗?与离子反应相比,有什么特点?
提示:盐类水解属于离子反应,盐类水解反应是可逆反应,是微弱的,是中和反应的逆过程,是吸热反应,书写离子方程式时一般不标“↑”“↓”等符号。
例5 下列盐溶液中能发生水解的用离子方程式表示,不能发生水解的请写上“不发生水解”字样并说明溶液的酸碱性:(1)CH3COONa , 溶液呈 性。 (2)BaCl2 ,溶液呈 性。 (3)CuCl2 ,溶液呈 性。
(2)氯化钡是强酸强碱盐,不会水解,溶液显中性;
4.相同温度、相同浓度下的六种溶液,其pH由小到大的顺序如图3-3-2所示,图中①②③代表的物质可能分别为( )A.NH4Cl (NH4)2SO4 CH3COONaB.(NH4)2SO4 NH4Cl CH3COONaC.(NH4)2SO4 NH4Cl NaOHD.CH3COOH NH4Cl (NH4)2SO4
5.写出下列物质发生水解反应的离子方程式,并指明水溶液的酸碱性:(1)Na2SO3: 。 (2)CuSO4: 。 (3)NH4Cl: 。 (4)NaClO: 。
[解析] Na2SO3、NaClO为强碱弱酸盐,溶液呈碱性,CuSO4、NH4Cl为强酸弱碱盐,溶液呈酸性。
1.物质的量浓度相同的三种盐NaX、NaY和NaZ的溶液,其pH分别为8、9、10,则HX、HY、HZ的酸性由强到弱的顺序是( )A.HX,HZ,HY B.HX,HY,HZC.HZ,HY,HX D.HY,HZ,HX
[解析] 利用盐类水解规律“越弱越水解,谁强显谁性”,结合同浓度三种酸对应的钠盐的溶液的pH可推知,碱性越强则对应的酸越弱。
2.(1)常温下,0.10 ml·L-1 NH4Cl溶液的pH (填“>”“=”或“<”)7。
(2)相同物质的量浓度的Na2S溶液与NaHS溶液,pH大小:Na2S (填“>”“=”或“<”)NaHS,两种溶液中粒子种类数:Na2S (填“>”“=”或“<”)NaHS。
人教版 (2019)选择性必修1第三节 盐类的水解教案配套课件ppt: 这是一份人教版 (2019)选择性必修1第三节 盐类的水解教案配套课件ppt,共60页。PPT课件主要包含了玻璃棒,2实验结果,强碱弱酸,强酸弱碱,氢氧根,盐类水解的特点,盐类水解的规律,课堂回眸等内容,欢迎下载使用。
高中化学人教版 (2019)选择性必修1第三章 水溶液中的离子反应与平衡第三节 盐类的水解教课课件ppt: 这是一份高中化学人教版 (2019)选择性必修1第三章 水溶液中的离子反应与平衡第三节 盐类的水解教课课件ppt,共42页。PPT课件主要包含了正反应,逆反应,cOH-,在HCl气流中,FeOH3,Fe2O3,Al3+,HBHA,氧化镁或氢氧化镁,③②①等内容,欢迎下载使用。
人教版 (2019)选择性必修1第三节 盐类的水解示范课课件ppt: 这是一份人教版 (2019)选择性必修1第三节 盐类的水解示范课课件ppt,共42页。PPT课件主要包含了图3-3-3,图3-3-4等内容,欢迎下载使用。













