

- 3-1-2铁的重要化合物 练习 试卷 0 次下载
- 3-2-1铁合金 铝和铝合金 新型合金 练习 试卷 0 次下载
- 第三章铁金属材料章节检测 试卷 0 次下载
- 4-1-1原子结构 练习 试卷 0 次下载
- 4-1-2元素周期表 练习 试卷 1 次下载
化学必修 第一册第二节 金属材料练习
展开时间:45分钟
eq \a\vs4\al(一、选择题)
1.把足量的铁粉投入到溶解有硫酸和硫酸铜的溶液中,充分反应后,剩余金属粉末的质量与原加入铁粉的质量相等,则原溶液中H+与SOeq \\al(2-,4)的物质的量浓度之比为( A )
A.14 B.27
C.12 D.38
解析:设原溶液中H2SO4和CuSO4物质的量分别为a和b。Fe+H2SO4===FeSO4+H2↑,Fe+CuSO4===FeSO4+Cu。由题意:56(a+b)=64b,eq \f(a,b)=eq \f(1,7),c(H+)c(SOeq \\al(2-,4))=eq \f(2a,a+b)=eq \f(1,4)。
2.取含有0.02 ml的硫酸溶液,先投入0.24 g镁粉,再滴入NaOH溶液,当使溶液中的镁离子全部转化为沉淀时,需要NaOH的物质的量为( C )
A.0.02 ml B.0.03 ml
C.0.04 ml D.0.01 ml
解析:取含有0.02 ml的硫酸溶液,先投入0.24 g镁粉,镁与硫酸反应生成硫酸镁和氢气,再滴入NaOH溶液,生成氢氧化镁和硫酸钠,当使溶液中的镁离子全部转化为沉淀时,溶液恰好为硫酸钠溶液,根据原子守恒,需要NaOH的物质的量为0.02×2=0.04 ml,选C。
3.现有一块铝铁合金,欲测定其铝的质量分数,切下W g合金,溶于盐酸中,再加入过量NaOH溶液,滤出沉淀,将沉淀在空气中充分灼烧,最后得到W g红棕色粉末。则此合金中铝的质量分数约为( B )
A.20% B.30%
C.70% D.80%
解析:将铝铁合金粉末溶于足量盐酸中,加入过量NaOH溶液,沉淀为氢氧化铁,灼烧后得到的红棕色固体为氧化铁,氧化铁质量等于合金的质量,利用组成可知Fe2O3中O元素的质量等于合金中Al的质量,则合金中Al的质量分数=氧化铁中氧的质量分数=eq \f(16×3,160)×100%=30%。
4.已知Na2O2可与H2O(g)、CO2发生反应:2H2O(g)+2Na2O2===4NaOH+O2、2CO2+2Na2O2===2Na2CO3+O2,现将1 ml CO2与水蒸气的混合气体通入盛有足量Na2O2的试剂瓶中,充分反应放出气体后称量固体,则试剂瓶中固体质量可能增加( B )
A.2 g B.20 g
C.28 g D.32 g
解析:假设通入气体全部为水蒸气,依据反应可得
2H2O(g)+2Na2O2===4NaOH+O2 Δm
2 ml 156 g 160 g (160-156) g
1 ml 2 g
同理,假设通入气体全部为CO2,依据反应2CO2+2Na2O2===2Na2CO3+O2可得1 ml CO2反应时Δm=28 g,故1 ml CO2与水蒸气的混合气体与Na2O2充分反应后固体增加的质量介于2 g~28 g之间,故答案为B。
5.用一定物质的量浓度的NaOH溶液使相同体积的FeSO4溶液和Fe2(SO4)3溶液中的Fe2+、Fe3+完全沉淀,若所用的NaOH溶液的体积相同,则FeSO4溶液和Fe2(SO4)3溶液的物质的量浓度之比为( C )
A.11 B.13
C.31 D.32
解析:根据关系式2NaOH~FeSO4、6NaOH~Fe2(SO4)3,可知与相同物质的量的NaOH反应消耗的FeSO4和Fe2(SO4)3的物质的量之比为31,在体积相同的情况下,FeSO4溶液和Fe2(SO4)3溶液的物质的量浓度之比为31。
6.分别在两份等体积等物质的量浓度的烧碱溶液和稀硫酸中加入过量的铝粉,充分反应后,放出H2气体(相同状况)的体积之比为( C )
A.31 B.13
C.32 D.11
解析:设两份等体积等物质的量浓度的烧碱溶液和稀硫酸中溶质NaOH、H2SO4的物质的量均为3 ml,则产生H2的物质的量分别为
2Al+2NaOH+2H2O===2NaAlO2+3H2↑
3 ml 4.5 ml
2Al+3H2SO4===Al2(SO4)3+3H2↑
3 ml 3 ml
故充分反应后,相同状况下产生H2的体积比=物质的量之比=4.5 ml3 ml=32。
7.50 g镁、锌、铁的混合物与一定量的10%的稀硫酸恰好完全反应,将反应后的混合溶液蒸干后可得不含结晶水的固体146 g,则反应生成氢气的质量为( B )
A.1 g B.2 g
C.3 g D.4 g
解析:不含结晶水的固体是硫酸盐,其中SOeq \\al(2-,4)的质量是146 g-50 g=96 g,其物质的量是1 ml。氢气的物质的量等于SOeq \\al(2-,4)的物质的量,故生成氢气的质量是2 g。
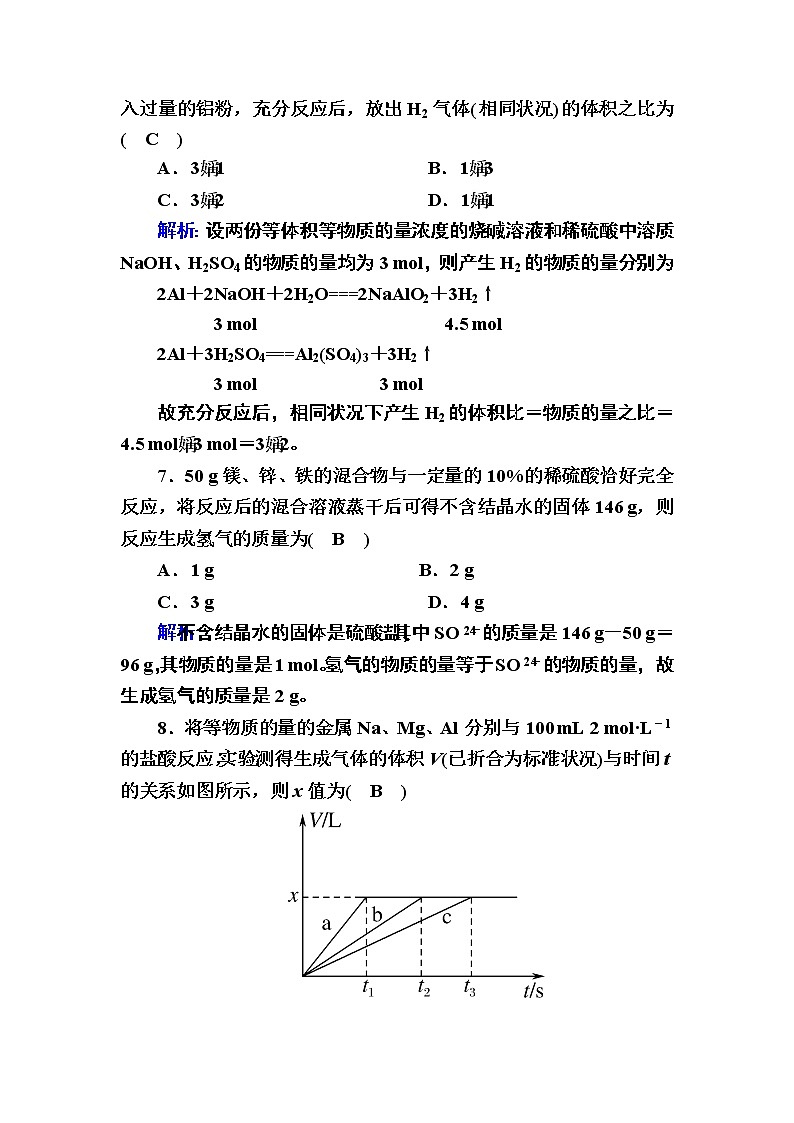
8.将等物质的量的金属Na、Mg、Al分别与100 mL 2 ml·L-1的盐酸反应,实验测得生成气体的体积V(已折合为标准状况)与时间t的关系如图所示,则x值为( B )
A.1.12 B.2.24
C.4.48 D.无法确定
解析:Na既能与酸反应又能与水反应,钠一定没有剩余;等物质的量的金属Na、Mg、Al完全反应放出氢气的体积比为123,根据图象可知Na、Mg、Al分别与100 mL 2 ml·L-1的盐酸反应放出的氢气一样多,所以Mg、Al都有剩余,盐酸完全反应,放出氢气的体积为0.1 L×2 ml·L-1×eq \f(1,2)×22.4 L·ml-1=2.24 L。
9.向500 mL 2 ml·L-1的CuSO4溶液中插入一铁片,反应片刻后取出铁片,洗涤、烘干,称其质量比原来增加2.0 g。下列说法错误的是(设反应后溶液的体积不变)( D )
A.参加反应的铁的质量是14 g
B.析出的铜的物质的量是0.25 ml
C.反应后溶液中c(CuSO4)=1.5 ml·L-1
D.反应后溶液中c(FeSO4)=1.5 ml·L-1
解析:发生反应Fe+CuSO4===FeSO4+Cu,根据差量法得56 g8 g=m(Fe)2.0 g,解得m(Fe)=14 g,A项正确;由于1 ml8 g=n(Cu)2.0 g,故n(Cu)=0.25 ml,B项正确;原溶液中n(CuSO4)=0.5 L×2 ml·L-1=1 ml,反应中消耗n(CuSO4)=0.25 ml,反应后溶液中c(CuSO4)=eq \f(1 ml-0.25 ml,0.5 L)=1.5 ml·L-1,C项正确;反应后溶液中c(FeSO4)=eq \f(0.25 ml,0.5 L)=0.5 ml·L-1,D项错误。
10.将0.2 ml钠和铝的混合物溶于足量的盐酸中,产生3 136 mL(标准状况下)氢气,则钠和铝的物质的量之比为( C )
A.13 B.31
C.41 D.14
解析:H2的物质的量为eq \f(3 136×10-3 L,22.4 L·ml-1)=0.14 ml。设混合物中钠和铝的物质的量分别为x ml、y ml,则:
2Na+2HCl===2NaCl+H2↑
2 1
x eq \f(x,2)
2Al+6HCl===2AlCl3+3H2↑
2 3
y eq \f(3,2)y
则eq \b\lc\{\rc\ (\a\vs4\al\c1(x+y=0.2,,\f(x,2)+\f(3,2)y=0.14,))解得eq \b\lc\{\rc\ (\a\vs4\al\c1(x=0.16,,y=0.04,))
故Na和Al的物质的量之比为41。
11.将11.5 g钠、9 g铝、28 g铁分别投入200 mL 1 ml·L-1的盐酸中,下列分析结果正确的是( A )
A.钠与盐酸反应最剧烈,产生的气体最多
B.铝与盐酸反应的速率仅次于钠,但产生的气体最多
C.铁与盐酸反应产生的气体比钠多
D.反应结束时产生的气体一样多
解析:金属越活泼,和酸反应越剧烈,金属活动性强弱顺序是Na>Al>Fe,2Na+2HCl===2NaCl+H2↑,11.5 g金属钠消耗盐酸的物质的量n(HCl)=eq \f(11.5,23) ml=0.5 ml>0.2 ml,因此金属钠过量,但金属钠能和水反应生成氢气,因此钠反应生成氢气的物质的量为eq \f(1,2)×eq \f(11.5 g,23 g·ml-1)=0.25 ml,同理,根据2Al+6HCl===2AlCl3+3H2↑、Fe+2HCl===FeCl2+H2↑知,铝、铁与盐酸反应时,均是盐酸不足,故二者产生氢气的量相等,产生氢气的物质的量为eq \f(0.2 L×1 ml·L-1,2)=0.1 ml,故A项正确。
12.在FeCl3和CuCl2的混合液中逐渐加入铁粉,溶液中Fe2+的物质的量浓度和加入铁粉的物质的量之间的关系如图所示。则该溶液中FeCl3与CuCl2的物质的量浓度之比为( C )
A.31 B.12
C.21 D.11
解析:根据氧化性:Fe3+>Cu2+,加入铁后会依次发生氧化还原反应:①Fe+2Fe3+===3Fe2+,②Fe+Cu2+===Cu+Fe2+,从题图中可知加入2 ml Fe时,发生反应①生成Fe2+的物质的量为6 ml,反应的Fe3+的物质的量为4 ml,即FeCl3为4 ml;再加入2 ml铁发生反应②,此时生成Fe2+物质的量为2 ml,原溶液中Cu2+的物质的量为2 ml,即CuCl2为2 ml;同一溶液中浓度之比等于物质的量之比,所以原溶液中FeCl3、CuCl2的浓度之比为4 ml2 ml=21。
13.Mg、Al组成的混合物与足量盐酸反应,产生标准状况下的氢气4.48 L。下列推断中不正确的是( A )
A.参加反应的Mg、Al共0.2 ml
B.参加反应的HCl为0.4 ml
C.Mg、Al在反应中共失去0.4 ml电子
D.若与足量的稀硫酸反应能产生0.2 ml H2
解析:反应的实质为Mg+2H+===Mg2++H2↑,2Al+6H+===2Al3++3H2↑,n(H2)=eq \f(4.48 L,22.4 L·ml-1)=0.2 ml,则参加反应的n(H+)=0.4 ml,即参加反应的HCl为0.4 ml。若换成稀硫酸,同样产生0.2 ml H2。依据得失电子守恒,由2H+―→H2得电子总数为0.2 ml×2=0.4 ml,故C正确。0.2 ml Mg提供0.4 ml电子,0.2 ml Al则提供0.6 ml电子,0.2 ml Mg、Al的混合物提供的电子数大于0.4 ml,小于0.6 ml,A不正确。
14.用足量的CO还原13.7 g某铅氧化物,把生成的CO2全部通入到过量的澄清石灰水中,得到的沉淀干燥后质量为8.0 g,则此铅氧化物的化学式是( C )
A.PbO B.Pb2O4
C.Pb3O4 D.PbO2
解析:设此铅氧化物的化学式为PbxOy,有:
PbxOy~y[O]~yCO~yCO2~yCaCO3
16y 100y
m(O)=1.28 g 8.0 g
所以m(Pb)=13.7 g-1.28 g=12.42 g
xy=eq \f(mPb,MPb)eq \f(mO,MO)=eq \f(12.42 g,207 g/ml)eq \f(1.28 g,16 g/ml)=34。
eq \a\vs4\al(二、填空题)
15.(1)等物质的量的钠、镁、铝分别与足量盐酸反应,产生的氢气在相同条件下的体积比为123。
(2)等质量的钠、镁、铝分别与足量盐酸反应,产生的氢气在相同条件下的体积比为eq \f(1,23)eq \f(1,12)eq \f(1,9)(或366992)。
(3)将物质的量均为0.2 ml的钠、镁、铝分别投入100 mL 1 ml·L-1的盐酸中,三者产生的氢气在相同条件下的体积比为211。
解析:(1)金属完全反应,令金属的物质的量均为1 ml,根据得失电子守恒,Na反应生成氢气的物质的量为eq \f(1 ml×1,2)=0.5 ml,Mg反应生成氢气的物质的量为eq \f(1 ml×2,2)=1 ml,Al反应生成氢气的物质的量为eq \f(1 ml×3,2)=1.5 ml,相同条件下,气体体积之比等于物质的量之比,则等物质的量的Na、Mg、Al生成氢气体积之比=0.5 ml1 ml1.5 ml=123。
(2)金属完全反应,令金属的质量均为1 g,则利用反应关系式:
2Na~H2↑
46 2
1 g m
列比例式可得:m=eq \f(1 g×2,46)=eq \f(1,23) g;
同理可得1 g Mg、Al反应产生氢气的质量分别为eq \f(1,12) g、eq \f(1,9) g,即质量相同的Na、Mg、Al生成氢气的质量之比=eq \f(1,23) geq \f(1,12) geq \f(1,9) g=366992。相同条件下,氢气的体积之比等于其质量之比。
(3)100 mL 1 ml·L-1的盐酸中H+物质的量为0.1 L×1 ml·L-1=0.1 ml,若将0.2 ml金属钠、镁、铝分别投入到100 mL 1 ml·L-1的盐酸中,可知三种金属都过量,盐酸不足,但金属钠能与水继续反应生成氢气,所以镁、铝反应生成的氢气一样多,其生成氢气的物质的量为eq \f(0.1 ml,2)=0.05 ml,而钠反应生成的氢气最多,其生成氢气的物质的量为eq \f(0.2 ml,2)=0.1 ml,故Na、Mg、Al生成氢气的体积比为0.1 ml0.05 ml0.05 ml=211。
16.铝镁合金已成为飞机制造、化工生产等行业的重要材料。研究性学习小组的同学,为测定某含镁3%~5%的铝镁合金(不含其他元素)中镁的质量分数,设计下列实验方案进行探究。填写下列空白。
[实验方案]将铝镁合金与足量稀硫酸溶液反应,测定生成气体在通常状况(约20 ℃,1.01×105 Pa)的体积。
[问题讨论](1)同学们拟选用如图所示实验装置完成实验:
①你认为最简易的装置连接顺序是A接(E)(D)接(G)。(填接口字母符号,可不填满)
②实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开其活塞,一会儿后稀硫酸也不能顺利滴入锥形瓶。请你帮助分析原因合金与稀硫酸反应放热且生成气体,使锥形瓶中气体压强变大。
(2)仔细分析实验装置后,同学们经讨论认为以下两点会引起较大误差:稀硫酸滴入锥形瓶中,即使不生成氢气,也会将瓶内空气排出,使所测氢气体积偏大;实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氢气体积偏小。于是他们设计了如图所示的实验装置。(碱式滴定管上的刻度数值上小下大)
①装置中导管a的作用是使分液漏斗内气体压强与锥形瓶内气体压强相等,打开分液漏斗活塞时稀硫酸能顺利滴下;滴入锥形瓶的稀硫酸的体积等于进入分液漏斗的气体体积,从而消除由于加入稀硫酸引起的氢气体积误差。
②实验前后碱式滴定管中液面读数分别为V1 mL、V2 mL。则产生氢气的体积为V1-V2 mL。
解析:实验中通过测定气体体积来确定样品中各组分的质量分数,所以装置的连接顺序为A、E、D、G;稀硫酸不能滴入的原因是产生的氢气使锥形瓶内的压强大于外界大气压所致;导管a的作用是平衡气压,使液体能够顺利滴下,同时消除硫酸的滴入对气体体积的影响。
17.已知MnO2与浓盐酸反应的化学方程式为MnO2+4HCl(浓)eq \(=====,\s\up17(△))MnCl2+Cl2↑+2H2O,回答下列问题:
(1)该反应的离子方程式为MnO2+4H++2Cl-eq \(=====,\s\up17(△))Mn2++Cl2↑+2H2O。
(2)被氧化的HCl占HCl总量的eq \f(1,2)。
(3)当标准状况下有11.2 L氯气生成时,该反应转移的电子数为NA(设NA为阿伏加德罗常数的值)。
(4)1.74 g MnO2与100 mL 12 ml·L-1的过量浓盐酸完全反应(假设HCl无挥发),在反应后的溶液中加入足量的AgNO3溶液,可生成166.46 g沉淀。
解析:(1)书写该反应的离子方程式时,HCl、MnCl2要拆写成离子形式,故反应的离子方程式为MnO2+4H++2Cl-eq \(=====,\s\up17(△))Mn2++Cl2↑+2H2O。(2)该反应中一半HCl作还原剂,一半HCl作酸。(3)当标准状况下有11.2 L氯气生成时,该反应转移的电子数为NA。(4)n(MnO2)=eq \f(1.74 g,87 g·ml-1)=0.02 ml,n(HCl)=12 ml·L-1×0.1 L=1.2 ml。反应中被氧化的n(HCl)=n(MnO2)×2=0.04 ml,反应后溶液中n(Cl-)=1.2 ml-0.04 ml=1.16 ml,加入足量的AgNO3溶液生成1.16 ml AgCl,m(AgCl)=1.16 ml×143.5 g·ml-1=166.46 g。
化学必修 第一册第三节 物质的量当堂检测题: 这是一份化学必修 第一册第三节 物质的量当堂检测题,共7页。
2021学年第三节 物质的量练习题: 这是一份2021学年第三节 物质的量练习题,共7页。试卷主要包含了下列关于金属的叙述中正确的是等内容,欢迎下载使用。
高中化学人教版 (2019)必修 第一册第三节 物质的量同步训练题: 这是一份高中化学人教版 (2019)必修 第一册第三节 物质的量同步训练题,共6页。













