

初中化学第十一单元 盐 化肥综合与测试巩固练习
展开一、单选题(每小题只有一个正确答案)
1.某工厂排放的废水的PH=3,且含有有毒的Cu2+,为治理此废水,回收金属Cu,并将其PH调节至7.5﹣8.其经济可行的方案,是向此废水中加入( )
A.Fe B.Ca(OH)2和Fe C.NaOH和Fe D.H2O和Fe
2.下列除去杂质的试剂和方法可行的是( )
3.下列各组变化中,每个转化在一定条件下均能一步实现的是( )
A.①④ B.①②④ C.①③④ D.①②③④
4.将下列各组物质同时加入到足量水中,最终能得到无色、透明溶液的是( )
A.BaCl2、NaOH、H2SO4 B.KNO3、NaCl、CuSO4
C.HCl、Na2CO3、K2SO4 D.KMnO4、Na2SO4、KCl
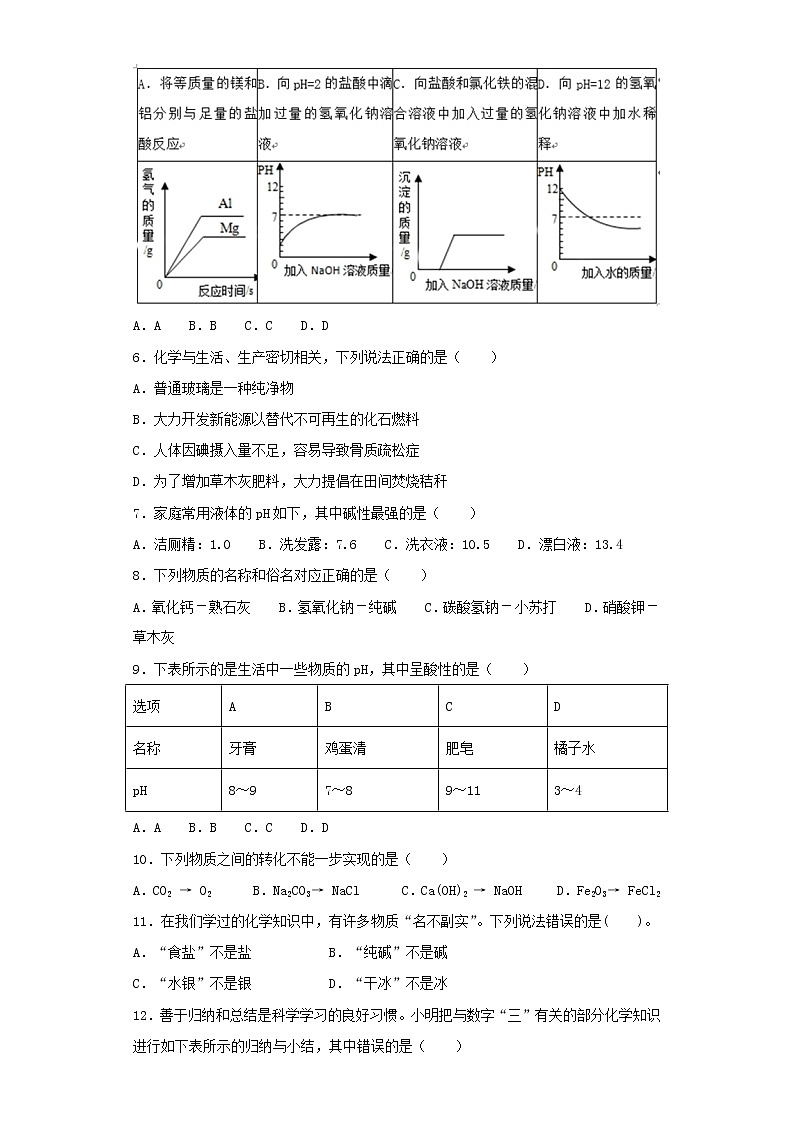
5.下列实验对应的图象正确的是( )
A.A B.B C.C D.D
6.化学与生活、生产密切相关,下列说法正确的是( )
A.普通玻璃是一种纯净物
B.大力开发新能源以替代不可再生的化石燃料
C.人体因碘摄入量不足,容易导致骨质疏松症
D.为了增加草木灰肥料,大力提倡在田间焚烧秸秆
7.家庭常用液体的pH如下,其中碱性最强的是( )
A.洁厕精:1.0 B.洗发露:7.6 C.洗衣液:10.5 D.漂白液:13.4
8.下列物质的名称和俗名对应正确的是( )
A.氧化钙-熟石灰 B.氢氧化钠-纯碱 C.碳酸氢钠-小苏打 D.硝酸钾-草木灰
9.下表所示的是生活中一些物质的pH,其中呈酸性的是( )
A.A B.B C.C D.D
10.下列物质之间的转化不能一步实现的是( )
A.CO2 → O2 B.Na2CO3→ NaCl C.Ca(OH)2 → NaOH D.Fe2O3→ FeCl2
11.在我们学过的化学知识中,有许多物质“名不副实”。下列说法错误的是( )。
A.“食盐”不是盐 B.“纯碱”不是碱
C.“水银”不是银 D.“干冰”不是冰
12.善于归纳和总结是科学学习的良好习惯。小明把与数字“三”有关的部分化学知识进行如下表所示的归纳与小结,其中错误的是( )
二、填空题
13.厨房中有许多与化学知识有关的问题,是家庭中的实验室(如图),试回答:
(1)写出厨房中每天必用的调味品的化学式为______________;
(2)用合成材料作厨房抹布,其优点是__________________________________;
(3)厨房中的不粘锅内衬膜一般是(写化学名称)___________;推测该物质可能具有的两点性质是___________________________;
(4)在家中,胃酸病发作可用厨房中的小苏打进行缓解,反应的化学方程式为_____________________________,但胃溃疡不要用小苏打,总服用以免加快胃穿孔,原因是_________________________________________。
14.稀盐酸与碳酸氢钠反应(小苏打治疗胃酸过多症):__________________
15.请参与某学习小组进行的化学魔术的过程,并协助完成相关任务:
(查阅资料)氯化钠、氯化钙溶液呈中性。
(魔术药品)氢氧化钠稀溶液、稀盐酸
(魔术表演)在玻璃杯内放入滴有酚酞溶液的蒸馏水,加入无色溶液A后,溶液呈现红色;。再将一枚鸡蛋放入溶液中,观察到鸡蛋慢慢沉到杯底同时在蛋壳表面出现气泡,一会儿又慢慢上浮,当接近液面时又下沉,如此反复。充分反应后,取出这枚鸡蛋,又将另一枚鸡蛋放入其中,观察到鸡蛋直接沉到杯底。(如图所示)。
(1)写出无色溶液A中溶质的化学式为 ;加入无色溶液B后,溶液呈无色,除酚酞外,此时溶液中一定含有的溶质的化学式为 ;
(2)鸡蛋壳的主要成分是碳酸钙。鸡蛋壳表面产生的气体的化学方程式 ;
(3)魔术表演结束后,玻璃杯中废液除酚酞和水外,废液中含有 。
16.已知A、B、C、D、E五种物质中都含有人体含量最多的一种金属元素,其中A是单质,B、C含有两种元素,D、E含有三种元素,反应⑤是放热反应,它们之间的转化关系如图所示,下列推理不正确的是
A、反应⑤是化合反应
B.反应④一定是中和反应
C.反应③可以由多个化学反应实现
D.反应②为吸热反应
三、推断题
17.几种常见物质之间的相互转化关系如图所示(每个字母各代表一种物质,每个箭号各表示一个化学反应,部分反应物、生成物及反应条件略去).已知五种物质均由C、H、O中部分元素组成,A和B所含元素相同,D和E所含元素相同,X为单质,A为有毒气体,B和D可以发生化合反应。
①A的名称是_____
②B的一种用途是_______________________________________。
③写出X→D转化的化学方程式:_________________________。
④实现A→B转化的化学反应类型________(填“一定”或“不一定”)属于化合反应。
18.A~F均为初中化学中常见的物质,且均含一种地壳中含量最多的元素,其中A是单质;B、C均为液体,且组成元素相同;E是引起温室效应的主要物质;反应①中出现火星四射现象;反应②会放出大量的热.其物质间的转化关系如图所示,图中“--”表示两端的物质能发生化学反应;“→”表示物质间存在转化关系,其余反应条件、部分反应物和生成均已略去。
(1)写出E的化学式_________,A物质的主要用途是___________;
(2)写出反应①的化学方程式_______________,生成物F是_______色固体;
(3)写出反应②的化学方程式_______________;
(4)写出方法③的化学方程式________________基本反应类型为_____________.
四、实验题
19.我国海洋资源十分丰富.从海水中提取氯化钠并以氯化钠和水为原料制取氢氧化钠、氯气等物质的工艺流程图如下:
某兴趣小组进行如下实验:
【实验一】除去粗盐中的不溶性杂质
步骤一:用托盘天平称取5.0g粗盐,用药匙将该粗盐逐渐加入盛10mL水的烧杯中,边加边用玻璃棒搅拌,一直加到粗盐不再溶解为止.称量剩下的粗盐质量为1.4g
步骤二:经过过滤、蒸发,得到3.2g精盐.
(1)计算精盐的产率 (保留一位小数).
(2)该小组测得的产率偏低,可能的原因是 .
A.溶解时未充分搅拌
B.蒸发时水分未蒸干
C.蒸发时盐粒溅出蒸发皿
(3)步骤一、二的部分操作如图所示,其中错误的是 (填字母序号).
【实验二】探究工艺流程图步骤Ⅱ所得的氯化钠溶液中MgCl2是否除尽,溶液中是否含有CaCl2
[查阅资料]有关物质的溶解性表(20℃)
[进行实验]请你与他们共同完成,并回答所给的问题:
[拓展思维]
(1)工艺流程图步骤Ⅰ从海水中得到粗盐,采用风吹日晒蒸发溶剂的方法,而不是采用降低溶液温度的方法,原因是 .
(2)写出工艺流程图步骤Ⅳ的化学方程式 .
20.有一瓶未知浓度的氢氧化钠溶液,同学们想用10%的稀盐酸来测定其溶质的质量分数。以下是两组同学的设想及做法:
①甲组同学的实验如下图所示:在烧杯中加入5g氢氧化钠溶液,滴入2滴酚酞溶液,用滴管慢慢滴入10%的稀盐酸,并不断搅拌,至溶液颜色恰好变为无色为止。
请回答:
酚酞溶液的作用是 ⑿ 边滴加稀盐酸,边要用玻璃棒不断搅拌的目的是 ⒀ 。
当溶液颜色恰好变为无色时,共用去了稀盐酸14.6g,则甲组这瓶氢氧化钠溶液中溶质的质量分数为
⒁ (写出计算过程,结果用百分数表示)。
②乙组同学的设想是:在烧杯中加入一定量的氢氧化钠溶液,用滴管慢慢滴入10%的稀盐酸,并不断搅拌,通过用pH试纸多次测定溶液pH的办法,达到实验目的。
下列使用pH试纸的方法正确的是 ⒂ (填字母)。
A.将pH试纸剪成几段节约使用
B.将pH试纸直接插入待测液中
C.将pH试纸放在干净的表面皿上,用玻璃棒蘸取待测液滴在pH试纸上
D.将pH试纸润湿后放在干净的表面皿上,用玻璃棒蘸取待测液滴在pH试纸上
在滴加稀盐酸一段时间后,发现溶液中有少量气泡产生。他们通过进一步实验证明:该组用的这瓶氢氧化钠溶液已经部分变质。请你根据他们的实验步骤写出实验现象:
若要除去溶液中变质生成的杂质,请简要写出实验方案 ⒄ 。
五、计算题
21.某碳酸钠样品中含有少量氯化钠。现取一定量该样品,加水配制成80g溶液,再加入80g氯化钙溶液,恰好完全反应,过滤后得到溶质质量分数为10%的滤液150g。求:
(1)生成沉淀的质量为_____g;
(2)原样品中氯化钠的质量_________。
22.张南和化学兴趣小组的同学从内蒙古伊盟地区的天然碱湖带来一种“碱”样品(含 有碳酸钠、氯化钠和泥沙)。为测定这种样品(样品中的泥沙不参加反应,也不溶于水)中 碳酸钠的含量,并得到纯净的一定浓度的氯化钠溶液。进行了如下实验:
请回答下列问题:
(1)写出发生反应的化学方程式____________;
(2)根据已知条件列出求解反应中生成氯化钠的质量(X)的比例式_______;
(3)该“碱”样品中碳酸钠的含量为_______;
(4)若最终得到的滤液为不饱和溶液,则所得滤液中溶质的质量分数为______;
(5)若用36.5%的浓盐酸配制上述实验所用的稀盐酸,需浓盐酸的质量为________。
选项
物质(括号内为杂质)
除杂试剂和方法
A
Mg(NO3)2溶液(AgNO3)
加入过量铁粉,过滤
B
NaCl溶液(Na2SO4)
加入适量BaCl2溶液,过滤
C
CO2(CO)
通过足量澄清石灰水
D
N2(O2)
通过灼热的氧化铜
选项
A
B
C
D
名称
牙膏
鸡蛋清
肥皂
橘子水
pH
8~9
7~8
9~11
3~4
知识内容
小结
A
农业常用三种化肥
氮肥、钾肥、磷肥
B
空气中常见的三种有害气体
一氧化碳、二氧化碳和二氧化硫
C
自然界的三种化石燃料
煤、石油和天然气
D
生活中用得最多的三种有机合成材料
合成纤维、塑料和合成橡胶
阴离子
阳离子
OH﹣
Ca2+
微
不
Mg2+
不
微
实验步骤
实验现象
实验结论
步骤一:取一定量的氯化钠溶液于试管中,加入适量的NaOH溶液
无明显现象
说明MgCl2 (填“已”或“未”)除尽
步骤二:往步骤一所得溶液中加入适量的 溶液
产生白色沉淀
说明溶液中含有CaCl2
实验步骤
现 象
结 论
取少量NaOH溶液样品于试管中,先滴加足量的CaCl2溶液,然后再滴加酚酞试液。
⒃
NaOH溶液部分变质
参考答案
1.B
【解析】A、加入铁可以与铜离子反应生成铜从而回收铜,同样铁可以和酸反应降低溶液的酸性,但不能将溶液的PH调节至7.5﹣8,从经济方面考虑也不可行,故A错误;
B、加入石灰水能与酸反应从而降低废水的酸性,铁排在铜的前面,能与硫酸铜反应回收铜,故B正确;
C、加入烧碱能与酸反应从而降低废水的酸性,铁排在铜的前面,能与硫酸铜反应回收铜,但是氢氧化钠的价格比较高,从经济方面考虑不可行,故C错误;
D、加入铁可以与铜离子反应生成铜从而回收铜,加入水降低废水的酸性,但不能将溶液的pH调节至7.5﹣8,故D错误.
故选:B.
2. B
【解析】试题分析:A、铁粉与硝酸银反应,生成银和硝酸亚铁,引来新的杂质,错误;B、硫酸钠与适量氯化钡反应,生成硫酸钡和氯化钠,正确;C、CO与澄清石灰水不发生反应,错误;D、氧化铜与氧气不发生化学反应,错误。故选B
考点:除杂质问题。
3.A
【解析】①2Cu+O2 △2CuO,CuO+H2SO4= CuSO4+H2O ,Fe+CuSO4=FeSO4+Cu,正确;②Fe+H2SO4==FeSO4+H2↑,FeSO4不能发生反应生成Fe (OH)3,错误;③2NaOH+CuCl2= 2NaCl+ Cu(OH)2↓ ,NaCl不能发生反应生成Na2CO3,错误;④CaCO3+ 2HCl==CaCl2+ H2O + CO2↑, CO2+2NaOH=Na2CO3+H2O,Na2CO3+ CaCl2= CaCO3↓+2 NaCl,正确。故选A。
【点睛】熟知物质之间的转化关系。
4.C
【解析】
试题分析:物质加到水中得到无色澄清溶液,说明彼此之间不能生成沉淀,且不存在有色离子. A、BaCl2和H2SO4生成硫酸钡沉淀,溶液变浑浊,故选项错误. B、CuSO4溶液有颜色,故选项错误. C、三者之间不反应,符合无色透明的要求,故选项正确. D、三者之间不反应,但高锰酸钾溶于水呈紫黑色,故选项错误.故选C.
考点:物质的共存
5.C
【解析】
A、等质量的镁和铝分别与足量的盐酸反应,铝生成的氢气质量大于镁,在金属活动性顺序中,镁在铝的前面,与酸反应的速率比铝快,在坐标中,斜线越陡,反应的速率越快,故A错误;
B、向pH=2的盐酸中滴加过量的氢氧化钠溶液,氢氧化钠的pH大于7,最后溶液的pH会大于7,故B错误;
C、盐酸能与氢氧化钠反应生成氯化钠和水,氯化铁能与氢氧化钠反应生成氢氧化铁沉淀和氯化钠,生成的氢氧化铁沉淀能与盐酸反应生成氯化铁和水,所以一开始时盐酸与氢氧化钠反应,无沉淀生成,当盐酸消耗尽,氯化铁与氢氧化钠反应生成氢氧化铁沉淀,故C正确;
D、氢氧化钠的pH大于7,加水稀释其pH变小,但不会小于等于7,故D错误.
故选C.
【点评】本题考查了常见物质间的反应以及溶液稀释pH变化的有关知识,完成此题,可以依据已有的知识结合反应的实验现象进行.
6. B
【解析】
试题分析:A选项普通玻璃是一种纯净物是错误的叙述,属于混合物;B选项大力开发新能源以替代不可再生的化石燃料是正确的叙述;C选项是错误的叙述,人体因钙元素摄入量不足,容易导致骨质疏松症;D选项为了增加草木灰肥料,大力提倡在田间焚烧秸秆是错误的叙述,这样污染空气,故答案选择B
考点:化学与生活、生产
7.D
【解析】
溶液的pH小于7,溶液呈酸性,pH越小,酸性越强;溶液的pH大于7,溶液呈碱性性,pH越大碱性越强;pH等于7,溶液呈中性。上述物质中漂白液的pH最大,溶液的减小最强。
8.C
【解析】A氧化钙是生石灰,熟石灰是氢氧化钙,错误;B、氢氧化钠俗称烧碱、火碱、苛性钠,纯碱是碳酸钠,错误;C碳酸氢钠俗称小苏打,正确;D、草木灰的主要成分是碳酸钾,错误。故选C。
点睛:生石灰是氧化钙,熟石灰和消石灰是氢氧化钙;苏打是碳酸钠,小苏打是碳酸氢钠 。
9.D
【解析】牙膏、鸡蛋清、肥皂等物质的pH大于7,显碱性;橘子水的pH小于7,显酸性。故选D。
10.D
【解析】
试题分析:A、CO2 → O2,可以通过植物的光合作用一步实现,正确,B、Na2CO3→ NaCl可以通过Na2CO3与盐酸或氯化钙溶液反应一步实现,正确,C、Ca(OH)2→ NaOH可以通过Ca(OH)2与Na2CO3溶液反应一步实现,正确,D、Fe2O3与盐酸反应得到FeCl3,故Fe2O3→ FeCl2不能一步实现,错误,故选D
考点:物质的转化
11.A
【解析】
试题分析:A、“食盐”是氯化钠,是属于盐,错误, B、“纯碱”是碳酸钠,不是碱,正确,C、“水银”是金属汞,不是银,正确,D、“干冰”是固态二氧化碳,不是冰,正确,故选A
考点:物质的成分
12.B
【解析】A、农业上常用的三种化肥是氮肥、钾肥、磷肥; 正确;
B、空气中常见的三种有害气体是一氧化碳、二氧化氮和二氧化硫,二氧化碳不是有毒气体,能形成温室效应;不正确;
C、自然界的三种化石燃料是:煤、石油和天然气; 正确;
D、生活中用得最多的三种有机合成材料是:合成纤维、塑料和合成橡胶. 正确.
故选B
13.(1) NaCl;(2)耐磨,耐化学腐蚀,[没答强度高也给分] ;
(3) 聚四氟乙烯;不溶于水,无毒(答:不溶于油,熔点较高,与金属有很强的附着力均给分);(4)NaHCO3+HCl===NaCl+H2O+CO2↑;在胃内发生的上述反应,产生气体增多(1分),胃内压强增大(1分),易通破创面(答出要点:产生气体,压强增大即给分)
【解析】
试题分析:(1) 厨房中每天必用的调味品为氯化钠,化学式为:NaCl
(2)用合成材料作厨房抹布,属于合成纤维,其优点是耐磨,耐化学腐蚀
(3) 厨房中的不粘锅内衬膜一般是:聚四氟乙烯;该物质可能具有的两点性质是:不溶于水,无毒(或不溶于油,熔点较高,与金属有很强的附着力)
(4)胃酸病发作可用厨房中的小苏打进行缓解,反应化学方程式:NaHCO3+HCl=NaCl+H2O+CO2↑
但胃溃疡不要用小苏打,总服用以免加快胃穿孔,原因是:在胃内发生的上述反应,产生气体增多,胃内压强增大,易通破创面
考点:常见盐的性质及用途,有机合成材料
14.HCl+NaHCO3===NaCl+H2O+CO2↑_
【解析】稀盐酸与碳酸氢钠反应生成氯化钠、水和二氧化碳,反应方程式为:HCl+NaHCO3===NaCl+H2O+CO2↑
15.(1) NaOH; NaCl、HCl(有错或漏一个不得分)
(2) CaCO3+2HCl = CaCl2+H2O+CO2↑
(3)NaCl、CaCl2(有错或漏一个不得分)
【解析】
试题分析:(1)滴有酚酞溶液的蒸馏水,加入无色溶液A后,溶液呈现红色,说明A呈碱性,为氢氧化钠;再慢慢加入无色溶液B,溶液最终变为无色,则溶液可以是恰好中和呈中性,或盐酸过量呈酸性,可确定一定有中和反应生成的氯化钠,再将一枚鸡蛋放入溶液中,观察到鸡蛋慢慢沉到杯底同时在蛋壳表面出现气泡,说明还含有氯化氢;(2)即碳酸钙和盐酸的反应;(3)原本的氯化钠和氯化氢,其中氯化氢和碳酸钙反应生成氯化钙,那么废液中含有氯化钠和氯化钙。
考点:酸碱盐的性质
16.B
【解析】
试题分析:人体含有最多的金属元素是钙元素,B、C含有两种元素,D、E含有三种元素,反应⑤是放热反应,那么B是氧化钙,氧化钙与水反应生成氢氧化钙,即D是氢氧化钙,E是碳酸钙,碳酸钙分解生成氧化钙和二氧化碳。氢氧化钙与氯化铜反应生成氢氧化铜沉淀和氯化钙,氯化钙含有两种元素,故反应4不一定是中和反应。故选B。
考点:物质的推断
17.一氧化碳 灭火、制汽水、作气体肥料、人工降雨等,任填一种即可 2H2+O2点燃2H2O 不一定
【解析】
【分析】
据题中信息和已有的知识,A为有毒气体,且由C、H、O中的部分元素组成,推测A为一氧化碳,A和B所含元素相同,故B为二氧化碳,D和E所含元素相同,均由C、H、O中部分元素组成,B和D可以发生化合反应,故猜测D可能为水,E为过氧化氢,X为单质,并且过氧化氢反应可以生成单质X,推断X是氧气。故A是一氧化碳,B是二氧化碳,D是水,E是过氧化氢,X是氧气。带入图示和已知信息,推断正确。
【详解】
①由推测可知A的名称是一氧化碳;
② B是二氧化碳,其用途有:灭火、制汽水、作气体肥料、人工降雨等,任填一种即可;
③X→D转化就是氧气到水的转化,即氧气与氢气反应生成水,2H2+O2点燃2H2O;
④A→B转化是一氧化碳到二氧化碳的转化,可以利用一氧化碳与氧气化合,也可利用一氧化碳与金属氧化物的反应得到二氧化碳,所以不一定属于化合反应。
18.CO2 供给呼吸 3Fe+2O2点燃Fe3O4 黑 CaO+H2O==Ca(OH)2 2H2O2MnO22H2O+O2↑ 分解反应
【解析】
【分析】
推断题要注意找突破口,可以从典型物质、典型现象、典型组成、典型反应等方面寻找,也可以从特征用途、元素或物质之最、反应基本类型、反应条件等方面寻找。
【详解】
(1)都含有地壳中含量最多的元素氧,且A是单质,E是引起温室效应的主要物质,由此可知A是氧气,能供给呼吸,E是二氧化碳,故填CO2和供给呼吸;
(2)根据“火星四射”可知F是四氧化三铁,那么①的转化就是铁在氧气中燃烧生成四氧化三铁,故填3Fe+2O2Fe3O4和黑色;
(3)含有氧元素的液体常见的有水和过氧化氢,水通电分解可以得到氧气,氢气在氧气中燃烧又可以生成水,A和C之间可以相互转化,可知C是水, B就是过氧化氢,能和二氧化碳发生反应的物质有水和可溶性碱,所以D应当是可溶性的碱,且这种碱是由水和物质反应得到的,符合条件的只有氧化钙和水反应生成的氢氧化钙,则D是氢氧化钙,故填CaO+H2O=Ca(OH)2;
(4)由上分析可知③发生的是过氧化氢分解生成水和氧气,属于分解反应,故填2H2O22H2O+O2↑。
19.【实验一】(1)88.9% (2)AC (3)B
【实验二】步骤一:已; 步骤二:碳酸钠
(1)氯化钠的溶解度受温度变化影响很小.
(2)2NaCl+2H2O==2NaOH+H2↑+Cl2↑.
20.⑿ 判断反应是否恰好完成(或证明两者发生了反应等)
⒀ 使反应物充分接触,完全反应
⒁ 32%
⒂ A C
⒃ 产生白色沉淀,酚酞变红
⒄ 加入适量Ba(OH)2溶液【或Ca(OH)2溶液】恰好反应(或刚好不再产生沉淀),过滤。
【解析】
试题分析:①酚酞溶液为酸碱指示剂,所以判断反应是否恰好完成(或证明两者发生了反应等);边要用玻璃棒不断搅拌的目的是使反应物充分接触,完全反应;当溶液颜色恰好变为无色时,共用去了稀盐酸14.6g,则甲组这瓶氢氧化钠溶液中溶质的质量分数
解:HCl物质的量:14.6g×10%÷36.5=0.04ml……(1分)
设氢氧化钠为x ml
NaOH + HCl → NaCl + H2O (1分)
1 1
x 0.04ml
1:1=x:0.04ml
x=0.04ml (比例式和答案共1分)
0.04×40÷5×100%=32% (1分)
答:略
②乙组:下列使用pH试纸的方法正确的是A.将pH试纸剪成几段节约使用;C.将pH试纸放在干净的表面皿上,用玻璃棒蘸取待测液滴在pH试纸上;该组用的这瓶氢氧化钠溶液已经部分变质。产生白色沉淀,酚酞变红证明已部分变质;若要除去溶液中变质生成的杂质,必须出去碳酸根离子,但不能引进新杂质,故加入适量Ba(OH)2溶液【或Ca(OH)2溶液】恰好反应(或刚好不再产生沉淀),过滤。即可。
考点:氢氧化钠的性质、根据化学方程式的计算、除杂、实验方案评价
21. 10 3.3g
【解析】
【分析】
本题考查了根据化学方程式的计算,通过质量守恒求出生成沉淀的质量是解题的基础。
【详解】
(1)生成沉淀的质量为:80g+80g﹣150g=10g;
(2)设:生成氯化钠的质量为x
Na2CO3+CaCl2═CaCO3↓+2NaCl
100 117
10g x
100117=10gx
x=11.7g
原样品中氯化钠的质量为:150g×10%﹣11.7g=3.3g。
22.Na2CO3+2HCl=2NaCl+H2O+CO2↑ 117x=444.4g 53% 6.7% 20g
【解析】
【详解】
生成二氧化碳的质量=20g+100g-115.6g=4.4g;
设反应生成氯化钠的质量为x,样品中碳酸钠的质量为y,消耗盐酸的质量为m。
106y=73m=117x=444.4g
x=11.7g
y=10.6g
m=7.3g
(1)碳酸钠与稀盐酸反应生成氯化钠、水和二氧化碳,反应的化学方程式为:Na2CO3+2HCl=2NaCl+H2O+CO2↑;
(2)列出求解反应中生成氯化钠的质量(x)的比例式为:117x=444.4g;
(3)该“碱”样品中碳酸钠的含量为:10.6g20g×100%=53%;
(4)反应后溶液中氯化钠的质量=11.7g+(20g-10.6g-1g)=20.1g。若最终得到的滤液为不饱和溶液,则所得滤液中溶质的质量分数为:+185.4g×100%=6.7%;
(5)设需要36.5%的浓盐酸的质量为A,36.5%×A=7.3,A=20g。故需浓盐酸的质量为20g。
人教版九年级下册第十一单元 盐 化肥综合与测试精练: 这是一份人教版九年级下册第十一单元 盐 化肥综合与测试精练,共11页。试卷主要包含了5 Ca—40,B 3等内容,欢迎下载使用。
初中人教版第十一单元 盐 化肥综合与测试课后练习题: 这是一份初中人教版第十一单元 盐 化肥综合与测试课后练习题,共7页。试卷主要包含了单选题,填空题,计算题,石灰石等内容,欢迎下载使用。
初中第十一单元 盐 化肥综合与测试同步测试题: 这是一份初中第十一单元 盐 化肥综合与测试同步测试题,共16页。试卷主要包含了单选题,填空题,简答题等内容,欢迎下载使用。













