






人教版九年级下册第九单元 溶液课题2 溶解度授课ppt课件
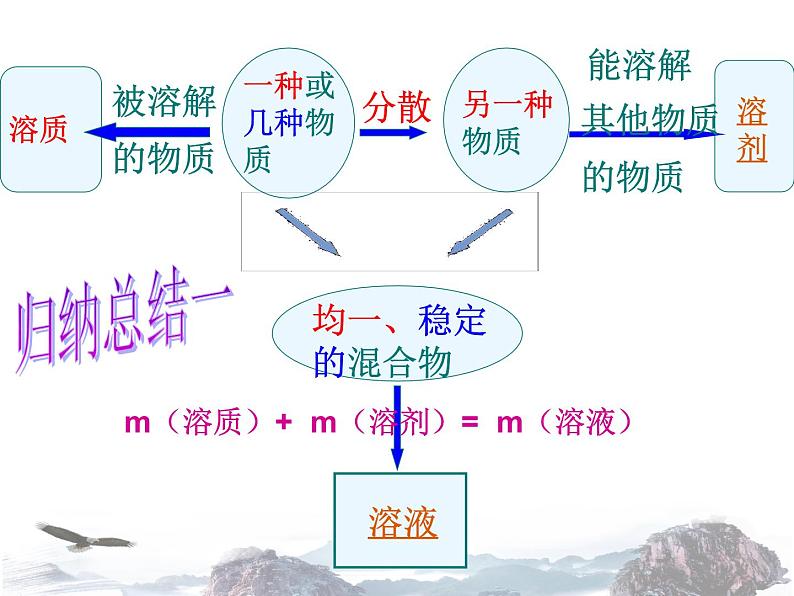
展开m(溶质)+ m(溶剂)= m(溶液)
多-溶剂 少-溶质
3、根据名称判断:溶质的溶剂的溶液 (若溶剂为水可省略不读)
洗涤剂的去污原理是: 将油污分散成无数小液滴,然后随水流走。 (这种现象称为洗涤剂的乳化作用。)
汽油去油污的原理是: 油污溶解在汽油中,形成溶液,从而除去油污.
扩散过程=水合过程:吸热=放热 温度变化不明显 扩散过程>水合过程:吸热>放热 温度降低扩散过程<水合过程:吸热<放热 温度升高
【思考一】通过上一节课的学习,同学们已经感受到,一种物质能否溶解在另一中物质里,与这两种物质的性质有关。那么,像食盐和蔗糖这样能够溶于水的物质,是不是可以无限量地溶解在一定量的水中呢?
【实验9-5】在室温下,向盛有20mL水的烧杯中加入5g氯化钠,搅拌;等溶解后,再加5g氯化钠,搅拌,观察现象。然后再加入15mL水,搅拌,观察现象。
【结论】物质不能无限量地溶解在一定量的水中。水的量增多,溶解的物质也增多。
20mL水能完全溶解5g氯化钠
20mL水不能完全溶解10g氯化钠
增加溶剂的量,可将未溶解物质溶解
【实验9-6】在室温下,向盛有20mL水的烧杯中加入5g硝酸钾,搅拌;等溶解后,再加5g硝酸钾,搅拌,观察现象。当烧杯中硝酸钾固体有剩余而不再继续溶解时,加热烧杯一段时间,观察剩余固体有什么变化。然后再加入5g硝酸钾,搅拌,观察现象。待溶液冷却后,又有什么现象发生?
【思考二】 :升高温度物质能不能无限制地溶解 在一定量水中呢?
20mL水能完全溶解5g硝酸钾
20mL水不能完全溶解10g硝酸钾
温度升高,硝酸钾溶解能力增强
温度降低,硝酸钾溶解能力降低
【结论】温度升高,一定量的水中可以溶解更多的物质; 温度降低,一定量的水中溶解的物质的量减少。
【小结】溶剂中溶解溶质的多少与溶剂的量和温度有关。
一.饱和溶液与不饱和溶液
在一定温度下,向一定量溶剂里加入某种溶质,当溶质不能继续溶解时所得到的溶液叫做这种溶质饱和溶液
1、什么叫饱和溶液、不饱和溶液
在一定温度下,向一定量溶剂里加入某种溶质,当溶质还能继续溶解时所得到的溶液叫做这种溶质不饱和溶液
如何判断一种溶液是否饱和呢?
①有未溶解的溶质,且固体溶质不再溶解。
②没有未溶解的溶质,再加少量的溶质,不能再 溶解的是饱和溶液
例如:如何判断某一蔗糖溶液是否饱和?
取少量蔗糖溶液,加入少量蔗糖,若溶解,则说明原溶液不饱和;若不溶解则说明原溶液是饱和溶液。
想一想,做一做1、为什么必须说明是“这种溶质”的饱和溶液?(即为什么必须指明溶质是什么?)
1.硝酸钾的饱和溶液中还能继续溶解高锰酸钾
剩余的氯化钠晶体继续溶解最后消失
增加溶质的量,能使不饱和溶液变成饱和溶液
想一想,做一做 2、我们再说某溶液是饱和溶液,还是不饱和溶液时,为什么总要强调“一定温度下,一定量的溶剂里,”这两个条件?
增加溶剂的量,能使饱和溶液变成不饱和溶液
升高温度能使饱和溶液变成不饱和溶液。降低温度能使不饱和溶液变成饱和溶液。
饱和溶液:在一定温度下,向一定质量溶剂里加入某种溶质,当溶质不能够继续溶解时,所得到的溶液叫做这种溶质的饱和溶液.
不饱和溶液:在一定温度下,向一定质量溶剂里加入某种溶质,当溶质还能够继续溶解时,所得到的溶液叫做这种溶质的不饱和溶液.
2、不饱和溶液与饱和溶液的转化关系及结晶的方法:
增加溶质、蒸发溶剂或降低温度
(2)最可靠的方法是:加溶质、蒸发溶剂
①溶解在溶液里的溶质以晶体的形式析出过程,叫做结晶。
冷却后硝酸钾晶体从溶液中析出
① 降温结晶(即:冷却热饱和溶液结晶)
②固体溶质 溶液里的溶质
注意:没溶解的溶质不能计算在溶液中
指出下列各题的错误之处,并加以改正:1.不能再溶解某种溶质的溶液叫饱和溶液。2.装有饱和溶液的瓶子的瓶底,一定有这种溶质的固体。 3.使一接近饱和的溶液变成饱和溶液,可将其中的溶 剂倒出一些。 4.在同一温度下,同体积的某物质的饱和溶液,一定 会比另一物质的不饱和溶液含有的溶质多。
在一定温度.一定量的溶剂中,不能…….
不一定,有可能刚好达到饱和.
不一定,这两种物质的溶解能力有可能不同.
1.1000C硝酸钾饱和溶液冷却至300C,滤去晶体后,所得溶液是________溶液(饱和、不饱和)。 2.把600C时的氯化铵饱和溶液冷却到100C,有氯化铵晶体析出,剩余溶液是:( ) A.浓溶液 B.稀溶液 C.饱和溶液 D.不饱和溶液 3.200C时,要使硝酸钾不饱和溶液,变为饱和溶液,可采取下列措施中的:( ) A.温度升高至600C B.加入硝酸钾 C.加入水 D.加入200C硝酸钾饱和溶液
4、A、B、C、D四个烧杯里分别盛有质量相等的同种溶剂,向四个烧杯加入某溶质,且固体溶质质量依次减少(温度相同),充分溶解,(如下图所示)回答下列各问(填序号)(1)_____________中盛的一定是饱和溶液;(2)_____________中盛的可能是饱和溶液;(3)_____________中盛的一定是不饱和溶液;
1、溶解性(1)定义:一种物质溶解在另一种物质的能力。
(2)溶解性与溶质和溶剂的性质有关、还与温度有关。(3)如何比较两种物质的溶解能力大小?
20克水能溶解1克氯化钠也能溶解1克硝酸钾,这可以说明氯化钠、硝酸钾的溶解性相同吗?
定温度定溶剂的量定状态(达到饱和)
比较不同物质的溶解力,应该控制的条件有:
【思考】食盐和硝酸钾都可以溶解在水中,那么,到底谁溶得更多呢?
只有在温度确定、溶剂的量也确定的条件下才能作出比较。
【溶解度】在一定温度下,某固态物质在100g溶剂里达到饱和状态时所溶解的质量。
说明:通常所说的溶解度是指物质在水里的溶解度。
1、固体溶解度概念:在一定温度下,某固态物质在100g溶剂里达到饱和状态时所溶解的质量。叫做这种物质在这种溶剂里的溶解度。用符号S表示
如:在20℃时,100g水中溶解36g氯化钠达饱和,我们就说20℃时,氯化钠的溶解度是36g。
又如:60℃时,硝酸钾的溶解度是110克,说明在60℃时,100g水里最多能溶解110g硝酸钾。
2、固体溶解度的四要素:
100克溶剂(一般指水)
课堂练习(一):判断下列说法是否正确:
(1) 20克 A 物质溶解在100克水里恰好制成饱和溶液, A的溶解度是20克。
(2) 20℃时,10克氯化钠溶解在水里制成饱和溶液,故20℃时氯化钠的溶解度是10克。
(3) 20℃时,10克氯化钠可溶解在100克水里,20℃时氯化钠的溶解度是10克。
(4) 20℃时, 100克水最多可溶解36克氯化钠, 则20℃时氯化钠的溶解度为36。
(X) 未指明温度
(X) 未指明100克溶剂
(X) 没有单位:克
(5) 20℃时, NaCl的溶解度为36g.在20℃时,将40gNaCl固体,放入100g水中,充分搅动,只溶解了36g.
例:氯化钠在20℃是的溶解度是 36g。
③20℃时,100g水中溶解36g氯化钠,溶液达到饱和
3、固体溶解度的意义:
④20℃时,100g水中最多可溶解36g氯化钠。
M质=36g, m剂=100g , m液=136g;② m质:m剂:m液 = 36:100: 136
⑤ 20℃时,将136g饱和氯化钠溶液蒸干,得36g 氯化钠
⑥ 20℃时,136g饱和氯化钠溶液中,含氯化钠36g,水100g.
1、在20℃时,100g水中溶解36g氯化钠溶液达到饱和,则20 ℃时氯化钠溶解度是____g。
2、在0℃时,100g水中最多可溶解13.3g硝酸钾,则0℃时硝酸钾溶解度是____g。
3、20℃时硝酸钾的溶解度是31.6g,这句话的含义是什么?将其关系代入下表:
4、 20℃时,氯化钠溶解度是36g, 20℃时,在50g水中,加入30g氯化钠固体,充分搅动,得氯化钠饱和溶液 g
2、溶解度与溶解性的关系
常见物质溶解性表P114---附录1
【思考】理解了溶解度的概念,那你了解平时所说的“易溶”“难溶”与溶解度的关系吗?
注:溶解度是衡量物质溶解性的尺度。
【例2】①不溶物就是绝对不溶的物质。这句话是否正确? ②20℃时碳酸钙的溶解度是0.0013克,所以碳酸钙是___物质。③20℃时食盐的溶解度是36克,所以食盐属于__ 物质。
不正确。通常所说的不溶物即难溶物,溶解度<0.01g。实际上没有绝对不溶的物质。
5、影响固体溶解度的因素:
溶解度与溶质,溶剂的质量无关
6、固体溶解度的表示方法:
硝酸钾在不同温度时的溶解度:
想一想: 固体溶解度受什么因素的影响以及如何表示
用实验的方法可以测出在不同温度时的溶解度—表9-1
【思考】P36的列表法所表示溶解度还不是很直观,不能表示某物质在任意温度溶解度,也不能直观表示某物质溶解度随温度变化的趋向。能否寻找另一种表示方法?
0 10 20 30 40 50 60
8070605040302010
(2)图像法--溶解度曲线
活动与探究(绘制溶解度曲线)P36
用纵坐标表示溶解度,用横坐标表示温度.
通过绘制、观察氯化钠溶解度曲线,你得到什么信息?
1、溶解度曲线:物质的溶解度随温度变化的曲线
从这些溶解度曲线图你能获取哪些信息?
利用溶解度曲线,我们可以1、查出某物质在不同温度时的溶解度2、比较不同物质的同一温度时溶解度的大小。3、比较不同物质受温度变化影响的大小。4、看出物质的溶解度随温度变化的规律。
(1)、点:曲线上的点均表示某物质在该温度下的溶解度。
(2)、交点:曲线的交点表示这两种物质在该温度下的溶解度相同。
(3)、曲线:曲线越陡,该物质的溶解度受温度影响越大。
2、溶解度曲线的意义:
(4)、面:曲线下面的各点,表示的溶液不饱和;曲线上面的各点,表示的溶液饱和且底部有未溶解的溶质;
图像上任一点,M剂=100g, M质=纵坐标(线上的点是溶解度,线上方或下方的不是溶解度)
讨论: 固体物质溶解度受温度变化影响情况:
①大多数固体物质溶解度随温度升高而增大,例如 硝酸钾等。 (曲线陡)
②少数固体物质溶解度受温度影响不大,例如食盐。 (曲线平缓);
③极少数固体物质溶解度随温度升高反而减小,例如熟石灰。 (曲线向下)。
(5)、分析溶解度受温度影响的趋势
曲线越陡,溶解度受温度影响越大
(6)、比较几种物质溶解度及溶质质量分数的大小
①在680C时,NaNO3与KNO3的溶解度相等
②温度大于680C时, KNO3的溶解度大于NaNO3
③温度低于680C时,NaNO3的溶解度大于KNO3
如:比较NaNO3与KNO3的溶解度大小
2、在40℃时,硝酸钾的溶解度____ (填大于、小于)硝酸钠的溶解度。
1、在___℃时硝酸钾和硝酸钠的溶解度相同,都约为______。
3、在80℃时氯化钠、氯化钾、氯化铵、硼酸的溶解度由大到小的顺序是_______________________________。
氯化铵、氯化钾、氯化钠、硼酸
在80℃时,将110g硝酸钾加入到100g水中,充分溶解后,形成的溶液为该温度下硝酸钾的____溶液。欲使其刚好形成饱和溶液,可采用的方法有:
若再降温到10℃,会怎样?
会析出89g硝酸钾晶体
在90℃时,将36g氯化钠加入到100g水中,充分溶解后,形成的溶液为该温度下氯化钠的______溶液。欲使其刚好形成饱和溶液,可采用的方法有:
若仅将题中“36g”换成“30g”,会怎样?
适用于溶解度随温度升高而显著增大大的物质。如:KNO3
(又叫冷却热饱和溶液法)
(2)、蒸发溶剂结晶法
适用于溶解度受温度影响小的物质。如:NaCl
适用于溶解度随温度升高而减小的物质。如:熟石灰
硝酸钾溶液中混入少量的氯化钠
氢氧化钙(熟石灰)的溶解度曲线图
【思考】1.打开汽水盖时,汽水会自动喷出来,这说明气体在水中的溶解度与什么有关?2.喝了汽水后,常常会打嗝。这说明气体的溶解度还与什么有关?3.用什么方法确定汽水中溶解的气体是二氧化碳?
温度:温度升高,气体在水中的溶解度减小。
压强:压强减小,气体在水中的溶解度减小。
收集气体,通入澄清石灰水中,看石灰水是否会变浑浊
气体的溶解度:是指在压强为101kPa和一定温度时,气体溶解在1体积水里达饱和状态时的气体体积。
1、概念: 通常讲的气体溶解度是指该气体在压强为101KPa和一定温度时溶解在1体积水里达到饱和状态时的气体体积。
2、气体溶解度的意义:
如:0℃时,氮气的溶解度为0.024
在0℃,氮气压强为101kPa时,1体积水最多能溶解0. 024体积氮气
3、影响气体溶解度的因素:
随压强增大而增大,压强减小而减小。(成正比)
随温度升高而减小,温度降低而增大。(成反比)
[讨论] 天气闷热时,鱼儿为什么总爱在水面上进行呼吸?
气体溶解度一般随压强增大而增大,压强减小而减小。
气体溶解度一般随温度升高而减小,温度降低而增大。
天气闷热,温度升高,气压减小,空气在水中的溶解度随温度升高而减小,随气压减小而减小,水中氧气含量减小;而水面与空气接触,氧气含量相对多些,所以,鱼浮出水面呼吸。
措施:安一个喷水泵,将水喷向空中
同种溶质在不同的溶 剂中的溶解能力不同
不同的溶质在同种溶 剂中的溶解能力不同
易溶 、可溶 、 微溶 、 难(不)溶
影响因素 (温度、压强)
练习:已知200c时,氯化钠在水中的溶解度为36g.在该温度下,如果将10g氯化钠加到20g水中充分搅拌,问得到的溶液质量为多少?
在200c时,20g水中最多能够溶解的氯化钠质量为:
溶液质量为:20g+7.2g =27.2g
答:得到的溶液质量为27.2g
1、加热盛饱和氢氧化钙溶液的试管,会看到 。
有白色固体析出/溶液变浑浊
3、右图分别表示A、B、C三种物质的溶解度曲线,则t20C时,其溶解度由大小的顺序是: A.A、B、C B.B、A、C C.B、C 、A D.C 、A、B
4、如图所示,表示a、b、c为三种固体物质的溶解度曲线,下列说法中不正确的是( ) A. a的溶解度受温度变化影响比c的大 B. 在t2℃时,a的溶解度大于b的溶解度 C. 在t1℃时,a、c的溶解度相等 D. t1℃~t2℃,a的溶解度逐渐变小
5、下图是a、b、c三种物质的溶解度曲线。由图示判断下列说法中不正确的是( ) A.在t1℃时,a的溶解度等于c的溶解度 B. c的溶解度随温度的升高而减小 C. a的饱和溶液从t2℃降温至t1℃时变为不饱和溶液 D.当a中含有少量b时,可以用降温结晶的方法提纯a
6、向一接近饱和的某KNO3溶液中,逐渐加入KNO3固体,图中符合溶液中溶质质量变化规律的是( )
7、下图是甲、乙、丙、丁四种物质的溶解度曲线,温度为t℃时,将等质量甲、乙、丙、丁四种物质分别加到100g水中,充分搅拌后只得到一种饱和溶液,该饱和溶液中的溶质是( ) A.甲 B.乙 C.丙 D.丁
初中化学人教版九年级下册第九单元 溶液课题2 溶解度示范课课件ppt: 这是一份初中化学人教版九年级下册第九单元 溶液课题2 溶解度示范课课件ppt,共24页。PPT课件主要包含了一饱和溶液,实验探究,想一想,溶液是否饱和的判断,概念上,外观上,饱和溶液,不饱和溶液,蒸发结晶,二溶解度等内容,欢迎下载使用。
初中人教版课题2 溶解度背景图课件ppt: 这是一份初中人教版课题2 溶解度背景图课件ppt,共37页。PPT课件主要包含了饱和溶液,浓溶液与稀溶液,不一定,注结晶的方法,蒸发结晶蒸发溶剂,贮水池,蒸发池,结晶池,氯化钠,多种化工原料等内容,欢迎下载使用。
初中化学人教版九年级下册第九单元 溶液课题2 溶解度背景图课件ppt: 这是一份初中化学人教版九年级下册第九单元 溶液课题2 溶解度背景图课件ppt,共60页。PPT课件主要包含了情境引入,你吃“饱”了没,与情绪有关,与体型有关,饱和溶液,饱和溶液和不饱和溶液,课堂练习,饱和溶液的状态,生活小常识,海水晒盐等内容,欢迎下载使用。













