






化学课题 1 质量守恒定律课堂教学课件ppt
展开化学反应前后反应物的质量总和与生成物的质量总和之间有什么关系呢?
生成物的质量总和大于(或等于、小于)反应物的 质量总和。
方案一:红磷燃烧前后质量的测定
实验步骤:1.在底部铺有细沙的锥形瓶中放一小块红磷,按图组装仪器,称量锥形瓶及瓶内物质的总质量,记为m1。2.点燃红磷,观察实验现象。3.反应结束后,冷却到室温,称量锥形瓶及瓶内物质的总质量,记为m2。4.红磷在空气中燃烧,反应物的质量总和跟生成物的质量总和相比较,存在什么关系?
(防止集气瓶底炸裂)
(气球鼓起后瘪掉,气体热胀冷缩。)
(不能,由于气压过大,瓶塞易被冲出)
1.锥形瓶底部为何要铺细砂?
3.气球有何现象?为何有此现象?
4.能否将玻璃管换成玻璃棒,一端不系气球?
2. 将铁钉浸入硫酸铜溶液中,观察实验现象。
3. 称量反应后锥形瓶及锥形瓶内物质的总质量,记为m2。
方案二:铁跟硫酸铜反应
4. 比较反应前后物质总质量的变化,得出结论。
1. 向锥形瓶中加入适量的硫酸铜溶液塞上橡皮塞,将几根铁钉用砂纸打磨干净,称量其质量记为m1。
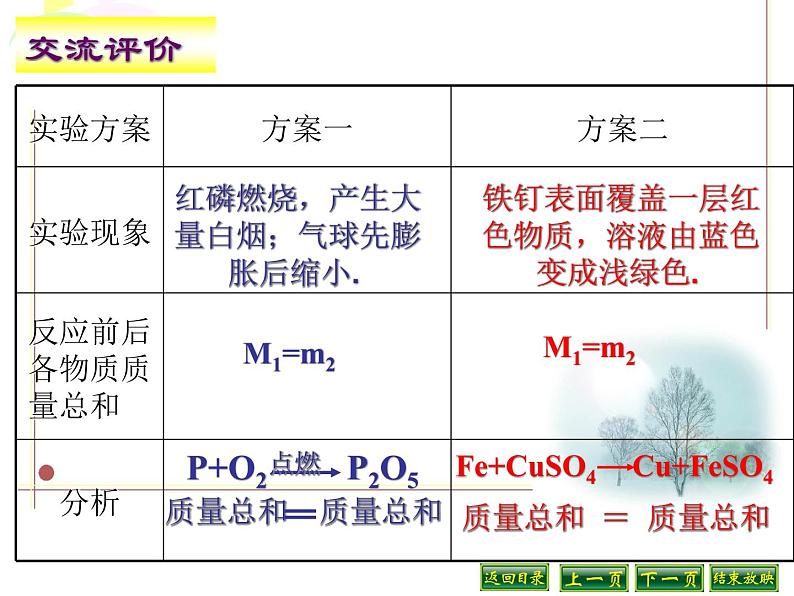
红磷燃烧,产生大量白烟;气球先膨胀后缩小.
铁钉表面覆盖一层红色物质,溶液由蓝色变成浅绿色.
参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和。
探究目的:是否所有化学反应都遵守质量守恒定律?实验内容:碳酸钠与稀盐酸反应前后,镁条燃烧前后质量的变化。我的猜想:反应前后质量_______(填相等或不等),天平______(平衡或不平衡)。实验方法:阅读课本94页实验5-1和5-2的内容,按要求完成实验,观察记录实验现象。讨论交流:实验结果和你预想的是否一致,为什么会出现这样的实验结果?
在实验中,稀盐酸和碳酸钠反应前后物质的总质量为什么不相等呢?
完全燃烧后称量留下固体的质量比反应前镁带的质量还要重。
理解和应用质量守恒定律时要注意以下几点: 1.质量守恒定律是一切化学反应必须遵守的一个定律,但物理变化不属于此定律。 2.质量守恒定律研究的仅是指“质量”,不能任意扩展到其他物理量。 3.守恒的数量是“总质量”,不是部分反应物和生成物的质量。 4.守恒的范围是“参加化学反应的各物质”,没有参加反应的物质,不能计算在内。
资料链接:质量守恒定律的发现
波义耳的实验(1673年)
拉瓦锡的实验(1777年)
观察氢气燃烧的微观示意图,思考化学反应前后为什么遵守质量守恒定律?
(1)本质:碳和氧气在点燃条件下反应生成二氧化碳。
以 为例,分析化学方程式表示了哪些意义?
C+O2 CO2
1 : 1 : 1
(2)粒子个数方面:1个碳原子和1个氧分子反应生成1个二氧化碳分子。
12 : 32 : 44
(3)质量方面:每12份质量的碳和32份质量的氧气完全反应生成44份质量的二氧化碳。
反应物:C、O2,生成物:CO2,条件:点燃。
表示反应物、生成物及反应条件
12 : 16×2 :12+16×2
12 : 32 : 44
1 : 1 : 1
2.化学方程式的读法:
1)宏观读法:碳和氧气在点燃条件下反应生成二氧化碳。
3)数量读法:每12份质量的碳和32份质量的氧气完全反应生成44份质量的二氧化碳。
2)微观读法:1个碳原子和1个氧分子反应生成1个二氧化碳分子。
用化学式来表示化学反应的式子
① 表示反应物、生成物
④ 表示反应物和生成物间的质量比
③ 表示参加反应和生成的各粒子的 相对数量
1.水通电分解的过程中,要发生改变的是( )①原子的种类②分子的种类③原子的数目④分子的数目⑤物质的状态⑥物质的颜色A. ①②④ B. ②③④⑤ C. ③④⑤⑥ D. ②④⑤⑥
2.在化学反应A+B====2C+D中,10 g A物质恰好与10 g B物质完全反应,若生成D物质8 g,则生成C物质为______。
3.下列对质量守恒定律的理解正确的是( )A.根据质量守恒定律可知10 g碳和10 g氧气完全 反应生成20 g二氧化碳.B.铝条燃烧后增加的质量等于参加反应的氧气的 质量 g高锰酸钾完全分解所得各生成物的质量 总和一定是10 g.D.蒸发液态空气所得各气体的质量总和等于液态 空气的质量,这有力地证实了质量守恒定律.
4.某物质在空气中完全燃烧只生成二氧化碳和 水,则该物质中( )A.只含有碳元素.B.只含有碳、氢元素.C.一定含有碳、氢、氧三种元素.D.一定含有碳、氢元素,可能含有氧元素.
5.能正确表示化学方程式 2H2+O2 2H2O 意义的是( )A.氢气在氧气中燃烧生成水.B.氢原子和氧原子在点燃条件下生成水分子. C.4份质量的氢气和32份质量的氧气在点燃条件 下生成36份质量的水. D.氢元素和氧元素在点燃条件下生成水元素.
6.对化学方程式2CO+O2 2CO2的读法或叙述正 确的是( )A.一氧化碳加氧气点燃等于二氧化碳.B.一氧化碳与氧气在点燃条件下生成二氧化碳.C.反应中CO、O2、CO2的质量比为28∶32∶44.D.2个一氧化碳分子加1个氧分子等于2个二 氧化碳 分子.
7.为了研究质量守恒定律,设计了下图“白磷燃烧前后质量测定”的实验,请分析有关问题:(1)装置:锥形瓶的底部铺有一层细沙, 其作用是 。(2)燃烧前称量,锥形瓶的总质量为 27.6g,则右图托盘天平中游码的 读数为 g.(3)白磷燃烧:白磷燃烧过程中看到 的现象是____________________。
初中人教版第五单元 化学方程式课题 1 质量守恒定律图文课件ppt: 这是一份初中人教版第五单元 化学方程式课题 1 质量守恒定律图文课件ppt,共23页。PPT课件主要包含了敞口装置体系,容积不可变的密闭体系等内容,欢迎下载使用。
初中化学课题 1 质量守恒定律课文配套ppt课件: 这是一份初中化学课题 1 质量守恒定律课文配套ppt课件,共45页。PPT课件主要包含了化学反应的实质,知识回顾,从分子和原子观点来看,化学反应前后,随堂练习等内容,欢迎下载使用。
化学九年级上册第五单元 化学方程式课题 1 质量守恒定律课文内容课件ppt: 这是一份化学九年级上册第五单元 化学方程式课题 1 质量守恒定律课文内容课件ppt,共17页。PPT课件主要包含了你发现了什么,你又发现了什么,猜测求证,②相等,①不相等,学习目标,红磷燃烧,交流总结,归纳升华,质量守恒定律等内容,欢迎下载使用。













