

2021年中考化学基础过关:11《盐化肥》(含答案) 试卷
展开2021年中考化学基础过关:
11《盐化肥》
1.在“粗盐中难溶性杂质的去除”实验中,玻璃棒的用途不正确的是( )
A.称取粗盐后,把粗盐研磨细
B.溶解时搅拌,加速粗盐溶解
C.称量精盐前,把精盐固体转移到纸上
D.蒸发时搅拌,防止因局部温度过高,造成液滴飞溅
2.下列离子在pH=1的溶液中,能大量存在,且为无色溶液的是( )
A.NH、Ca2+、Cl-、NO
B.K+、Na+、Cl-、CO
C.Fe3+、Mg2+、NO、Cl-
D.Na+、Ba2+、NO、OH-
3.海水淡化可采用膜分离技术。如图所示,对淡化膜右侧的海水加压,水分子可以透过淡化膜进入左侧淡水池,而海水中其他各种离子不能通过淡化膜,从而得到淡水。对加压后右侧海水成分变化分析正确的是( )
A.溶质质量增加
B.溶剂质量减少
C.溶液质量不变
D.溶质质量分数减小
4.在“粗盐中难溶性杂质的去除”实验中,玻璃棒的用途不正确的是( )
A.称取粗盐后,把粗盐研磨细
B.溶解时搅拌,加速粗盐溶解
C.称量精盐前,把精盐固体转移到纸上
D.蒸发时搅拌,防止因局部温度过高,造成液滴飞溅
5.“一带一路”赋予古丝绸之路崭新的时代内涵。古代染坊常用下列物质中的一种盐来处理丝绸,这种盐是( )
A.熟石灰 B.碳酸钾 C.乙醇 D.烧碱
6.下列各组物质中,能相互反应且反应前后溶液总质量保持不变的是( )
A.硫酸和烧碱溶液
B.铝和硫酸铜溶液
C.氧化铁固体和盐酸
D.碳酸钾溶液和硝酸钠溶液
7.用括号内的物质不能区分的一组是( )
A.NaCl、NaOH、NH4NO3三种固体(水)
B.K2CO3、Na2SO4、BaCl2三种溶液(稀硫酸)
C.铁粉、碳粉、氧化铜粉末(稀盐酸)
D.NaOH、NaCl、Na2SO4三种溶液(酚酞溶液)
8.下列各组物质中,能相互反应且反应前后溶液总质量保持不变的是( )
A.碳酸钙固体和稀盐酸
B.硫酸铜溶液和氢氧化钾溶液
C.盐酸和烧碱溶液
D.碳酸钾溶液和氯化钠溶液
9.如图是一些物质的转化关系,“→”表示一种物质能转化成另一种物质,其中A、B、C、D、E都含有同一种元素,且A、B、C、D属于同类别的化合物,A在生活中可用作调味品,C、E的水溶液能使酚酞溶液变红。部分反应物与生成物及反应条件已省略。
(1)写出A、E的化学式:A__________;E__________。
(2)写出下列反应的化学方程式(写出满足条件的一个即可)。
E→D:__________________________________________________________。
C→D:__________________________________________________________。
(3)图中的物质转化关系可以逆向转化的有(填物质的化学式):
____________→ ____________,______________→______________。
10.Na2CO3是一种常见的盐,多角度看物质可以提高对该物质的认识。
(1)Na2CO3俗称__________。
(2)从类别看,Na2CO3可以看作是某种碱和某种氧化物反应的产物。该反应的化学方程式:______________________________。
(3)从用途看,Na2CO3可制备某些物质,如Na2CO3+M→NaOH+N,写出该反应的化学方程式:__________________________。
(4)从组成看,Na2CO3、NaCl均属钠盐,NaCl溶于水显中性,但Na2CO3溶于水显碱性。请完善实验方案,探析上述性质差异的初步原因:
11.海水淡化可采用膜分离技术。如图1所示,对淡化膜右侧的海水加压,在其左侧得到淡水,其原因是海水中的水分子可以透过淡化膜,但其他各种离子不能透过。请回答:
(1)采用膜分离技术淡化海水的原理,与化学实验中常见的 操作相似。
(2)对淡化膜右侧的海水加压后,海水中溶质的质量分数会 (填“增大”“减小”或“不变”)。
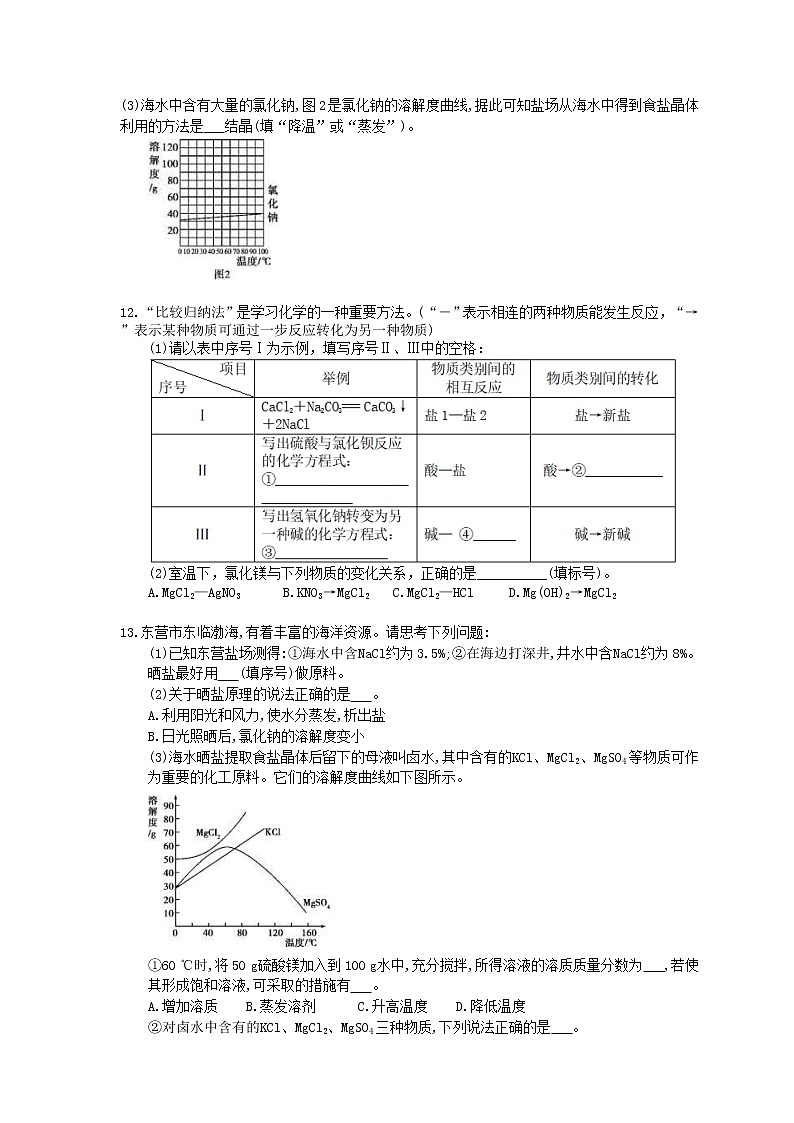
(3)海水中含有大量的氯化钠,图2是氯化钠的溶解度曲线,据此可知盐场从海水中得到食盐晶体利用的方法是 结晶(填“降温”或“蒸发”)。
12.“比较归纳法”是学习化学的一种重要方法。(“―”表示相连的两种物质能发生反应,“→”表示某种物质可通过一步反应转化为另一种物质)
(1)请以表中序号Ⅰ为示例,填写序号Ⅱ、Ⅲ中的空格:
(2)室温下,氯化镁与下列物质的变化关系,正确的是__________(填标号)。
A.MgCl2—AgNO3 B.KNO3→MgCl2 C.MgCl2—HCl D.Mg(OH)2→MgCl2
13.东营市东临渤海,有着丰富的海洋资源。请思考下列问题:
(1)已知东营盐场测得:①海水中含NaCl约为3.5%;②在海边打深井,井水中含NaCl约为8%。晒盐最好用 (填序号)做原料。
(2)关于晒盐原理的说法正确的是 。
A.利用阳光和风力,使水分蒸发,析出盐
B.日光照晒后,氯化钠的溶解度变小
(3)海水晒盐提取食盐晶体后留下的母液叫卤水,其中含有的KCl、MgCl2、MgSO4等物质可作为重要的化工原料。它们的溶解度曲线如下图所示。
①60 ℃时,将50 g硫酸镁加入到100 g水中,充分搅拌,所得溶液的溶质质量分数为 ,若使其形成饱和溶液,可采取的措施有 。
A.增加溶质 B.蒸发溶剂 C.升高温度 D.降低温度
②对卤水中含有的KCl、MgCl2、MgSO4三种物质,下列说法正确的是 。
A.三种物质均为易溶物质
B.20 ℃时,向40 g KCl固体和40 g MgCl2固体中分别加入100 g水充分溶解后,两种溶液均能达到饱和状态
C.60 ℃时,三种物质溶于水形成的溶液浓度可能相等
14.《四川盐法志》记载,“敞锅熬盐”的主要步骤为:①将黄卤和黑卤按比例混合;②放入敞口锅中加热浓缩,析出粗盐;③用“花水”冲洗粗盐得精品盐。
(1)步骤①中,黄卤所含杂质BaCl2和黑卤所含杂质MgSO4反应生成白色沉淀。该反应的化学方程式为__________________________________________________。
(2)步骤②中,析出粗盐的过程称为________________。
(3)步骤③用“花水”冲洗粗盐,既可除去表面的MgSO4和MgCl2杂质,又不损失NaCl。则“花水”应当是__________(填字母)。
A.蒸馏水
B.饱和NaCl溶液
C.饱和NaOH溶液
D.饱和BaCl2溶液
(4)将60 kg含10% NaCl的黄卤和40 kg含15% NaCl的黑卤混合,经“敞锅熬盐”制得的粗盐中NaCl的质量最多为__________kg。
实验与探究题
15.实验室中有一瓶标签破损的固态铵盐,它可能是NH4Cl、NH4NO3、NH4HCO3、(NH4)2SO4中的一种,请利用如图所示的溶液进行实验探究。
[提出猜想] 猜想①:该铵盐是NH4Cl;猜想②:该铵盐是________;猜想③:该铵盐是NH4HCO3;猜想④:该铵盐是(NH4)2SO4。
[实验探究] 步骤一:取少量样品放入试管中,没有闻到强烈的氨味,加入适量水溶解得到无色液体,选用图中的________滴入试管中,无气泡放出,则猜想③不成立。
步骤二:在步骤一所得的溶液中,滴加图中的Ba(NO3)2溶液,没有白色沉淀生成,则猜想________不成立。
步骤三:另取适量样品放入试管中,加水溶解配成溶液,滴加图中的________溶液,有白色沉淀生成,则猜想________成立。
[拓展应用] 铵盐可作氮肥,它会与碱性物质发生化学反应,请写出硝酸铵溶液与氢氧化钠溶液在加热条件下反应的化学方程式____________________________,所以在农业生产中,为避免降低肥效,铵态氮肥不要与碱性物质混合施用。
16.通过海水晾晒可得粗盐,粗盐中除NaCl外,还含有MgCl2、CaCl2、Na2SO4及泥沙等杂质。以下是制备精盐的实验方案:
(1)在第③步操作中,选择的除杂试剂不能用KOH代替NaOH,
理由是____________________________________________________。
(2)在第④步操作中,加入过量碳酸钠溶液的作用是______________________(用化学方程式表示)。
(3)若第⑤步过滤操作之后发现滤液仍浑浊,其原因可能是_____________(写一种)。
(4)第⑥步操作的目的是除去滤液中的__________________(填化学式);若加入的盐酸略过量是否对实验结果有影响?______________(填“有影响”或“无影响”),
原因是________________________________________。
参考答案
1.答案为:A;
解析:在“粗盐中难溶性杂质的去除”实验中,玻璃棒在溶解时用于搅拌,加速粗盐溶解;在过滤时用来引流;在蒸发时用于搅拌,防止因局部温度过高,造成液滴飞溅;在称量精盐前,用来把精盐固体转移到纸上。称取粗盐后,应使用研钵和研杵把粗盐研磨细。
2.答案为:A;
3.答案为:B;
解析:F加压后,溶质不能通过淡化膜,水分子可以透过淡化膜进入左侧,所以右侧溶质质量不变,溶剂质量减少,溶液质量减少,溶质质量分数变大。
4.答案为:A;
5.答案为:B;
解析:碳酸钾是由钾离子与碳酸根离子构成的化合物,属于盐。
6.答案为:A;
解析:硫酸和氢氧化钠反应,没有气体和沉淀产生,溶液的质量不变;铝能置换出硫酸铜中的铜,溶液中的溶质由硫酸铜变成硫酸铝[3CuSO4~Al2(SO4)3],溶液质量减小;氧化铁和盐酸反应,溶液增加的质量为参加反应的氧化铁的质量;碳酸钾和硝酸钠不反应,溶液总质量保持不变。
7.答案为:D;
8.答案为:C;
9.答案为:
(1)NaCl NaOH
(2)CuSO4+2NaOH=== Na2SO4+Cu(OH)2↓(合理即可)
Na2CO3+H2SO4=== Na2SO4+H2O+CO2↑(合理即可)
(3)Na2CO3 NaOH Na2SO4 NaOH
10.答案为:
(1)纯碱;
(2)2NaOH+CO2=== Na2CO3+H2O
(3)Na2CO3+Ca(OH)2=== CaCO3↓+2NaOH
(4)①无明显现象 ②过量CaCl2(BaCl2等)溶液 ③产生白色沉淀,溶液红色消失 ④Na2CO3溶于水呈碱性与CO 有关
11.答案为:(1)过滤 (2)增大 (3)蒸发
解析:
(1)题给方法类似于过滤——分离难溶性固体和液体的方法。
(2)由题干信息可知,海水中溶质质量不变,溶剂的质量减少,所以溶液中溶质的质量分数增大。
(3)由图像可知,氯化钠的溶解度受温度影响比较小,所以从海水中得到食盐晶体利用的方法是蒸发结晶。
12.答案为:
(1)①H2SO4+BaCl2=== 2HCl+BaSO4↓
②新酸(合理均可) ③CuSO4+2NaOH=== Na2SO4+Cu(OH)2↓(合理均可) ④盐;
(2)AD
13.答案为:
(1)②
(2)A
(3)①33.3% ABCD ②AC
解析:(1)海水中氯化钠的浓度越高,产率越高,所以选海边的井水较好。(2)海水晒盐的原理是利用阳光和风力,使水分蒸发,析出盐。(3)①60℃时,将50g硫酸镁加入到100g水中,充分搅拌,所得溶液的溶质质量分数为×100%≈33.3%;由MgSO4的溶解度曲线随温度的变化可知,60℃时使其不饱和溶液变为饱和溶液,可用的方法是增加溶质、蒸发溶剂、升高温度、降低温度。②20℃时,溶解度大于10g的物质称为易溶物质,故三种物质均为易溶物质,A项正确;20℃时,KCl的溶解度约为35g,MgCl2的溶解度约为50g,向40gKCl和MgCl2固体中,分别加入100g水,充分溶解后,KCl溶液达到饱和状态,MgCl2溶液为不饱和状态,B项错误;60℃时,三种物质可能均能完全溶解,溶于水形成的溶液浓度可能相等。
14.答案为:
(1)BaCl2+MgSO4=== MgCl2+BaSO4↓
(2)蒸发结晶;
(3)B;
(4)12
15.答案为:
[提出猜想] NH4NO3
[实验探究] 稀盐酸 ④ 硝酸银 ①
[拓展应用] NH4NO3+NaOHNaNO3+NH3↑+H2O
[解析] [提出猜想]它可能是NH4Cl、NH4NO3、NH4HCO3、(NH4)2SO4中的一种,其余三种猜想已给出。
[实验探究] 步骤一:根据取少量样品放入试管中,没有闻到强烈的氨味,加入适量水溶解得到无色液体,滴入某种溶液无气泡放出,说明该样品中不含碳酸氢铵,所以此溶液为稀盐酸;步骤二:NH4Cl、NH4NO3、NH4HCO3、(NH4)2SO4中只有(NH4)2SO4能和硝酸钡反应生成白色沉淀,其余三种都不能和硝酸钡反应;步骤三:稀盐酸和硝酸钡都用过了,只有硝酸银没有用,且硝酸银和硝酸铵不反应,但和氯化铵反应生成氯化银白色沉淀和硝酸铵。
[拓展应用] 硝酸铵溶液与氢氧化钠溶液在加热条件下反应,生成硝酸钠、氨气和水。
16.答案为:
(1)防止带入新的杂质氯化钾;
(2)Na2CO3+BaCl2=== 2NaCl+BaCO3↓、Na2CO3+CaCl2=== 2NaCl+CaCO3↓
(3)滤纸破损(或液面高于滤纸边缘等)
(4)NaOH、Na2CO3 无影响 蒸发时氯化氢气体会全部挥发掉








