







所属成套资源:2025年高中化学选择性必修2课件(人教版)
第二章 第三节 第三课时 分子结构与物质性质小结 2025年高中化学选择性必修2课件(人教版)
展开
这是一份第二章 第三节 第三课时 分子结构与物质性质小结 2025年高中化学选择性必修2课件(人教版),文件包含第二章第三节第3课时分子结构与物质性质小结pptx、第二章第三节第3课时分子结构与物质性质小结教师版docx、第二章第三节第3课时分子结构与物质性质小结docx等3份课件配套教学资源,其中PPT共60页, 欢迎下载使用。
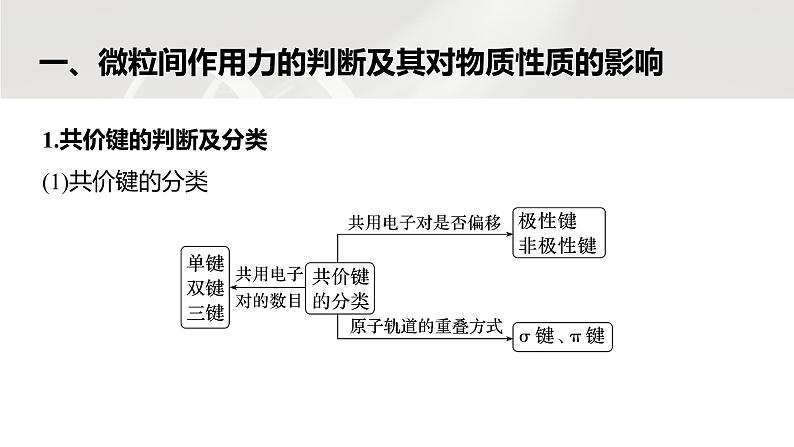
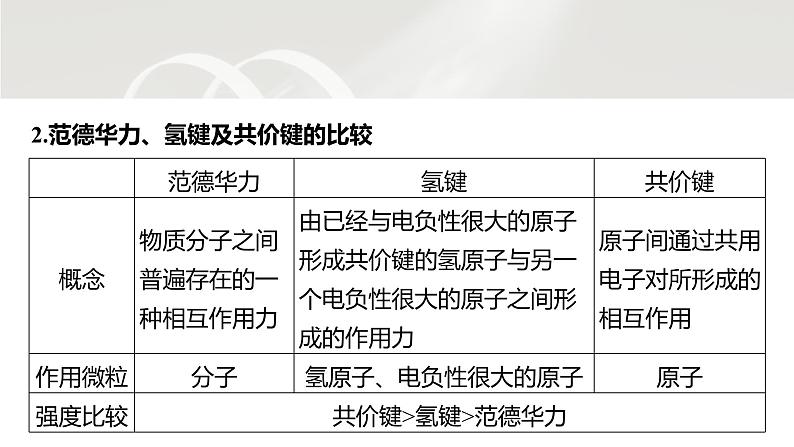
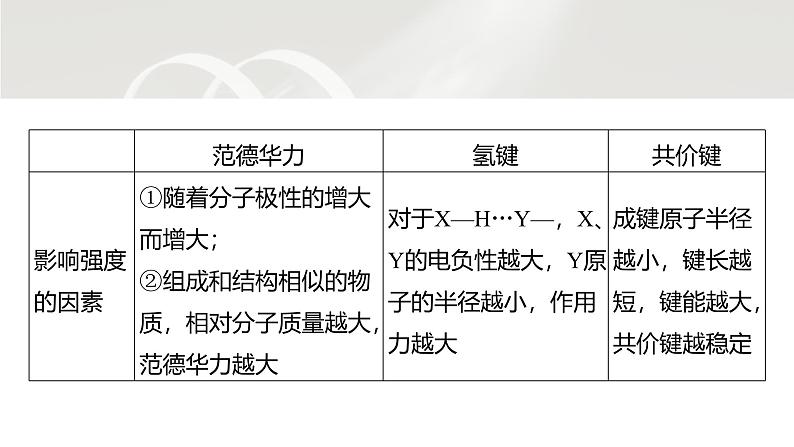
分子结构与物质性质小结第3课时第二章 第三节HI>HF ④由于氢键的存在,使水与乙醇互溶 ⑤由于氢键的存在,使水具有稳定的化学性质A.②⑤ B.③⑤ C.②④ D.①④√ 应用体验冰中水分子有序排列,每个水分子被4个水分子包围,形成4个氢键,使体积膨胀,密度减小,所以冰能浮在水面上,故①正确;氢键属于分子间作用力,不属于化学键,故②错误;HF分子间存在氢键,沸点最高,HCl、HBr、HI分子间都不存在氢键,其熔、沸点高低取决于分子间作用力大小,相对分子质量越大,分子间作用力越大,则熔、沸点越高,所以沸点:HCld√1234567891011121314b分子中化学键是氯原子与氯原子形成的非极性共价键,故A错误;四种分子都无π键,故B错误;甲烷中碳原子与氢原子形成4个碳氢σ键,一氯甲烷分子中形成三个碳氢σ键和一个碳氯σ键,中心原子均为sp3杂化,故C正确;氯的原子半径大于氢的原子半径,所以氯气分子中的Cl—Cl的键能小于氯化氢分子中的H—Cl的键能,故D错误。12345678910111213144.二硫代磷酸酯的分子结构如图,下列说法错误的是A.该物质可以与水形成分子间氢键B.二硫代磷酸酯中C—O的极性小于C—SC.该分子中的所有原子无法都共平面D.1 mol该物质含有的π键数目为2NA√1234567891011121314C、O的电负性之差大于C、S的电负性之差,故C—O的极性大于C—S,故B错误;该分子中含有sp3杂化的碳原子,所有原子无法都共平面,故C正确;二硫代磷酸酯的分子结构中含有1个P==S和1个C==O,则含有的π键数目为2个,1 mol该物质含有的π键数目为2NA,故D正确。12345678910111213145.(2023·福州高二检测)LiPF6作为一种非常有竞争力的锂电池电解质盐,可用以下方法制得:PCl5+5LiF===5LiCl+PF5,LiF+PF5===LiPF6。下列说法不正确的是A.LiPF6易溶于乙醚、碳酸酯等极性较小的溶剂B.PCl5中所有原子都满足最外层8电子稳定结构C.PF5比PCl5的热稳定性更好D.PCl5是由极性共价键构成的非极性分子√12345678910111213141234567891011121314PCl5中P原子与5个Cl原子形成5个共用电子对,最外层电子数为10,B错误;PF5中P—F的键长比PCl5中P—Cl的键长短,键能大,键能越大分子越稳定,所以PF5比PCl5的热稳定性更好,C正确;PCl5中P—Cl是极性键,PCl5的空间结构是三角双锥形,正、负电中心重合,是非极性分子,D正确。6.科学家研究温室气体CH4、CO2的转化和利用。下列关于CH4和CO2的说法正确的是A.因为碳氢键的键能小于碳氧键,所以CH4 的熔点低于CO2B.1 mol CO2分子中含有4 mol σ键C.CH4与H2O形成的水合物晶体俗称“可燃冰” (结构见上图),分子间仅存在范德华力D.N2O与CO2的价电子数相等√12345678910111213141234567891011121314二者熔点高低取决于分子间作用力的相对大小,与共价键的键能大小无关,A错误;每个二氧化碳分子中存在2个碳氧双键,每个碳氧双键中存在1个σ键,则1 mol CO2分子中含有2 mol σ键,B错误;CH4与H2O分子间存在范德华力,且水分子间存在氢键,C错误;N2O和CO2均有16个价电子,D正确。7.(2023·广东江门高二期中)下列关于分子的结构和性质的描述错误的是A.PF5和PCl5分子均为三角双锥形结构,两者的沸点关系:PF5Y>ZB.氢化物沸点:Y>W>XC.W和Y可组成含极性键的非极性分子D.Y的单质均可用于杀菌消毒√1234567891011121314W、X、Y、Z均为短周期元素且原子序数依次增大,常温下,0.1 mol·L-1 Z的氢化物的水溶液pH=1,该氢化物为HCl,则Z为Cl元素;结合图示可知,Y形成2个共价键,位于第Ⅵ A族,且Z与Y位于不同周期,则Y为O元素;W形成4个共价键,其原子序数小于O,则W为C元素;X形成3个共价键,则X为N元素。电子层数越多离子半径越大,电子层结构相同时,核电荷数越大离子半径越小,则简单离子半径:Z>X>Y,故A错误;1234567891011121314W的氢化物为烃,碳原子数较多的烃常温下为固态,其沸点大于氨气和水,故B错误;W和Y组成的二氧化碳分子中含有碳氧极性键,属于非极性分子,故C正确;氧元素的单质有氧气和臭氧,臭氧具有强氧化性,能够杀菌消毒,但氧气不能用于杀菌消毒,故D错误。123456789101112131412.研究发现,在CO2低压合成甲醇反应(CO2+3H2===CH3OH+H2O)中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。回答下列问题:(1)CO2和CH3OH分子中C原子的杂化方式分别为 和 。 (2)在CO2低压合成甲醇反应所涉及的4种物质中,沸点从高到低的顺序为 , 原因是______________________________________________________________________________________________________________________。 1234567891011121314spsp3H2O>CH3OH>CO2>H2H2O与CH3OH均为极性分子,水分子间氢键比甲醇分子间氢键多;CO2与H2均为非极性分子,CO2相对分子质量较大,范德华力大(3)在常压下,甲醇的沸点(65 ℃)比甲醛的沸点(-19 ℃)高,主要原因是 。 1234567891011121314甲醇分子间存在氢键13.现有五种短周期非金属元素,其中A、B、C的最外层电子排布式可分别表示为asa、bsbbpb、csccp2c,D与B同主族,E位于C的下一周期,且是同周期中电负性最大的元素。试回答下列问题。(1)由A、B、C、E四种元素中的两种元素可形成多种分子,下列分子①BC2 ②BA4 ③A2C2 ④BE4中,属于极性分子的是 (填序号)。 1234567891011121314③由A、B、C、D、E为短周期的非金属元素及s轨道最多可容纳2个电子可得:a=1,b=c=2。即A为H,B为C,C为O,D为Si,E为Cl。①②③④分别为CO2、CH4、H2O2、CCl4,其中H2O2为极性分子,其他均为非极性分子。1234567891011121314(2)C的最简单氢化物比下一周期同族元素的氢化物沸点高,其原因是 。 1234567891011121314H2O分子间可形成氢键C的最简单氢化物为H2O,H2O分子间可形成氢键使其沸点比下一周期同族元素的氢化物的沸点高。(3)B、C两种元素都能和A元素形成常见的溶剂,其化学式分别为 、 。DE4在前者中的溶解度 (填“大于”或“小于”)在后者中的溶解度。 1234567891011121314C6H6B、A两种元素形成的常见溶剂为苯,C、A两种元素形成的常见溶剂为水。SiCl4为非极性分子,易溶于非极性溶剂苯中。H2O大于(4)BA4、BE4和DE4的沸点从高到低的顺序为__________________(填化学式)。 1234567891011121314SiCl4>CCl4>CH4BA4、BE4、DE4分别为CH4、CCl4、SiCl4,三者结构相似,相对分子质量越大,分子间作用力越大,故沸点:SiCl4>CCl4>CH4。 1234567891011121314d1234567891011121314NH3和H2O都是极性分子,相似相溶,a有关;NH3极易溶于水,主要原因是NH3分子与H2O分子间形成氢键,b有关;NH3和H2O能发生化学反应,加速NH3的溶解,c有关;NH3易液化与其水溶性无关,d无关。(2)CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断CrO2Cl2是 (填“极性”或“非极性”)分子。 1234567891011121314非极性CCl4、CS2是非极性溶剂,根据“相似相溶”规律可知,CrO2Cl2是非极性分子。(3)金属镍粉在CO气流中轻微加热,生成无色挥发性液体Ni(CO)4,Ni(CO)4呈正四面体形。Ni(CO)4易溶于下列物质中的 (填字母)。 a.水 b.CCl4 c.苯 d.NiSO4溶液1234567891011121314bc由Ni(CO)4易挥发且其空间结构为正四面体形可知,Ni(CO)4为非极性分子,根据“相似相溶”规律可知,Ni(CO)4易溶于CCl4和苯。(4)甲醛、甲醇和甲酸等碳原子数较少的醛、醇和羧酸均易溶于水的原因是 。 1234567891011121314它们都是极性分子且都能与H2O分子形成分子间氢键返回第二章 第三节






