











所属成套资源:2025年高中化学选择性必修2课件(人教版)
第一章 第二节 第二课时 元素周期律 2025年高中化学选择性必修2课件(人教版)
展开
这是一份第一章 第二节 第二课时 元素周期律 2025年高中化学选择性必修2课件(人教版),文件包含第一章第二节第2课时元素周期律pptx、第一章第二节第2课时元素周期律教师版docx、第一章第二节第2课时元素周期律docx、原子的第一电离能swf等4份课件配套教学资源,其中PPT共60页, 欢迎下载使用。
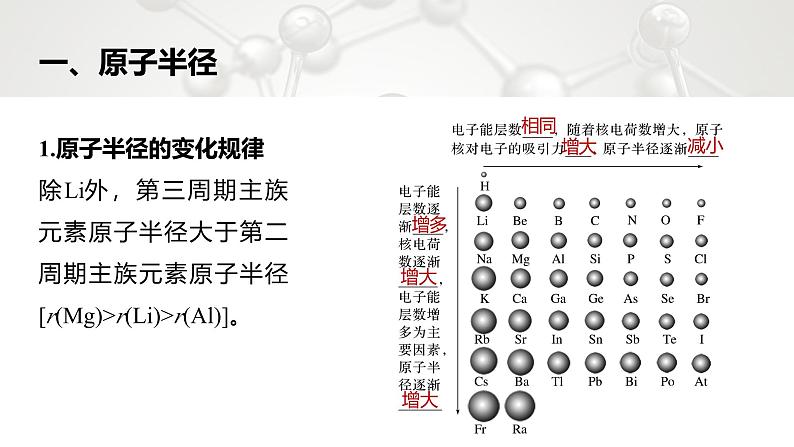
元素周期律第2课时第一章 第二节r(Al)]。一、原子半径相同增大减小增多增大增大2.原子或离子半径的比较方法(1)同种元素的离子半径:阴离子大于原子,原子大于阳离子,低价阳离子大于高价阳离子。例如:r(Cl-) r(Cl),r(Fe) r(Fe2+) r(Fe3+)。(2)能层结构相同的离子:核电荷数越大,半径越小。例如:r(O2-) r(F-) r(Na+) r(Mg2+) r(Al3+)。(3)带相同电荷的离子:能层数越多,半径越大。例如:r(Li+) r(Na+) r(K+) r(Rb+) r(Cs+),r(O2-) r(S2-) r(Se2-) r(Te2-)。>>>>>>>B+>A2+。 应用体验1.正误判断(1)核外能层结构相同的单核粒子,半径相同(2)质子数相同的不同单核粒子,电子数越多,半径越大(3)各元素的原子半径总比其离子半径大(4)同周期元素从左到右,原子半径、离子半径均逐渐减小×√×× 应用体验2.下列各组微粒不是按半径逐渐增大的顺序排列的是A.Na、K、Rb B.F、Cl、BrC.Mg2+、Al3+、Zn2+ D.Cl-、Br-、I-√ 应用体验同主族元素,从上到下,原子半径(或离子半径)逐渐增大,故A、B、D三项中的各微粒的半径逐渐增大;能层数相同,核电荷数越大半径越小,Mg2+、Al3+能层数相同但铝元素的核电荷数大,所以Al3+的半径小,故C项中微粒不是按半径逐渐增大的顺序排列的。 应用体验3.[2020·全国卷Ⅲ,35(1)节选]氨硼烷(NH3BH3)含氢量高、热稳定性好,是一种具有潜力的固体储氢材料。H、B、N中,原子半径最大的是 。B 方法规律粒子半径比较的一般思路(1)“一层”:先看能层数,能层数越多,一般微粒半径越大。(2)“二核”:若能层数相同,则看核电荷数,核电荷数越大,微粒半径越小。(3)“三电子”:若能层数、核电荷数均相同,则看核外电子数,电子数多的半径大。返回电离能二二、电离能1.电离能的概念(1) 原子失去一个电子转化为 正离子所需要的_____ 叫做第一电离能,符号:I1。可以衡量元素的气态原子失去一个电子的 。(2)各级电离能:+1价气态基态正离子失去一个电子,形成+2价气态基态正离子所需的最低能量叫第二电离能,用 表示;+2价气态基态正离子再失去一个电子,形成+3价气态基态正离子所需的最低能量叫做第三电离能,用 表示,依次类推。气态基态气态基态最低能量难易程度I2I32.电离能的变化规律(1)每个周期的第一种元素(氢和碱金属)的第一电离能 ,最后一种元素(稀有气体)的第一电离能 ,即一般来说,同周期随着核电荷数的递增,元素的第一电离能呈 趋势。(2)同族元素从上到下第一电离能逐渐 。(3)同种原子的逐级电离能越来越 (I1ⅥA。 1.元素周期表中,第一电离能最大的是哪个元素?第一电离能最小的应出现在元素周期表什么位置?深度思考提示 最大的是He;最小的应在元素周期表左下角。 2.下表是钠、镁、铝逐级失去电子的电离能:深度思考 (1)为什么同一元素的电离能逐级增大?深度思考提示 这是由于原子失去一个电子变成+1价阳离子后,半径变小,核电荷数未变而电子数目变少,原子核对电子的吸引作用增强,因而第二个电子比第一个电子更难失去,故I2>I1,同理I3>I2。 (2)为什么钠、镁、铝的化合价分别为+1、+2、+3?深度思考提示 钠的I1比I2小很多,电离能差值很大,说明失去第一个电子比失去第二个电子容易得多,所以Na容易失去一个电子变成+1价离子;Mg的I1和I2相差不多,而I3比I2大很多,说明Mg容易失去2个电子形成+2价离子;Al的I1、I2、I3相差不多,而I4比I3大很多,所以Al容易失去3个电子形成+3价离子。 应用体验1.正误判断(1)第一电离能越大的原子失电子的能力越强(2)铝的第一电离能比镁的第一电离能大(3)在所有元素中,氟元素的第一电离能最大(4)同一周期中,主族元素原子的第一电离能从左到右越来越大(5)同一周期典型金属元素的第一电离能总是小于典型非金属元素的第一电离能×√××× 应用体验2.在下面的电子结构中,第一电离能最小的原子可能是A.3s23p3 B.3s23p5C.3s23p4 D.3s23p6√ 应用体验同一周期中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第ⅡA族、第ⅤA族元素的第一电离能大于其相邻元素,同一主族元素中,其第一电离能随着原子序数的增大而减小。3s23p3属于第ⅤA族元素、3s23p5属于第ⅦA族元素、3s23p4属于第ⅥA族元素、3s23p6属于0族元素,这几种元素都是第三周期元素,分别是P、Cl、S、Ar,其第一电离能大小顺序是Ar>Cl>P>S,所以第一电离能最小的原子是S。 应用体验3.(1)[2020·江苏,21(2)节选]C、N、O元素的第一电离能由大到小的顺序为 。 (2)[2019·全国卷Ⅰ,35(1)]下列状态的镁中,电离最外层一个电子所需能量最大的是 (填标号)。 N>O>CA 应用体验[Ne]3s1属于基态的Mg+,由于Mg的第二电离能高于其第一电离能,故其再失去一个电子所需能量较高;[Ne] 3s2属于基态Mg原子,其失去一个电子变为基态Mg+;[Ne]3s13p1属于激发态Mg原子,其失去一个电子所需能量低于基态Mg原子;[Ne]3p1属于激发态Mg+,其失去一个电子所需能量低于基态Mg+,综上所述,电离最外层一个电子所需能量最大的是[Ne]3s1。 易错提醒(1)第一电离能与元素的金属性有本质的区别。(2)由电离能的递变规律可知:同周期主族元素从左到右,元素的第一电离能呈增大趋势,但第ⅡA族的Be、Mg的第一电离能较同周期第ⅢA族的B、Al的第一电离能要大;第ⅤA族的N、P、As的第一电离能较同周期第ⅥA族的O、S、Se的第一电离能要大。这是由于第ⅡA族元素的最外层电子排布为ns2,p轨道为全空状态,较稳定;而第ⅤA族元素的最外层电子排布为ns2np3,p轨道为半充满状态,比第ⅥA族的ns2np4状态稳定。返回电负性三三、电负性1.有关概念与意义(1)键合电子:元素相互化合时,原子中用于形成 的电子。(2)电负性:用来描述不同元素的原子对键合电子 的大小。电负性越大的原子,对键合电子的吸引力 。(3)电负性大小的标准:以氟的电负性为 和锂的电负性为 作为相对标准。化学键吸引力越大4.01.02.递变规律(1)一般来说,同周期元素从左到右,元素的电负性逐渐 ,元素的非金属性逐渐 、金属性逐渐 。(2)一般来说,同族元素从上到下,元素的电负性逐渐 ,元素的金属性逐渐 、非金属性逐渐 。变大增强减弱变小增强减弱3.应用(1)判断元素的金属性和非金属性强弱①金属元素的电负性一般 1.8,非金属元素的电负性一般 1.8,而位于非金属三角区边界的“类金属”(如锗、锑等)的电负性则在_________,它们既有金属性,又有非金属性。②金属元素的电负性 ,金属元素越活泼;非金属元素的电负性 ,非金属元素越活泼。小于大于1.8左右越小越大(2)判断元素的化合价①电负性数值小的元素在化合物中吸引电子的能力 ,元素的化合价为正值。②电负性数值大的元素在化合物中吸引电子的能力 ,元素的化合价为负值。弱强(3)判断化合物的类型如H的电负性为2.1,Cl的电负性为3.0,Cl的电负性与H的电负性之差为3.0-2.1=0.9①>③>④,C错误;123456789101112131415① ②③ ④一般情况下同一周期元素从左至右第一电离能呈增大趋势,若元素处于第ⅡA、第ⅤA族的全充满、半充满的稳定状态时,其第一电离能大于同一周期相邻元素;同一主族元素的第一电离能随原子序数的增大而减小,则第一电离能大小关系为②>①>④>③,D错误。12345678910111213141511.(2023·焦作高二检测)下列各组元素性质的递变情况错误的是A.Li、Be、B原子的最外层电子数依次增多B.P、S、Cl元素的最高化合价依次升高C.N、O、F电负性依次增大D.Na、K、Rb第一电离能逐渐增大√123456789101112131415Li、Be、B原子的最外层电子数分别为1、2、3,选项A正确;P、S、Cl元素最外层电子数分别为5、6、7,最高化合价分别为+5、+6、+7价,选项B正确;同周期元素从左到右元素的电负性逐渐增大,则N、O、F电负性依次增大,选项C正确;同主族元素从上到下元素的第一电离能逐渐减小,则Na、K、Rb元素的第一电离能逐渐减小,选项D错误。12345678910111213141512.已知X、Y、Z为同一周期的三种元素,其原子的部分电离能如下表所示:123456789101112131415下列说法正确的是A.三种元素中,X元素的第一电离能最小,其电负性在同一周期元素中也 最小B.三种元素中,Y元素的第一电离能最大,其电负性也最大C.等物质的量的X、Y、Z三种单质与少量盐酸反应放出氢气的物质的量 之比为1∶1∶1D.三种单质与盐酸反应放出等量氢气时,消耗X、Y、Z的物质的量之比 为3∶2∶1√123456789101112131415123456789101112131415根据元素电离能的变化规律可知:X为第ⅠA族元素、Y为第ⅡA族元素、Z为第ⅢA 族元素,又知X、Y、Z为同一周期的三种元素,假设X、Y、Z属于第三周期,则这三种元素分别为Na、Mg、Al。第一电离能最小的为Na,电负性在同一周期元素中最小的也是Na,A正确;三种元素中,第一电离能最大的为Mg,电负性最大的为Al,B错误;三种金属和少量盐酸反应完成后,剩余的金属钠继续与水反应生成氢气,最终金属钠生成的氢气最多,C错误;123456789101112131415 13.短周期主族元素X、Y、Z、W、M、N的原子序数依次增大,X核外电子只有1种运动状态,Y、W的2p轨道均含有2个未成对电子,M是与X不同主族的金属元素,N的氢氧化物具有两性,下列说法正确的是A.电负性:Z






