
所属成套资源:2025年高考化学 热点 重点 难点 专练(浙江专用)
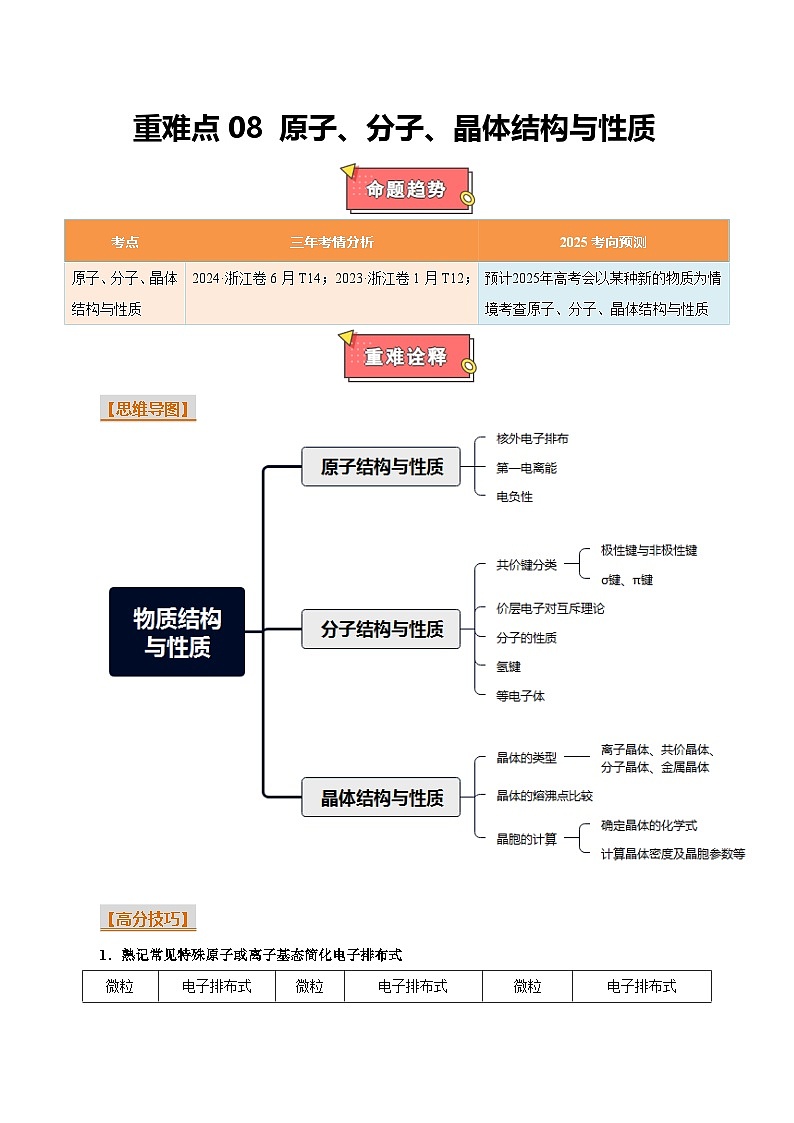
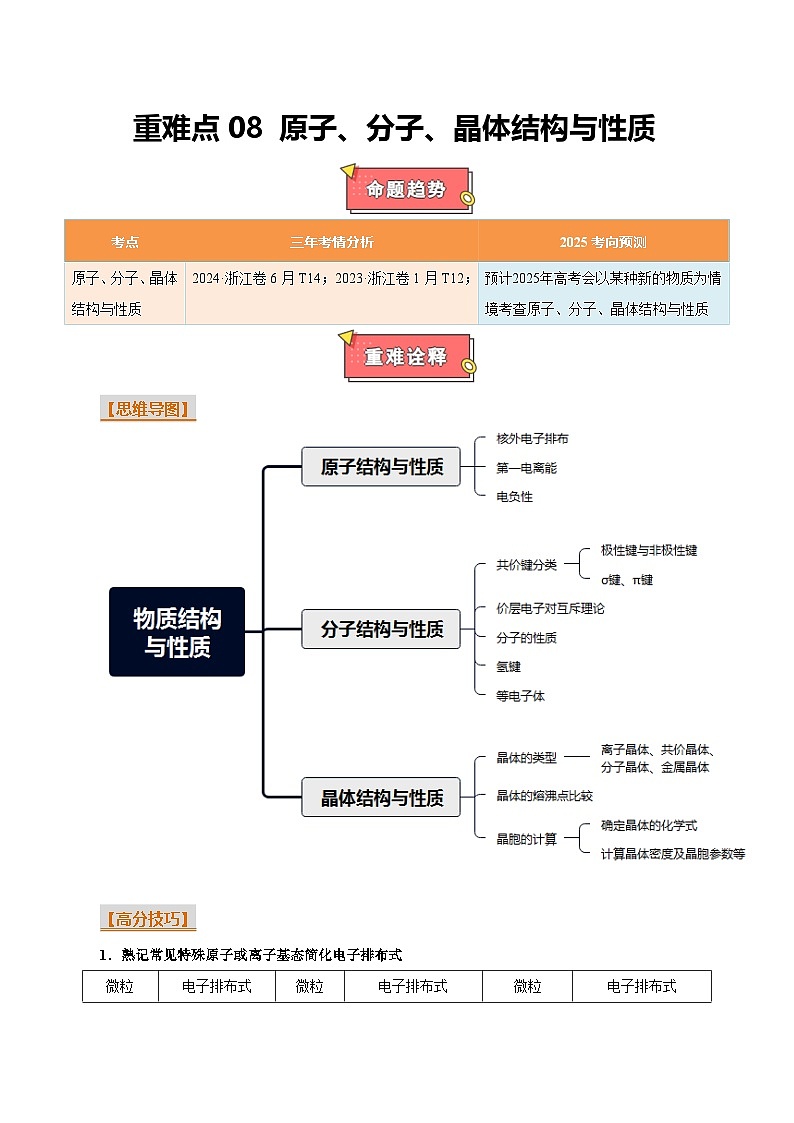
重难点08 原子、分子、晶体结构与性质-2025年高考化学 热点 重点 难点 专练(浙江专用)
展开
这是一份重难点08 原子、分子、晶体结构与性质-2025年高考化学 热点 重点 难点 专练(浙江专用),文件包含重难点08原子分子晶体结构与性质-2025年高考化学热点重点难点专练浙江专用原卷版docx、重难点08原子分子晶体结构与性质-2025年高考化学热点重点难点专练浙江专用解析版docx等2份试卷配套教学资源,其中试卷共24页, 欢迎下载使用。
【思维导图】
【高分技巧】
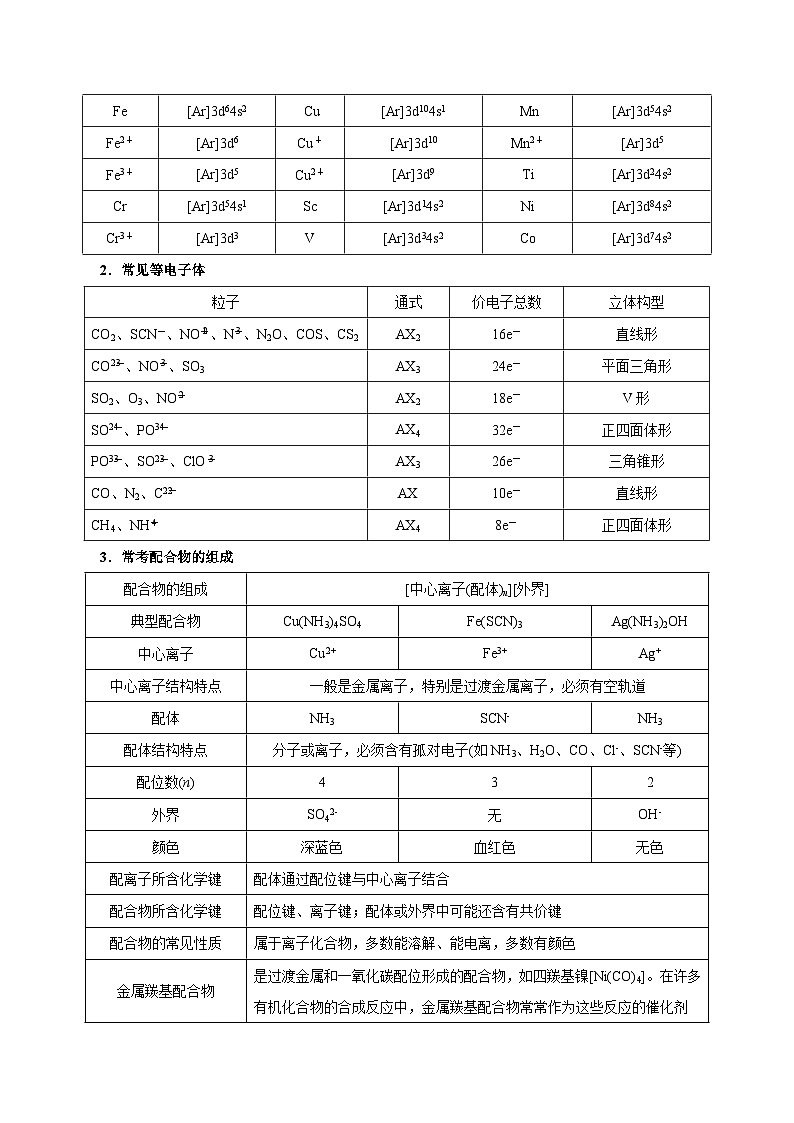
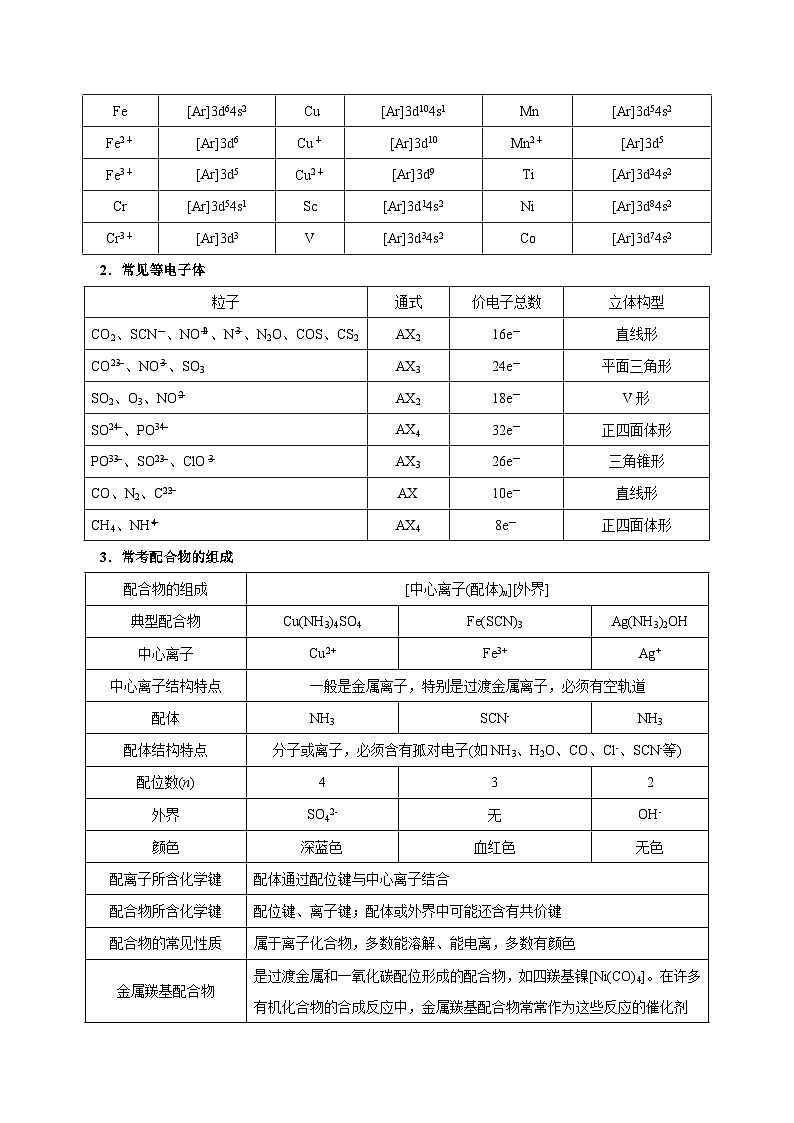
1.熟记常见特殊原子或离子基态简化电子排布式
2.常见等电子体
3.常考配合物的组成
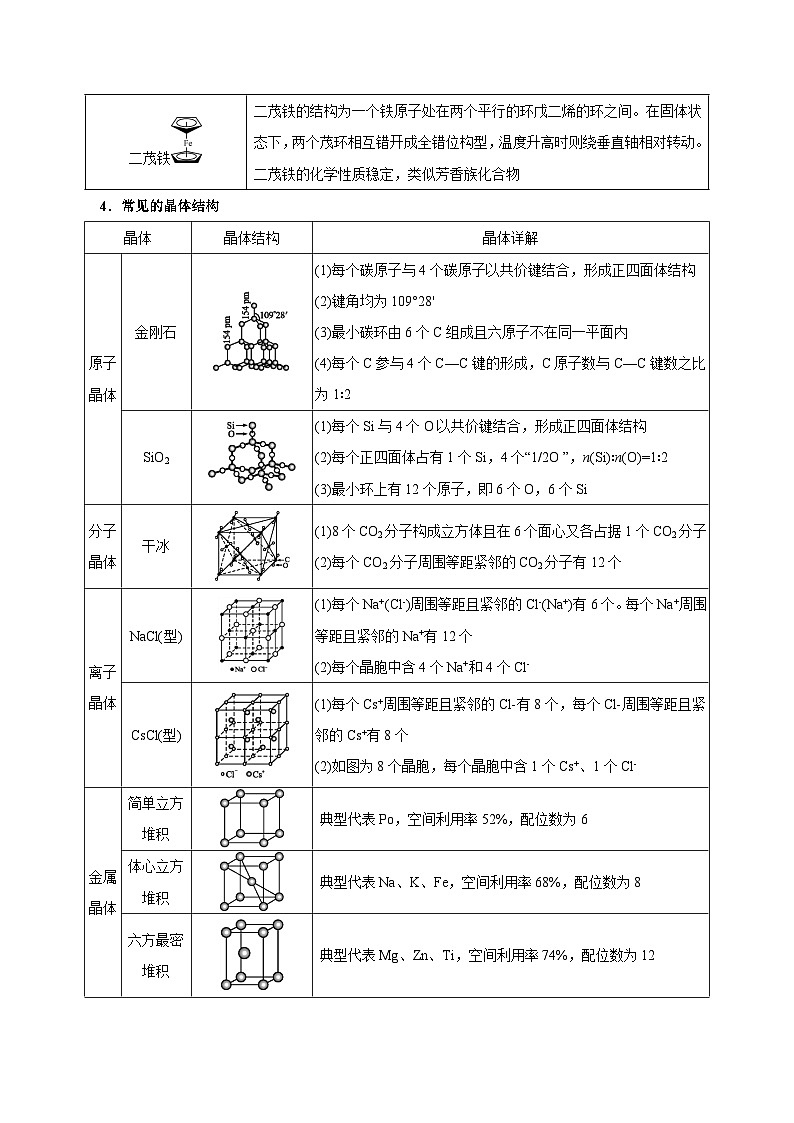
4.常见的晶体结构
(建议用时:20分钟)
1.(2024·浙江省6月选考)Si5Cl10中的Si原子均通过sp3杂化轨道成键,与NaOH溶液反应Si元素均转化成Na2SiO3。下列说法不正确的是( )
A.Si5Cl10分子结构可能是B.Si5Cl10与水反应可生成一种强酸
C.Si5Cl10与NaOH溶液反应会产生H2 D.Si5Cl10沸点低于相同结构的Si5Br10
【答案】A
【解析】A项,该结构中,如图所示的两个Cl,Cl最外层有7个电子,形成了两个共价键,因此其中1个应为配位键,而Si不具备空轨道来接受孤电子对,因此结构是错误的,故A错误;B项,Si5Cl10与水反应可生成HCl,HCl是一种强酸,故B正确;C项,Si5Cl10与NaOH溶液反应Si元素均转化成Na2SiO3,Si的化合价升高,根据得失电子守恒可知,H元素的化合价降低,会有H2生成,故C正确;D项,Si5Br10的相对分子质量大于Si5Cl10,因此Si5Br10的范德华力更大,沸点更高,故D正确;故选A。
2.(2023·浙江省1月选考)共价化合物Al2Cl6中所有原子均满足8电子稳定结构,一定条件下可发生反应:,下列说法不正确的是( )
A.Al2Cl6的结构式为B.Al2Cl6为非极性分子
C.该反应中NH3的配位能力大于氯D.Al2Br6比Al2Cl6更难与发生反应
【答案】D
【解析】A项,由双聚氯化铝分子中所有原子均满足8电子稳定结构可知,分子的结构式为,故A正确;B项,由双聚氯化铝分子中所有原子均满足8电子稳定结构可知,分子的结构式为,则双聚氯化铝分子为结构对称的非极性分子,故B正确;C项,由反应方程式可知,氨分子更易与具有空轨道的铝原子形成配位键,配位能力大于氯原子,故C正确;D项,溴元素的电负性小于氯元素,原子的原子半径大于氯原子,则铝溴键弱于铝氯键,所以双聚溴化铝的铝溴键更易断裂,比双聚氯化铝更易与氨气反应,故D错误;故选D。
3.(2025·浙江省宁波市镇海中学高三选考模拟)O2在超高压下转化为平行六面体的O8分子(如图)。下列说法错误的是( )
A.O2和O8互为同素异形体B.O8中存在不同的氧氧键
C.O2转化为O8是熵减反应D.常压低温下O8能稳定存在
【答案】D
【解析】A项,O2和O8是O元素形成的不同单质,两者互为同素异形体,A项正确;B项,O8分子为平行六面体,由其结构知,O8中存在两种氧氧键:上下底面中的氧氧键、上下底面间的氧氧键,B项正确;C项,O2转化为O8可表示为4O2O8,气体分子数减少,故O2转化为O8是熵减反应,C项正确;D项,O2在超高压下转化成O8,则在常压低温下O8会转化成O2,不能稳定存在,D项错误;故选D。
4.(2025·浙江省9+1高中联盟高三联考)Al(CH3)3常温常压下为液体,易燃易水解。下列说法不正确的是( )
A.Al(CH3)3结构简式为
B.Al(CH3)3与足量NaOH溶液反应生成白色沉淀和气体
C.Al(CH3)3着火后不可用泡沫灭火器灭火
D.A1(CH3)3可与AsH3形成配合物
【答案】B
【解析】A项,AlCl3中铝和氯形成3条共价键,推测三甲基铝的结构简式为,故A正确;B项,Al(CH3)3水解生成Al(OH)3和CH4,Al(OH)3与足量NaOH反应后生成Na[Al(OH)4],无白色沉淀生成,故B错误;C项,泡沫灭火器含有H2O,Al(CH3)3水解产生易燃气体CH4,不可用泡沫灭火器灭火,故C正确;D项,AsH3中As原子有孤对电子,Al的3p能级含有空轨道,因此AsH3可与Al原子形成配位键,故D正确;故选B。
5.(2025·浙江省NBchem联盟高三联考)共价型氢化物也称分子型氢化物。由氢和族元素所形成。其中与族元素形成的氢化物是缺电子化合物和聚合型氢化物,如乙硼烷B2H6,氢化铝(AlH3)n等。下列有关说法不正确的是( )
A.CCl4在水中不水解而SiCl4在水解水解的主要原因是具有轨道
B.(AlH3)n为平面分子,可以水解成H2与Al(OH)3
C.H2S中H-S键角大致93°,可以理解为S不杂化而成键,故酸性强于H2O
D.B2H6中B采取sp3杂化,分子中有B-H-B键存在
【答案】B
【解析】A项,CCl4中的碳原子是第二周期元素,只有2s和2p轨道可以成键,最大配位数为4,没有空轨道可以接受水的配位,因此不易发生水解。而SiCl4中的硅原子是第三周期元素,形成SiCl4后还有空的3d轨道,可以接受水分子中氧原子的孤电子对,形成配位键而发生水解,A正确;B项,(AlH3)n为聚合型氢化物,Al2H6的球棍模型为,所以(AlH3)n不是平面结构,其转化为H2和Al(OH)3时H元素化合价发生了变化,不是水解反应,B错误;C项,H2S中H-S键角大致93°,可以理解为S直接使用3p轨道和H的1s轨道重叠成键,键角仍是3p轨道的90°左右,H2O中O采取sp3杂化,键角105°左右,氧氢键更稳定,更难解离出H+,故酸性H2S强于H2O,C正确;D项,B2H6中B采取sp3杂化:,结构为,分子中有B-H-B键存在,D正确;故选B。
6.(2025·浙江省富阳中学高三选考模拟)一种含锡的多元金属硫化物的晶胞结构为四方晶系,已知金属原子均呈四面体配位,晶胞棱边夹角均为90°,其结构可看作是由两个立方体A、B上下堆叠而成。如图,甲为A的体对角线投影图,乙为B的沿y轴方向的投影图,A中Fe、Sn位置互换即为B,立方体A、B棱长均为a pm。下列说法正确的是( )
A.晶胞中Sn和Cu原子之间最短距离为
B.该晶胞密度为x
C.晶胞中部分原子的坐标为则晶胞中Sn的坐标可以表示为
D.晶体中Sn的价层成键电子对数与孤电子对数之比为2∶1
【答案】A
【解析】A项,该晶胞中,S原子位于晶胞的顶点和面心,Cu、Fe、Sn分别位于体对角线上,Sn和Cu原子间的最短距离为立方体面对角线长度的一半,为apm,A正确;B项,该晶胞中,S原子位于晶胞的顶点和面心,Cu、Fe、Sn分别位于体对角线上,根据均摊法可知,S个数为=4,Cu个数为2,Fe个数为1,Sn个数为1,因此该晶胞的密度为,B错误;C项,晶胞中部分原子的坐标S(,0,0)、Fe(,,),将立方体A、B都切割成8个小立方体,则Fe原子位于下层右下前小立方体体心,则下层的Sn位于左后下小立方体的体心,Sn的坐标可以为(,,),C错误;D项,晶体中距离Sn最近的S个数为4个,Sn与S形成4条单键,Sn价层没有孤电子对,D错误;故选A。
7.(2025·浙江省稽阳联谊学校高三联考)硫酸与氯气反应的生成物的结构如下图所示,有关说法不正确的是( )
硫酸 氯磺酸 硫酰二氯
A.沸点:硫酸氯磺酸硫酰二氯
B.氯磺酸在一定条件下可与苯发生取代反应生成氯苯
C.氯磺酸与足量NaOH溶液反应可生成两种钠盐
D.硫酰二氯可以脱去MgCl2·6H2O中的水制备无水氯化镁
【答案】B
【解析】A项,根据三种分子的结构,硫酸之间可以形成的氢键多,氯磺酸次之,硫酰二氯分子间不能形成氢键,故分子间作用力逐渐减小,所以沸点逐渐降低,A正确;B项,从电性上分析,氯磺酸中硫应该结合带负电荷的基团,而不是带正电荷的氢,则在一定条件下与苯发生取代反应不可能生成氯苯,B错误;C项,氯磺酸与足量NaOH溶液反应可生成氯化钠和硫酸钠两种钠盐,C正确;D项,硫酰二氯具有很强的吸水性,吸水生成硫酸和盐酸,可用于脱去金属氯化物中的水;硫酰二氯可以脱去MgCl2·6H2O中的水制备无水氯化镁:MgCl2·6H2O+3SO2Cl2=MgCl2+3H2SO4+6HCl,D正确;故选B。
8.(2025·浙江省金丽衢十二校高三第一次联考)Ga在电子工业中有广泛的应用,氯化物有GaCl3、GaCl2、Ga2Cl6等,实验证实GaCl3为共价化合物,GaCl2为离子化合物(含一种简单阳离子和一种复杂阴离子且基态阳离子中没有未成对电子),下列说法不正确的是( )
A.GaCl2中元素的化合价为价 B.GaCl2中阴离子的中心原子采用sp3杂化方式
C.GaCl3的熔点可能低于GaF3 D.Ga2Cl6中每个原子最外层均满足8电子稳定结构
【答案】A
【解析】A项,根据题意,基态镓原子电子排布式为1s22s22p63s23p63d104s24p1,GaCl2含有一种简单阳离子和一种复杂阴离子,且阳离子没有未成对电子,则阳离子为Ga+,阴离子为[GaCl4]-,则阳离子Ga的化合价为+1,阴离子Ga的化合价为+3,没有+2价,A错误;B项,由A项可知,阴离子为[GaCl4]-,该阴离子σ成键电子对数为4,孤对电子数为,则阴离子中心原子的杂化方式为sp3杂化,B正确;C项,氯化镓为共价化合物,属于分子晶体,F的电负性强于Cl,氟化镓为离子晶体,离子晶体熔点高于分子晶体,C正确;D项,Ga2Cl6为共价化合物,Ga与3个Cl共用电子对,Ga2Cl6以GaCl3的二聚体形式存在,结构中存在配位键,结构式为,因此每个原子最外层均满足8电子稳定结构,D正确;故选A。
9.(2025·浙江省嘉兴市高三基础测试)镓(Ga)常用作半导体的原料,能形成化合物Ga6I6,研究表明该物质由离子构成,其阴离子[Ga2I6]2-中所有原子的价层均有8个电子。以下说法不正确的是( )
A.镓和碘均位于元素周期表的p区
B.化合物Ga6I6中镓的化合价不止一种
C.[Ga2I6]2-的结构可以表示为
D.[Ga2I6]2-中Ga原子的杂化方式为sp3
【答案】C
【解析】镓与铝为同主族元素,因此镓应该至少连接三根共价键,阴离子[Ga2I6]2-中所有原子的价层均有8个电子,因此共用电子对=8-最外层电子数,但由于阴离子[Ga2I6]2-所带电荷为-2,相当于每个镓原子均已得到1个电子,则可知每个镓应该形成4根共价键,即四对共用电子对,因此[Ga2I6]2-的结构可以表示为:。A项,镓和碘分别均位于元素周期表的第IIIA族和第VIIA族,均位于元素周期表的p区,A正确;B项,化合物Ga6I6可写为:Ga4Ga2I6,根据阴离子[Ga2I6]2-的结构可知,镓与碘形成的是极性共价键,因此共用电子对均偏向碘,而镓之间形成的是非极性共价键,因此共用电子对无偏移,这就导致了[Ga2I6]2-中镓元素为+3价,镓元素常见的正价有+1价、+3价,结合阴离子所带电荷为-2,可知剩余的4个镓总的化合价应该为+2,因此含有2个Ga+和2个0价的Ga,综合可知Ga6I6中Ga元素的化合价有0、+1、+3价,不止一种,故B正确;C项,[Ga2I6]2-的结构可以表示为:,故C错误;D项,[Ga2I6]2-的结构可以表示为,Ga形成了4个价层电子对,因此Ga原子的杂化方式为sp3,故D正确;故选C。
10.(2025·浙江省名校协作体高三联考)三聚氰胺(已知分子内所有C、N原子共平面)结构如图所示,下列关于三聚氰胺的说法,不正确的是( )
A.分子中的为sp2杂化
B.分子中的原子均能与H2O形成分子间氢键
C.该物质可由尿素在一定条件下制得
D.三聚氰胺是非极性分子,不溶于水
【答案】AD
【解析】A项,分子中六元环上的N为sp2杂化,氨基中的N原子sp3杂化,故A错误;B项,N原子电负性大,分子中的N原子均能与H2O形成分子间氢键,故B正确;C项,尿素发生缩合反应可生成三聚氰胺,故C正确;D项,三聚氰胺能与水分子形成氢键,所以三聚氰胺易溶于水,故D错误;故选AD。
11.(2025·浙江部分高中高三开学考试)2023年诺贝尔化学奖颁发给量子点的发现与研究。其中巯基乙酸(HSCH2COOH)是量子点合成过程中的一种保护剂。下列说法不正确的是( )
A.亲水性:羧基(-COOH)>巯基(-SH)
B.酸性:巯基乙酸(HSCH2COOH)>乙酸(CH3COOH)
C.与量子点上的过渡金属离子配位的原子是S,结合后水溶性降低
D.与水分子形成的氢键强度:HSCH2CO-OH>HSCH2CS-OH>HSCH2CSe-OH
【答案】C
【解析】A项,羧基和巯基都具有亲水性,但羧基中的氧原子能够与水分子形成氢键,故亲水性:羧基(-COOH)>巯基(-SH),A正确;B项,硫基乙酸和巯基乙酸都是弱酸,但巯基乙酸中巯基和羧基均可电离出氢离子,故酸性:巯基乙酸(HSCH2COOH)>乙酸(CH3COOH),B正确;C项,-SH基团中的硫原子具有孤对电子,能够与过渡金属离子形成配位键,配位键将巯基乙酸引入量子点表面,可以增强量子点与水相之间的亲和性,从而使水溶性升高,C错误;D项,三种分子中均含有-OH,与-OH相连的碳原子分别与O原子、S原子、Se原子形成双键,电负性:O>S>Se,受三种原子的影响,三种分子与水分子形成的氢键强度:HSCH2CO-OH>HSCH2CS-OH>HSCH2CSe-OH,D正确;故选C。
12.(2025·江浙皖高中发展共同体高三月联考)下列有关SO2、SO3、SO42-、H2SO4的说法正确的是( )
A. SO2的空间构型为四面体
B. SO3分子中S采取sp3杂化方式
C.SO42-中的键角大于SO3中的键角
D.浓H2SO4中H2SO4分子间能形成氢键
【答案】D
【解析】A项,SO2的中心S原子的价层电子对数为=3,发生sp2杂化,则空间构型为平面三角形,A不正确;B项,SO3分子的中心S原子的价层电子对数为=3,采取sp2杂化方式,B不正确;C项,SO42-中心S原子的价层电子对数为=4,发生sp3杂化,SO3分子中S原子发生sp2杂化,则SO42-中的键角小于SO3中的键角,C不正确;D项,浓H2SO4的粘稠度大,表明分子间的作用力大,从而表明H2SO4分子间能形成氢键,D正确;故选D。
13.(2025·浙江省Z20名校联盟高三开学考试)加热煮沸的浓NaOH溶液和白磷反应可制PH3,该过程同时可获得P2H4。其中一个反应为:P4+3NaOH+3H2O=3NaHPO2+ PH3↑。下列说法不正确的是( )
A.热稳定性:NH3>PH3,沸点:N2H4<P2H4
B.P4、PH3与P2H4都是分子晶体
C.制备过程中有极性键、非极性键的断裂,也有极性键、非极性键的形成
D.已知PH3的配位能力比NH3强,这是由于PH3配体中的P存在3d空轨道
【答案】A
【解析】A项,N2H4分子能与水分子形成分子间氢键,增大其沸点,P2H4只存在范德华力,则沸点:N2H4>P2H4,故A项错误;B项,P4、PH3与P2H4都是由分子组成,只含有共价键,都是分子晶体,故B项正确;C项,反应过程中有水分子中的O-H极性键断裂、分子中的P-P非极性键的断裂,分子中有P-H极性键形成、P2H4分子中有P-P非极性共价键形成,故C项正确;D项,NH3利用N的孤电子对与过渡金属配位形成配位键,而PH3的中心原子P有空的d轨道,可以接受过渡金属d轨道上的电子形成配位键,使PH3与过渡金属生成的配合物更加稳定,因此与金属离子的配位能力NH3<PH3,故D项正确;故选A。
14.(2025·浙江省部分学校高三选考模拟)我国科学家利用高分辨原子力显微镜技术,首次拍摄到质子在水层中的原子级分辨图像,发现两种结构的水合质子,其中一种结构如图所示。下列有关该水合质子的说法正确的是( )
A.氢、氧原子间均以氢键结合 B.图中所有H-O-H键角都相同
C.氢、氧原子都处于同一平面 D.化学式为H9O4+
【答案】D
【解析】A项,在水分子内,氢、氧原子间以共价键相结合,在水分子之间,氢、氧原子间以氢键结合,A不正确;B项,在水分子中,O原子的最外层有2个孤电子对,它对成键电子对有较大的排斥作用,使水分子内H-O-H之间的键角减小,所以图中H-O-H键角不完全相同,B不正确;C项,在水分子中,O原子的价层电子对数为4,发生sp3杂化,价层电子对互斥模型呈四面体,则氢、氧原子不是都处于同一平面,C不正确;D项,从该水合质子图中可以看出,中间的微粒为H3O+,其他三个微粒都为H2O分子,所以化学式为H9O4+,D正确;故选D。
15.(2025·浙江省部分学校高三选考模拟)下列说法正确的是( )
A.键能:H-O>H-S,因此H2O的沸点高于H2S的沸点
B.原子轨道具有一定的伸展方向,所形成的共价键都具有方向性
C.杂化轨道可用于形成σ键和容纳未参与成键的孤电子对,不能用于形成π键
D.电负性越大,非金属性越强,第一电离能也越大
【答案】C
【解析】A项,H2O和H2S都形成分子晶体,沸点的高低受分子间作用力的影响,与分子内化学键的键能的大小无关,分子的稳定性受键能的影响,A不正确;B项,s轨道是球形对称的,没有伸展方向,s轨道与s轨道形成的共价键没有方向性,B不正确;C项,原子轨道中价电子所在轨道或与价电子所在轨道能量相近的轨道,可能全部发生杂化,也可能部分发生杂化,其中杂化轨道可用于形成σ键、容纳未参与成键的孤电子对,未杂化的p轨道可用于形成π键,C正确;D项,电负性越大,非金属性越强,但第一电离能不一定越大,如非金属性N<O,但第一电离能N>O,D不正确;故选C。
16.(2025·浙江省名校协作体三开学测试)在K2Cr2O7溶液中加入30%H2O2溶液,能得到紫色的KHCrO6溶液,继续加入稀硫酸,立即有蓝色的CrO5生成,该蓝色物质能被乙醚萃取,下列说法不正确的是( )
A.CrO5结构为:
B.CrO5在酸性溶液继续反应可能会生成O2
C.KHCrO6和CrO5均能氧化Na2SO3
D.CrO5与CrO5晶体类型不同,后者难以被乙醚萃取
【答案】A
【解析】A项,铬元素常见化合价+3、+6,氧元素常见化合价有-2价和-1价,则CrO5中铬元素的化合价为+6价,氧元素的化合价有-2价和-1价,设-2价O和-1价O的个数分别为x、y,则x+y=5、2x+y=6,解得x=1、y=4,说明分子中含有过氧键,结构式为,故A错误;B项,CrO5中含有-1价氧元素,其中含有过氧键,则酸性条件下CrO5能反应生成铬离子、氧气和水,故B正确;C项,KHCrO6、CrO5中铬元素都为+6价,都含有过氧键,都具有氧化性,所以都能与具有还原性的亚硫酸钠反应,故C正确;D项,KHCrO6中含钾离子,是含有离子键和共价键的离子晶体,由CrO5能被乙醚萃取可知,CrO5是分子晶体,所以CrO5与KHCrO6晶体类型不同,故D正确;故选A。
17.(2025·浙江省强基联高三联考)对金属材料中C、O、N、S的含量进行定性和定量分析,可以确定金属材料的等级。下列说法正确的是( )
A.半径:r(S2-)>r(O2-)>r(N3-)
B.沸点:H2O> H2S>NH3>CH4
C.键角:CH4>NH3>H2O> H2S
D.四种元素形成的单质的晶体类型一定相同
【答案】C
【解析】A项,S2-的核外电子排布为三层,O2-和N3-的核外电子排布相同,但只有两层,阴离子的电子层数越多则离子半径越大,但N的核电荷数小,核外电子层数相同时,原子序数越大半径越小,则半径大小为:r(S2-)>r(N3-)>r(O2-),A错误;B项,H2S、H2O、NH3、CH4均为分子晶体,而水分子、氨分子间均存在氢键,但相同状态下,水分子形成的氢键更多,且形成的氢键更稳定,因此水分子的沸点更高,CH4、H2S两者分子间不会形成氢键,沸点取决于分子质量大小,故H2S>CH4,因此沸点: H2O>NH3> H2S,B错误;C项,由于孤对电子数对成键电子对有较大的排斥力,所以孤对电子能使成键电子对彼此离得更近,键角被压缩而变小,通过计算孤对电子数,CH4、NH3、H2O、H2S的孤对电子数分别为0、1、2、2,由于水分子和硫化氢的孤对电子、杂化方式均相同,但中心原子电负性O>S,则键角H2O>H2S,故键角大小为CH4>NH3>H2O> H2S,C正确;D项,四种元素形成的单质中,氧气、氮气、硫单质均为分子晶体,但是金刚石属于原子晶体,D错误;故选C。
18.(2025·浙江省杭州市浙南联盟高三月联考)正高碘酸(H5IO6)为五元酸,具有强氧化性,弱酸性,易脱水。下列说法正确的是( )
A.正高碘酸的结构为
B.正高碘酸脱水可得到偏高碘酸HIO4,同浓度HIO4的酸性强于HBrO4
C.正高碘酸与反应后溶液呈紫红色,反应如下:8Mn2++5H5IO6+2H2O=8 MnO4-+5I-+29H+
D.正高碘酸隔绝空气加热分解仅生成I2O5、H2O
【答案】A
【解析】A项,正高碘酸为五元酸,分子中含有5个羟基,结构为,故A正确;B项,元素非金属性越强,最高价含氧酸的酸性越强,非金属性Br>I,所以HIO4的酸性弱于HBrO4,故B错误;C项,正高碘酸与Mn2+反应后溶液呈紫红色,说明Mn2+被氧化为MnO4-,MnO4-氧化性大于I-,所以还原产物不是I-,故C错误;D项,根据氧化还原反应规律,正高碘酸隔绝空气加热分解生成I2O5、H2O、O2,故D错误;故选A。
19.(2025·浙江省强基联盟高三月联考)Ca3SiO5是硅酸盐水泥的重要成分之一,其相关性质的说法不正确的是( )
A.金属离子以离子键与阴离子或阴离子骨架结合
B.具有吸水性,需要密封保存
C.能与SO2反应生成新盐
D.所有Si被Al取代则得到铝硅酸盐
【答案】D
【解析】A项,Ca3SiO5属于盐,含有离子键,金属离子以离子键与阴离子或阴离子骨架结合,A正确;B项,Ca3SiO5有吸水性,易板结,所以需要密封保存,B正确;C项,亚硫酸的酸性比硅酸强,当二氧化硫通入到Ca3SiO5溶液时,发生反应:3SO2+H2O+ Ca3SiO5=3CaSO3+H2SiO3,C正确;D项,部分Si被Al取代则得到铝硅酸盐,D错误; 故选D。
20.(2025·浙江省天域全国名校协作体高三联考)科学家合成了由氮原子组成的N5+、N5-等高能量微粒,它们的结构如图:
已知:N5+的5个N原子在同一平面上,属于V形结构;N5-属五元环结构,结构类似于苯;N8是立方结构;N10为两个五元环互相垂直连接。下列判断合理的是( )
A.N5AsF6与Na3AsO4中As化合价不同 B.N5-中N原子轨道杂化形式有sp2、sp3
C.N5+N5-属于离子化合物 D.N5-比N5+稳定
【答案】D
【解析】A项,N5AsF6 中含有N5-,F的化合价为-1,化合物中各元素的化合价代数和为零的原则,可以计算出As的化合价为+5,而在化合物Na3AsO4 中,Na的化合价为+1,O元素显-2价,根据化合物中各元素的化合价代数和为零的原则,可以计算出As的化合价为+5,A错误;B项,N5-属五元环结构,结构类似于苯,由其结构式可知,N原子的价层电子对数均为3,轨道杂化形式有sp2,B错误;C项,N5+N5-中只含有N元素,属于单质,不属于离子化合物,C错误;D项,N5-属五元环结构,结构类似于苯,具有稳定的化学性质,则N5-比N5+稳定,D正确;故选D。
21.(2025·浙江省新阵地教育联盟高三第一次联考)实验室将KF溶入18-冠-6 (结构如图1)的乙腈(CH3CN)溶液中可轻松实现氯的取代,反应过程如图2所示:
下列说法不正确的是( )
A.18-冠-6可循环使用
B.KF与18-冠-6形成的化合物熔点比KF低
C.KF与18-冠-6形成化合物的过程体现超分子自组装的特征
D.相同条件下,比更快被取代生成相应的氟化物
【答案】C
【解析】A项,18-冠-6是一种可以循环使用的化学物质,A正确;B项,KF与18-冠-6形成的化合物中阳离子半径更大,离子晶体熔点由离子所带电荷量及离子半径决定,电荷量越多,离子半径越小,熔点越高,B正确;C项,KF与18-冠-6形成化合物的过程体现超分子的分子识别特征,C错误;D项,中C-Br键较中C-Cl键更容易断裂,则相同条件下,用代替 参与上述反应,反应速率会加快,D正确; 故选C。
考点
三年考情分析
2025考向预测
原子、分子、晶体结构与性质
2024·浙江卷6月T14;2023·浙江卷1月T12;
预计2025年高考会以某种新的物质为情境考查原子、分子、晶体结构与性质
微粒
电子排布式
微粒
电子排布式
微粒
电子排布式
Fe
[Ar]3d64s2
Cu
[Ar]3d104s1
Mn
[Ar]3d54s2
Fe2+
[Ar]3d6
Cu+
[Ar]3d10
Mn2+
[Ar]3d5
Fe3+
[Ar]3d5
Cu2+
[Ar]3d9
Ti
[Ar]3d24s2
Cr
[Ar]3d54s1
Sc
[Ar]3d14s2
Ni
[Ar]3d84s2
Cr3+
[Ar]3d3
V
[Ar]3d34s2
C
[Ar]3d74s2
粒子
通式
价电子总数
立体构型
CO2、SCN-、NOeq \\al(+,2)、Neq \\al(-,3)、N2O、COS、CS2
AX2
16e-
直线形
COeq \\al(2-,3)、NOeq \\al(-,3)、SO3
AX3
24e-
平面三角形
SO2、O3、NOeq \\al(-,2)
AX2
18e-
V形
SOeq \\al(2-,4)、POeq \\al(3-,4)
AX4
32e-
正四面体形
POeq \\al(3-,3)、SOeq \\al(2-,3)、ClOeq \\al(-,3)
AX3
26e-
三角锥形
CO、N2、Ceq \\al(2-,2)
AX
10e-
直线形
CH4、NHeq \\al(+,4)
AX4
8e-
正四面体形
配合物的组成
[中心离子(配体)n][外界]
典型配合物
Cu(NH3)4SO4
Fe(SCN)3
Ag(NH3)2OH
中心离子
Cu2+
Fe3+
Ag+
中心离子结构特点
一般是金属离子,特别是过渡金属离子,必须有空轨道
配体
NH3
SCN-
NH3
配体结构特点
分子或离子,必须含有孤对电子(如NH3、H2O、CO、Cl-、SCN-等)
配位数(n)
4
3
2
外界
SO42-
无
OH-
颜色
深蓝色
血红色
无色
配离子所含化学键
配体通过配位键与中心离子结合
配合物所含化学键
配位键、离子键;配体或外界中可能还含有共价键
配合物的常见性质
属于离子化合物,多数能溶解、能电离,多数有颜色
金属羰基配合物
是过渡金属和一氧化碳配位形成的配合物,如四羰基镍[Ni(CO)4]。在许多有机化合物的合成反应中,金属羰基配合物常常作为这些反应的催化剂
二茂铁
二茂铁的结构为一个铁原子处在两个平行的环戊二烯的环之间。在固体状态下,两个茂环相互错开成全错位构型,温度升高时则绕垂直轴相对转动。二茂铁的化学性质稳定,类似芳香族化合物
晶体
晶体结构
晶体详解
原子
晶体
金刚石
(1)每个碳原子与4个碳原子以共价键结合,形成正四面体结构
(2)键角均为109°28'
(3)最小碳环由6个C组成且六原子不在同一平面内
(4)每个C参与4个C—C键的形成,C原子数与C—C键数之比为1∶2
SiO2
(1)每个Si与4个O以共价键结合,形成正四面体结构
(2)每个正四面体占有1个Si,4个“1/2O ”,n(Si)∶n(O)=1∶2
(3)最小环上有12个原子,即6个O,6个Si
分子
晶体
干冰
(1)8个CO2分子构成立方体且在6个面心又各占据1个CO2分子
(2)每个CO2分子周围等距紧邻的CO2分子有12个
离子
晶体
NaCl(型)
(1)每个Na+(Cl-)周围等距且紧邻的Cl-(Na+)有6个。每个Na+周围等距且紧邻的Na+有12个
(2)每个晶胞中含4个Na+和4个Cl-
CsCl(型)
(1)每个Cs+周围等距且紧邻的Cl-有8个,每个Cl-周围等距且紧邻的Cs+有8个
(2)如图为8个晶胞,每个晶胞中含1个Cs+、1个Cl-
金属
晶体
简单立方堆积
典型代表P,空间利用率52%,配位数为6
体心立方
堆积
典型代表Na、K、Fe,空间利用率68%,配位数为8
六方最密
堆积
典型代表Mg、Zn、Ti,空间利用率74%,配位数为12
面心立方
最密堆积
典型代表Cu、Ag、Au,空间利用率74%,配位数为12
相关试卷
这是一份重难点10有机物的结构与性质-2025年高考化学 热点 重点 难点 专练(浙江专用),文件包含重难点10有机物的结构与性质-2025年高考化学热点重点难点专练浙江专用原卷版docx、重难点10有机物的结构与性质-2025年高考化学热点重点难点专练浙江专用解析版docx等2份试卷配套教学资源,其中试卷共41页, 欢迎下载使用。
这是一份重难点07 化学实验基础-2025年高考化学 热点 重点 难点 专练(浙江专用),文件包含重难点07化学实验基础-2025年高考化学热点重点难点专练浙江专用原卷版docx、重难点07化学实验基础-2025年高考化学热点重点难点专练浙江专用解析版docx等2份试卷配套教学资源,其中试卷共77页, 欢迎下载使用。
这是一份重难点02 化学与STSE、传统文化-2025年高考化学 热点 重点 难点 专练(浙江专用),文件包含重难点02化学与STSE传统文化-2025年高考化学热点重点难点专练浙江专用原卷版docx、重难点02化学与STSE传统文化-2025年高考化学热点重点难点专练浙江专用解析版docx等2份试卷配套教学资源,其中试卷共17页, 欢迎下载使用。








