





沪科技版(2020)必修第一册元素周期表完美版课件ppt
展开1875年发现一种新元素,将其命名为镓(纪念法国)
并公布了所测镓的主要性质
您所说的镓就是我四年前所预言的“类铝”
它的比重应该为5.9左右
思考:门捷列夫是依靠什么规律神奇的预言镓的性质吗?
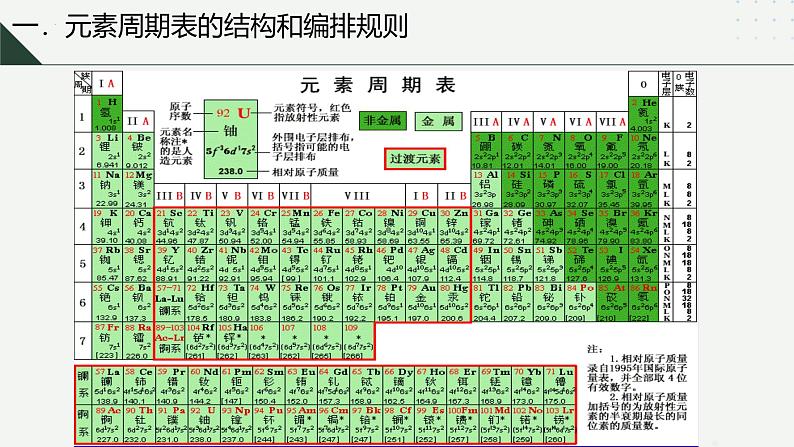
一.元素周期表的结构和编排规则
1.原子序数定义:按照元素在周期表中的 位置 给元素编号,得到原子序数。原子序数与元素的原子结构之间存在着如下关系: 原子序数=质子数=核电荷数=核外电子数 2.周期表编排规则:把电子层数相同的元素按照原子序数依次递增的顺序从左到右排列成一横行叫周期。把不同横行中最外层电子数相同的元素按照电子层数递增的顺序排列成纵行叫族。
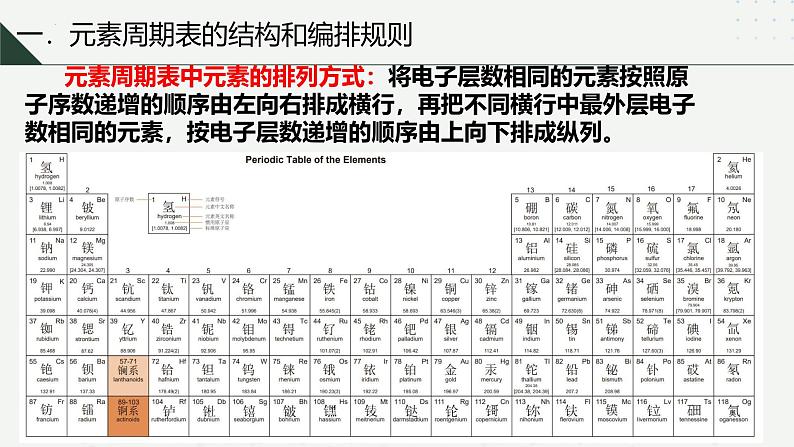
元素周期表中元素的排列方式:将电子层数相同的元素按照原子序数递增的顺序由左向右排成横行,再把不同横行中最外层电子数相同的元素,按电子层数递增的顺序由上向下排成纵列。
1.周期:元素周期表共有七个横行,每一横行称为一个周期,故元素周期表共有七个周期①周期序数与电子层数的关系:周期序数=核外电子层数 ②周期的分类 元素周期表中,我们把1、2、3周期称为短周期, 4、5、6、7 周期称为长周期。③周期数== 核外电子层数 ; 各周期元素从左向右都是原子序数依次递增;
2.族:元素周期表共有18个纵行,除了8、9、10三个纵行称为Ⅷ外,其余的每一个纵行称为一个族,故元素周期表共有16个族。族的序号一般用罗马数字表示。①族的分类 元素周期表中,我们把18个纵行共分为16个族,其中7个主族,7个副族,一个VIII族,一个0族。
①族的分类a.主族:由短周期元素和长周期元素共同构成的族,用A表示:ⅠA、 IIA 、 IIIA 、 IVA 、 VA 、 VIA 、VIIA b.副族:完全由长周期元素构成的族,用B表示:ⅠB、 IIB 、 IIIB 、 IVB 、 VB 、 VIB 、VIIB c.第Ⅷ族:8、9、10 三个纵行 d.零族:第18 纵行,即稀有气体元素
②主族序数与最外层电子数的关系: 主族序数=最外层电子数 各主族元素从上向下都是原子序数依次增大; ③族的别称ⅠA(除H外)称为碱金属元素 ⅡA称为碱土金属元素 ⅣA称为碳族元素 ⅤA称为氮族元素 ⅥA称为氧族元素 ⅦA称为卤族元素 副族和第Ⅷ族全部是金属元素;又称为过渡金属元素
七 A 七 B 0族 第VIII族
主族:由长周期元素和短周期元素共同组成的族 大写罗马数字加A
副族:完全由长周期元素组成的族 大写罗马数字加B(第Ⅷ族以外)
稀有气体元素化学性质不活泼,其化合价定为0,统称0族
思考与交流:随着原子序数的递增,元素原子的核外电子排布的变化规律是什么?
三.原子结构的周期性变化
思考与交流:随着原子序数的递增,元素原子的原子半径、化合价的变化规律是什么?
同周期由左向右元素的原子半径逐渐减小(不包括稀有气体)
说明:稀有气体元素的原子半径教材中没有列出,它跟邻近的非金属元素的原子相比显得特别大,这是由于测定稀有气体元素的原子半径的根据与其它元素的原子半径不同。
短周期主族元素中,原子半径最大的是哪种元素?
原子序数与原子半径线状图
随着原子序数的递增,原子半径呈现 周期性变化
原子序数与原子半径的关系
以原子序数为横坐标,原子半径为纵坐标,制作成折线图。请同学们从点(同主族元素)、线(同周期元素)、面(不同周期的变化趋势)三个层次进行数据分析,归纳规律 。
元素(除稀有气体外)的原子半径,
重复着由大到小的周期性变化
“原子半径”变化规律探讨
原子核对核外电子吸引力
1、比较 Na 与 Cl、Na 与 F 的原子半径大小?
r(Na)>r(Cl)
2、比较 Na+ 与 Cl−、Na+ 与 F− 的半径大小?
r(Na+)
r(Na)>r(Na+)
r(Cl)
元素化合价的变化规律:
正价:+1→+5,负价:-4 →-1
正价:+1→+7,负价:-4 →-1
同周期由左向右元素的最高正价逐渐升高(+1→+7,O和F无最高正价);元素的最低负价由ⅣA族的-4价逐渐升高至ⅦA族的-1价
“元素主要化合价”变化规律探讨
主族元素的最高正化合价,重复着由+1到+7的周期性变化
随着原子序数的递增(除氢、稀有气体),
主族元素的最高正化合价,重复着由+1到+7,
最低负化合价重复着由-4到-1的周期性变化
原子序数与最外层电子数、化合价的关系
结论1:随着原子序数的递增,原子的最外层电子数重复出现从___到___周期性变化。
结论2:随着核电荷数的递增,元素的主要化合价呈周期性变化。 最高正价由____到____递增,最低负价由____到____递增。
结论3:元素最高正价=最外层电子数=主族序数。
结论4:金属元素无负价;稀有气体元素化合价为0;非金属元素的最高正价+|最低负价|=8。
四.第三周期元素性质的递变
1. 钠、镁、铝的性质比较:
(1)概念既能与强酸反应又能与强碱反应,且均生成盐和水的氢氧化物。(2)氢氧化铝的两性①向AlCl3溶液中加入过量氨水,现象:产生白色沉淀;反应方程式:AlCl3+3NH3·H2O==3NH4Cl+Al(OH)3↓②向AlCl3溶液中逐滴加入NaOH溶液至过量,现象:先产生白色沉淀,后白色沉淀溶解,反应方程式:AlCl3+3NaOH==3NaCl+Al(OH)3↓ NaOH+Al(OH)3==NaAlO2+2H2O③向Al(OH)3沉淀中加入盐酸,发生反应的离子方程式: Al(OH)3+3H+===Al3++3H2O
3. 硅、磷、硫、氯的性质比较
(1)第三周期元素性质变化规律: 从Na Cl ,金属性逐渐 ,非金属性逐渐 。(2)同周期元素性质递变规律:从左 右,金属性逐渐 ,非金属性逐渐 。
1.碱金属元素原子结构
原子结构相似性: 递变性:
最外层电子数相同,都为1个。
从上到下,随着核电核数的增大,电子层数增多,原子半径增大。
我们知道物质的性质主要取决于原子的最外层电子数,从碱金属原子的结构可推知其化学性质是否完全相同?
相似性:最外层都只有一个电子,化学性质相似,很容易失去一个电子后呈+1价,活泼,有很强的还原性;递变性:从上到下,随着电子层数的增多,越来越容易失电子,还原性增强。
(1)与非金属的反应4Li + O2 2Li2O 2Na + O2 Na2O2K + O2 KO2K、Rb等碱金属与O2反应,会生成超氧化物。Rb、Cs在室温时,遇到空气会立即燃烧。(2)与水的反应2K + 2H2O = 2KOH + H2↑ 2Rb + 2H2O = 2RbOH + H2↑
(1)相似性:银白色固体、硬度小、密度小(轻金属)、熔点低、易导热、导电、有展性。(2)递变性(从锂到铯):①密度逐渐增大(K反常) ②熔点、沸点逐渐降低
【总结】与Na、K类似,其他碱金属元素也都可以和水反应生成相应的碱和H2。从上到下,与氧气、水的反应越来越剧烈,甚至发生爆炸。碱金属与水反应:2M+2H2O = 2MOH+H2↑ 碱性: LiOH
(1)卤素单质的颜色逐渐加深;(2)密度逐渐增大;(3)单质的熔、沸点升高(4)状态气态、液态、固态
1.卤族单质的物理性质
相似性: 递变性:
最外层电子数相同,都为7个。
2.卤族元素的原子结构
3.卤族元素的化学性质
1.卤素单质与氢气的反应卤素和H2的反应可用通式H2+X2= ____来表示,反应时按F2、Cl2、Br2、I2的顺序,反应条件越来越____,反应程度越来越____,形成的卤化氢的稳定性也依次________。2.卤素单质间的置换反应:2NaBr+Cl2=2NaCl+Br2 氧化性:Cl2____Br2 还原性:Cl-____Br-2NaI+Cl2 =2NaCl+I2 氧化性:Cl2 ____I2 还原性:Cl-____I-2NaI+Br2 =2NaBr+I2 氧化性:Br2 ____I2 还原性:Br-____I-
卤素单质随着原子核电荷数的递增,在物理性质和化学性质方面,均表现出一定的相似性和递变性。
元素周期表中,同主族元素从上到下原子核外电子层数依次增多,原子半径逐渐增大,得电子能力逐渐减弱,非金属性逐渐减弱。1.最高价氧化物对应水化物的酸性强弱;酸性:HClO4>HBrO4>HIO42.单质与氢气生成气态氢化物的难易程度;3.生成气态氢化物的稳定性;稳定性:HF>HCl>HBr>HI
【总结】同一主族元素性质具有一定的相似性和递变性;同一主族,从上到下:电子层数逐渐增多,原子半径逐渐增大,失电子能力逐渐 ,得电子能力渐 ,金属性逐渐 ,非金属性逐渐 ;
1.元素周期表中的分界
①从元素周期表的分区中可以看出,非金属性最强的是F,金属性最强的是Cs(放射性元素除外)。②金属元素和非金属元素分界线右侧都是非金属,但左侧的并不都是金属元素,如氢元素。③过渡元素都是金属元素,金属元素只有正价,没有负价。④处在金属元素和非金属元素分界线上下的元素单质并不一定是半导体。如Al是导体,B(硼)不导电。
高中化学沪科技版(2020)必修第一册自然界中的硫循环优秀ppt课件: 这是一份高中化学沪科技版(2020)必修第一册<a href="/hx/tb_c4025843_t3/?tag_id=26" target="_blank">自然界中的硫循环优秀ppt课件</a>,共38页。PPT课件主要包含了学习要点,课堂导入,知识梳理,●自然界中的硫循环,●自然界中的氮循环,●酸雨,课堂精练等内容,欢迎下载使用。
高中化学沪科技版(2020)必修第一册溴和碘的提取完整版ppt课件: 这是一份高中化学沪科技版(2020)必修第一册<a href="/hx/tb_c4025832_t3/?tag_id=26" target="_blank">溴和碘的提取完整版ppt课件</a>,共21页。PPT课件主要包含了学习要点,课堂导入,知识梳理,以免判断错误等内容,欢迎下载使用。
高中化学氧化剂和还原剂优质课件ppt: 这是一份高中化学<a href="/hx/tb_c4025826_t3/?tag_id=26" target="_blank">氧化剂和还原剂优质课件ppt</a>,共23页。PPT课件主要包含了学习要点,课堂导入,知识梳理,课堂精练等内容,欢迎下载使用。













