


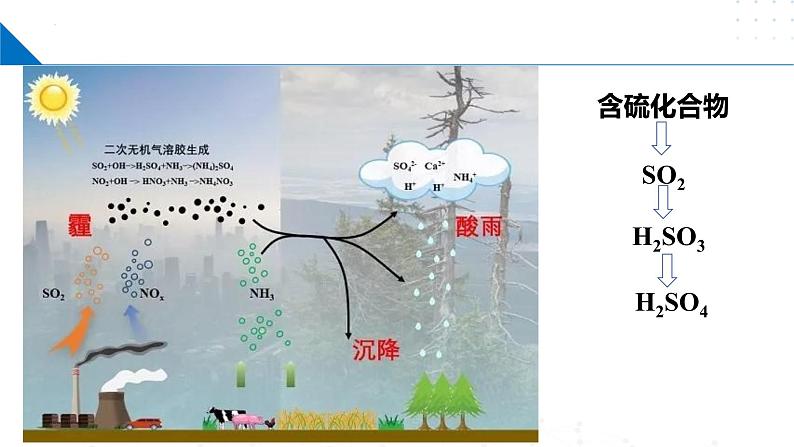

高中化学苏教版 (2019)必修 第一册第二单元 硫及其化合物的相互转化一等奖课件ppt
展开1.根据硫元素化合价会分析含硫物质的性质,并能设计实验实现不同价态硫元素的相互转化。2.利用不同类型化学反应的知识,研究物质之间相互转化的规律,能设计物质转化的方案。3.掌握氧化还原反应方程式的配平。
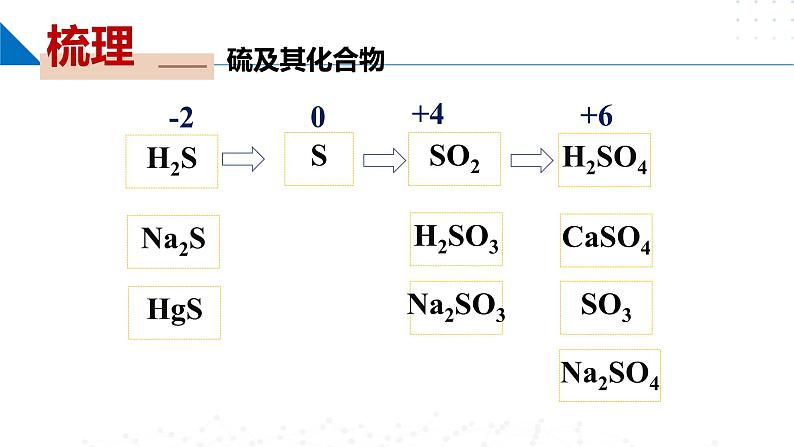
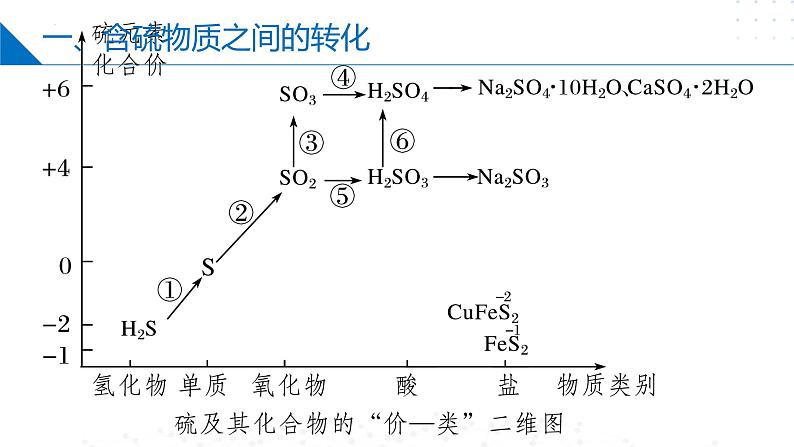
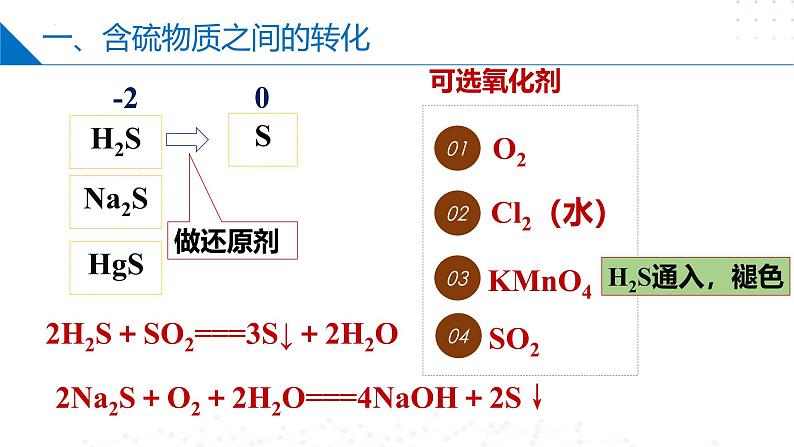
一、含硫物质之间的转化
通过氧化还原反应实现不同价态含硫物质的相互转化。
低价态的硫向高价态转化时需加入氧化剂,高价态的硫向低价态转化时需加入还原剂。
2H2S+SO2===3S↓+2H2O
2Na2S+O2+2H2O===4NaOH+2S↓
2Na2SO3+O2===2Na2SO4
1、当硫元素的化合价升高或降低时,一般升高或降低到其相邻的价态,即台阶式升降。
2、相邻价态的粒子不发生氧化还原反应:
如S和H2S、S和SO2、SO2和浓硫酸之间不发生氧化还原反应。
3、归中规律当硫元素的高价态粒子与低价态粒子反应时,一般生成中间价态。
如2H2S+SO2===3S↓+2H2O,2Na2S+Na2SO3+3H2SO4===3Na2SO4+3S↓+3H2O。
4、含硫物质的连续氧化规律
SO2+2NaOH===Na2SO3+H2O
SO3+H2O===H2SO4
SO3+2NaOH===Na2SO4+H2O
通过非氧化还原反应,可以实现相同价态含硫物质之间的转化。
Cu + 2H2SO4 = CuSO4 + SO2 ↑ + 2H2O
Na2SO3 + H2SO4 = Na2SO4+ SO2 ↑ + H2O
SO2+H2O ⇌ H2SO3
SO2+Ca(OH)2=CaSO3 ↓+H2O
2H2SO3+O2 = H2SO4
例1、物质的类别和核心元素的化合价是研究物质性质的两个重要角度。请根据下图所示,回答下列问题:
(1)X的化学式为 ,Y的化学式为 。(3)欲制备Na2S2O3,从氧化还原角度分析,下列选项中合理的是 (填序号)。 A.Na2S与S B.Na2SO3与SC.Na2SO3与Na2SO4 D.SO2与Na2SO4
(4)将X与SO2混合,可生成淡黄色固体。该反应的氧化产物与还原产物的质量之比为 。
KMnO4+ H2O2+ H2SO4=== MnSO4+ K2SO4+ O2↑+ H2O
以下那种配平是正确的?
二、氧化还原反应的配平
氧化剂和还原剂得失电子总数相等,化合价升高总数=化合价降低总数;
反应前后原子的种类和个数不变;
离子反应前后,所带电荷总数相等。
1.正向配平—— 先配氧化剂、还原剂的系数
①完全氧化还原反应:变价元素全部变
H2S + HNO3 —— H2SO4+ NO2 + H2O
+5
___HCl(浓)+___MnO2 ___Cl2↑+___MnCl2+___H2O
4 1 1 1 2
H2S + SO2 —— S ↓ + H2O
②归中反应:同一元素的高价与低价反应生成该元素的某 中间价态的反应
NaBr + NaBrO3 + H2SO4 —— Br2↑ + Na2SO4 + H2O
KMnO4+ H2C2O4+ H2SO4—— K2SO4 + MnSO4 + CO2↑+ H2O
2
KI+ KIO3+ H2SO4 —— I2+ K2SO4+ H2O
5 3 3 3 3
5
3
2
10
8
2. 逆向配平法——先配氧化产物、还原产物的系数
① 部分氧化还原反应:变价元素部分被氧化或部分被还原
Cu + HNO3(稀)— Cu(NO3)2+ NO↑ + H2O
②歧化反应:同种物质中同种价态的同种元素一部分被氧化、一部分被还原的反应称为歧化反应
S+ KOH —— K2SO3 + K2S + H2O
____Cl2+____KOH===____KCl+____KClO3+____H2O
3 6 5 1 3
某温度下,将 Cl2 通入 NaOH 溶液中,反应得到H2O、 NaCl、NaClO、NaClO3 的混合液,经测定,ClO-与ClO3-的浓度之比为1:3,写出该反应的化学反应方程式:
10Cl2+20NaOH=16NaCl+NaClO+3NaClO3+10H2O
某物质所含元素化合价同时升高或降低,或有升有降时,将该物质当作一个整体来计算化合价的变化数
Cu2S + HNO3 — Cu(NO3)2+ NO ↑+ H2SO4 + H2O
4、离子反应型方程式的配平
例6: H2O2+ MnO4-+ H+ — Mn2++ O2↑+ H2O
先配电子得失守恒,再配电荷守恒,最后配质量守恒。
ClO- + Fe2+ + H+ — Cl- + Fe3+ + H2O
2 2 2
2 16 10 2 5 8
MnO4- + H+ + Cl- — Mn2+ + Cl2↑ + H2O
S2O52- + I2+ H2O —— SO42- + I-+ H+
2 3 2 4 6
缺项是指某些反应物或生成物没有写出来,一般为水、酸或碱。
ClO3-+ Fe2+ + = + Fe3+ + .
工业上用NaClO3氧化酸性FeCl2废液得到FeCl3。
___Mn2++___ClO3-+___H2O===___MnO2↓+___Cl2+____
5 2 4 5 1 8H+
新情景下氧化还原反应方程式的书写
由新情景信息,据反应体系中物质书写反应方程式
例2 某厂废水中含KCN,其浓度为0.01 ml·L-1,现用氯氧化法处理,发生如下反应(化合物中N元素化合价均为-3):KCN+2KOH+Cl2===KOCN+2KCl+H2O(1)上述反应中被氧化的元素是________(用元素符号表示)。(2)加入过量液氯,可将氰酸盐进一步氧化为氮气,请配平下列化学方程式:
转化关系转化规律转化应用
配平原则配平方法正向配平、逆向配平、整体配平、离子反应型方程式的配平、缺项配平新情景下氧化还原反应方程式的书写
苏教版 (2019)必修 第一册第二单元 硫及其化合物的相互转化说课ppt课件: 这是一份苏教版 (2019)必修 第一册<a href="/hx/tb_c4002504_t3/?tag_id=26" target="_blank">第二单元 硫及其化合物的相互转化说课ppt课件</a>,共42页。PPT课件主要包含了课堂小结等内容,欢迎下载使用。
高中化学苏教版 (2019)必修 第一册第二单元 硫及其化合物的相互转化精品ppt课件: 这是一份高中化学苏教版 (2019)必修 第一册第二单元 硫及其化合物的相互转化精品ppt课件,共37页。PPT课件主要包含了学习目标,活动方案,课堂反馈等内容,欢迎下载使用。
化学必修 第一册第二单元 硫及其化合物的相互转化图文ppt课件: 这是一份化学必修 第一册第二单元 硫及其化合物的相互转化图文ppt课件,共26页。













