



苏教版 (2019)选择性必修1第三单元 金属的腐蚀与防护优质课ppt课件
展开1.通过实验科学探究金属腐蚀的本质及其原因,认识金属腐蚀的主要类型,能正确书写析氢腐蚀和吸氧腐蚀的电极反应式。2.通过认识金属腐蚀产生的危害和影响,树立防止金属腐蚀的意识,熟知金属腐蚀常用的防护方法。
金属腐蚀是指金属或合金与周围环境中的物质发生化学反应而腐蚀损耗的现象。
金属原子失电子被氧化,表示为:M-ne-=Mn+
金属被腐蚀后,在外形、色泽以及机械性能等方面都将发生变化,会使机器设备、仪器、仪表的精密度和灵敏度降低,影响使用以致报废。
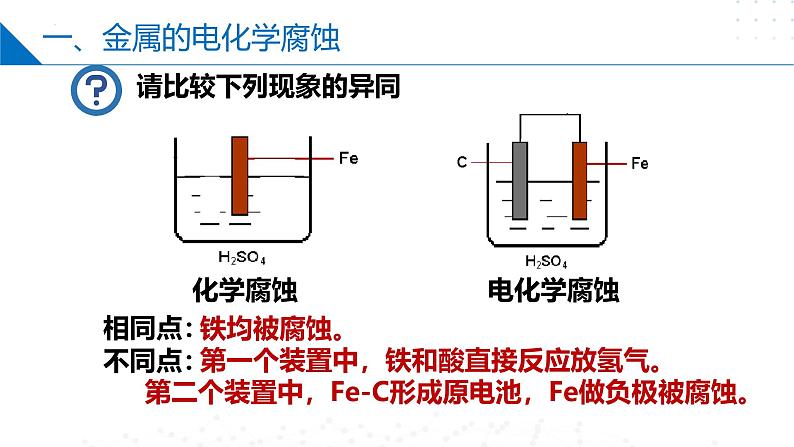
铁均被腐蚀。 第一个装置中,铁和酸直接反应放氢气。第二个装置中,Fe-C形成原电池,Fe做负极被腐蚀。
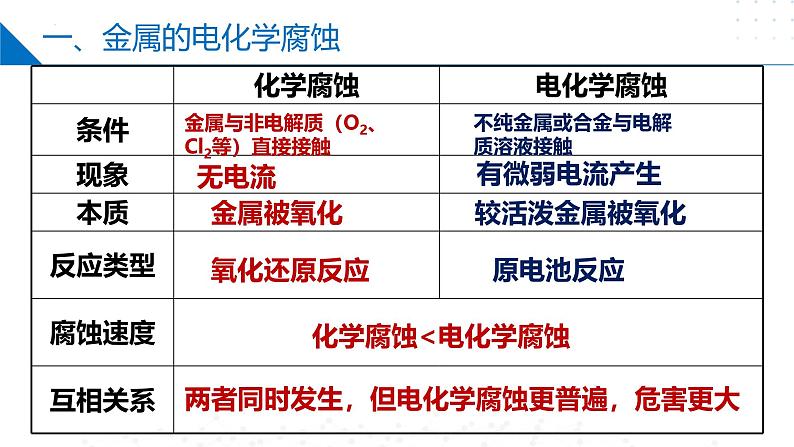
不纯金属或合金与电解质溶液接触
金属与非电解质(O2、Cl2等)直接接触
两者同时发生,但电化学腐蚀更普遍,危害更大
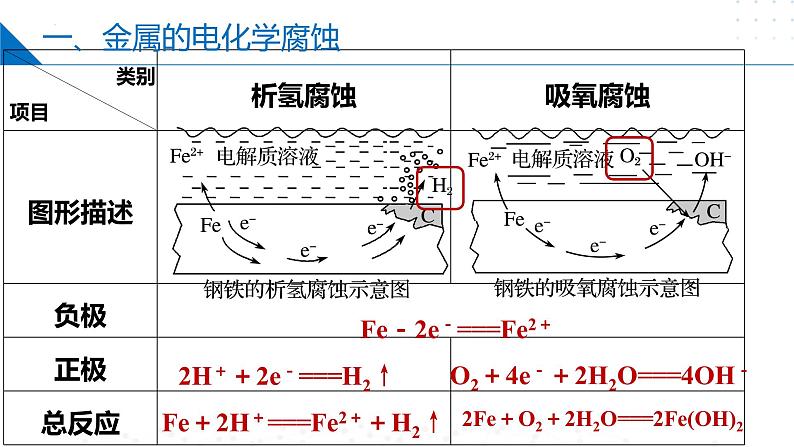
Fe-2e-===Fe2+
2H++2e-===H2↑
O2+4e-+2H2O===4OH-
Fe+2H+===Fe2++H2↑
2Fe+O2+2H2O===2Fe(OH)2
4Fe(OH)2+O2+2H2O=4Fe(OH)3
通常两种腐蚀同时存在,但后者更普遍
金属Al在空气中放置为什么不会锈蚀?金属Cu在潮湿空气中锈蚀生成铜绿[Cu2(OH)2CO3],其反应原理是什么?
金属铝在空气中放置,与空气中氧气反应,在表面形成一层致密的氧化膜,从而保护了内部金属不被腐蚀;铜在潮湿空气中锈蚀的原理为2Cu+H2O+O2+CO2===Cu2(OH)2CO3。
在铁的表面镀上一层其他金属是常见的防止铁生锈的方法,常见的有镀锡(马口铁)和镀锌(白铁皮),为什么镀层破损后,镀锌钢板(白铁皮)比镀锡钢板(马口铁)耐腐蚀?
镀层破损后,白铁皮形成原电池,因锌比铁活泼,易失去电子,从而保护了铁;而马口铁破损后,因为形成原电池时,铁比锡活泼,铁被腐蚀。所以在镀层破损后,马口铁比白铁皮更易被腐蚀。
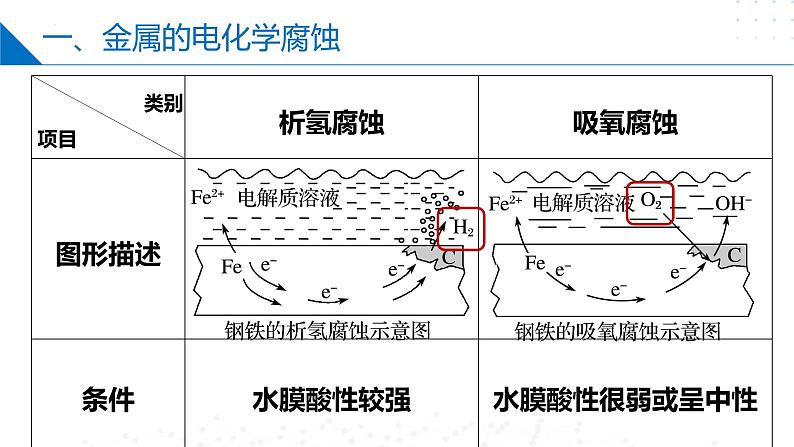
金属活动性顺序表中氢前面的金属,在酸性较强的电解质溶液中发生析氢腐蚀,在中性或酸性较弱的电解质溶液中发生吸氧腐蚀;金属活动性顺序在氢后面的金属只可能发生吸氧腐蚀。
钢铁发生析氢腐蚀或吸氧腐蚀时,负极都是铁,失电子生成Fe2+,而非Fe3+。
金属防护就是防止金属的腐蚀,要解决的主要问题是使金属不被氧化,应从金属腐蚀的化学反应原理、腐蚀的类型等方面来确定金属防护的具体方法。
金属的防护主要从金属、与金属接触的物质及两者反应的条件等方面来考虑。
例1 下列关于金属腐蚀和保护的说法正确的是( )A.牺牲阳极的阴极保护法利用的是电解池原理B.金属的化学腐蚀的实质是M-ne-===Mn+,即氧化剂失去电子C.外加电流的阴极保护法,被保护的金属与电源负极相连D.铜碳合金的铜像在酸雨中发生电化学腐蚀时,负极的电极反应式为O2+4e-+4H+===2H2O
在金属中添加其他金属或非金属制成性能优异的合金。如普通钢加入镍、铬制成不锈钢,钛合金不仅具有优异的抗腐蚀性能且具有良好的生物相容性。
在金属表面覆盖致密的保护层,从而使金属制品与周围物质(外界空气、水、电解质溶液等)隔离,这是一种被普遍采用的防护方法。
①非金属保护层:如喷油漆、涂油脂。②金属保护层:如铁制品上镀铜、锌等。
金属在发生电化学腐蚀时,总是作为原电池负极(阳极)的金属被腐蚀,作为正极(阴极)的金属不被腐蚀,如果能使被保护的金属成为阴极,就不易被腐蚀。
活泼性强的金属做负极,被保护金属做正极。
此法常用于保护海轮外壳及石油管道等。
更活泼的金属(如镁、锌等)作阳极(负极),在不断被腐蚀后定期更换,而作为阴极(正极)的金属就不易被腐蚀而得到保护。
被保护的金属与外接电源负极相连做阴极。
通电后,电子流向被保护的钢铁设备,在钢铁表面积累了大量的负电荷,从而抑制钢铁失去电子,阻止钢铁被腐蚀。
此主要用于防止土壤、海水及河水中金属设备的腐蚀。
电解原理引起的腐蚀 > 原电池原理引起的腐蚀 > 化学腐蚀>防腐措施的腐蚀
判断金属腐蚀快慢的规律
电解池的阳极>原电池的负极>化学腐蚀>原电池的正极>电解池的阴极
对同一种金属来说,腐蚀的快慢:强电解质溶液 > 弱电解质溶液 > 非电解质溶液
活泼性不同的两金属,活泼性差别越大,腐蚀越快。
对同一种电解质溶液来说,电解质溶液浓度越大,腐蚀越快。
例2 我国多条高压直流电线路的瓷绝缘子出现铁帽腐蚀现象,在铁帽上加锌环能有效防止铁帽的腐蚀,防护原理如图所示。下列说法错误的是( )A.通电时,锌环为阳极,发生氧化反应B.通电时,阴极上的电极反应:2H2O+2e-===H2↑+2OH-C.断电时,锌环上的电极反应:Zn2++2e-===ZnD.断电时,仍能防止铁帽被腐蚀
外加电流的阴极保护牺牲阳极的阴极保护法
1.硫酸盐还原菌SRB在地球上分布很广泛,通过多种相互作用发挥诸多潜力。但在水体中,会促使许多金属及合金发生腐蚀。某种Fe合金在硫酸盐还原菌存在条件下腐蚀的机理如图所示。对于该反应机理相关信息分析错误的是( )①升高温度有利于硫酸盐还原菌(SRB)对金属的腐蚀;②硫酸盐还原菌(SRB)对金属的腐蚀作用是在有氧环境下进行的;
③在硫酸盐还原菌(SRB)作用下,Fe腐蚀后最终会生成Fe2O3•xH2O;④电化学腐蚀中负极电极反应为 Fe-2e-===Fe2+;⑤当1 ml SO 在SRB的作用下转化为硫离子时,理论上正极反应会消耗8 ml水A.①②③B.①②⑤C.②③④D.②③⑤
苏教版 (2019)选择性必修1第二单元 化学能与电能的转化试讲课课件ppt: 这是一份苏教版 (2019)选择性必修1<a href="/hx/tb_c4009311_t3/?tag_id=26" target="_blank">第二单元 化学能与电能的转化试讲课课件ppt</a>,文件包含122化学能与电能的转化化学电源同步课件-2023-2024学年高二化学同步精品课堂苏教版2019选择性必修第一册pptx、1-化学铅蓄电池-480P清晰-AVC1mp4、1-两分钟带你看完200年的电池发展史-480P清晰-AVCmp4、1-新能源汽车锂离子电池原理揭秘-480P清晰-AVCmp4、1-氢燃料电池到底如何工作的-480P清晰mp4、两分钟带你看完200年的电池发展史1mp4、干电池原理mp4等7份课件配套教学资源,其中PPT共34页, 欢迎下载使用。
高中化学苏教版 (2019)选择性必修1专题1 化学反应与能量第一单元 化学反应的热效应试讲课ppt课件: 这是一份高中化学苏教版 (2019)选择性必修1<a href="/hx/tb_c4009310_t3/?tag_id=26" target="_blank">专题1 化学反应与能量第一单元 化学反应的热效应试讲课ppt课件</a>,共27页。PPT课件主要包含了长征五号,产生反应热,体系内能改变,恒压反应热,热化学方程式,物质变化,能量变化,课堂小结等内容,欢迎下载使用。
高中化学苏教版 (2019)选择性必修1专题1 化学反应与能量第三单元 金属的腐蚀与防护课文配套ppt课件: 这是一份高中化学苏教版 (2019)选择性必修1<a href="/hx/tb_c4009312_t3/?tag_id=26" target="_blank">专题1 化学反应与能量第三单元 金属的腐蚀与防护课文配套ppt课件</a>,共1页。













