


苏教版 (2019)选择性必修1第三单元 金属的腐蚀与防护优质ppt课件
展开金属原子失电子被氧化,表示为:M-ne-=Mn+
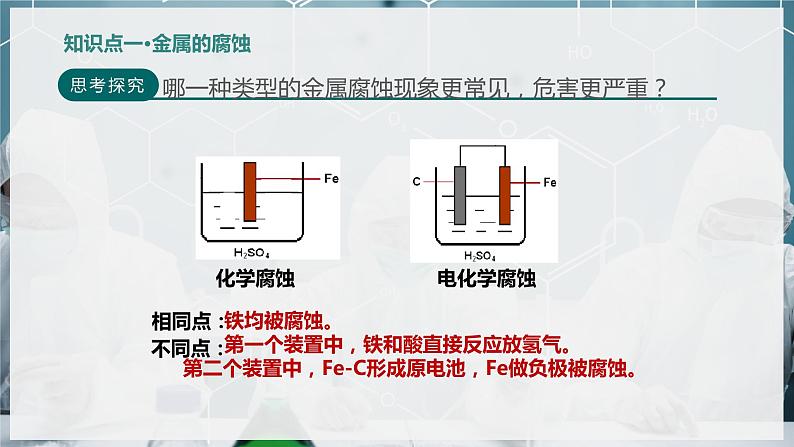
金属腐蚀是指 与周围环境中的物质发生 而腐蚀损耗的现象。
①化学腐蚀;②电化学腐蚀
铁均被腐蚀。 第一个装置中,铁和酸直接反应放氢气。第二个装置中,Fe-C形成原电池,Fe做负极被腐蚀。
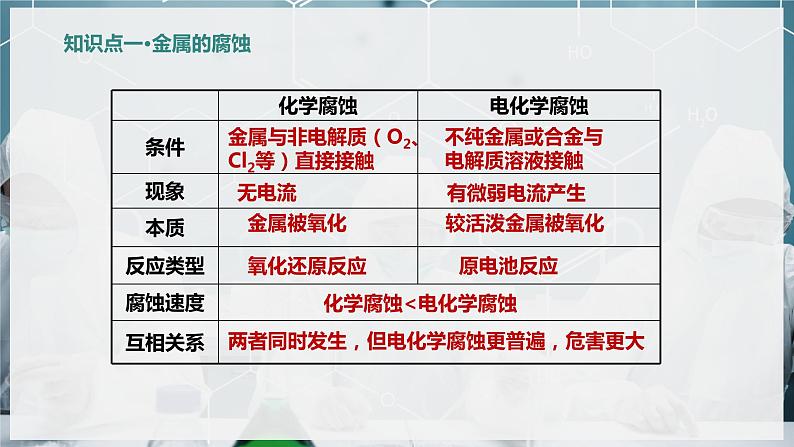
不纯金属或合金与电解质溶液接触
金属与非电解质(O2、Cl2等)直接接触
两者同时发生,但电化学腐蚀更普遍,危害更大
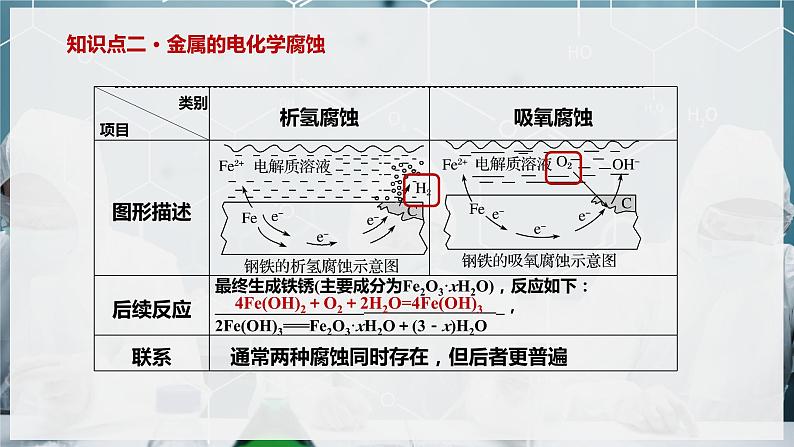
知识点二 · 金属的电化学腐蚀
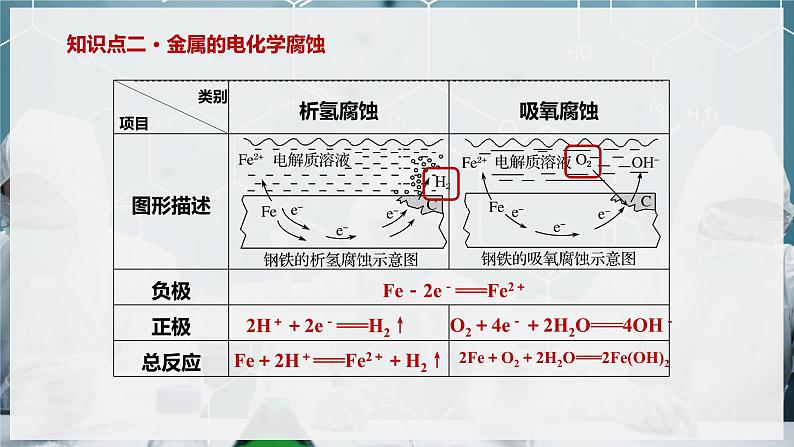
Fe-2e-===Fe2+
2H++2e-===H2↑
O2+4e-+2H2O===4OH-
Fe+2H+===Fe2++H2↑
2Fe+O2+2H2O===2Fe(OH)2
4Fe(OH)2+O2+2H2O=4Fe(OH)3
通常两种腐蚀同时存在,但后者更普遍
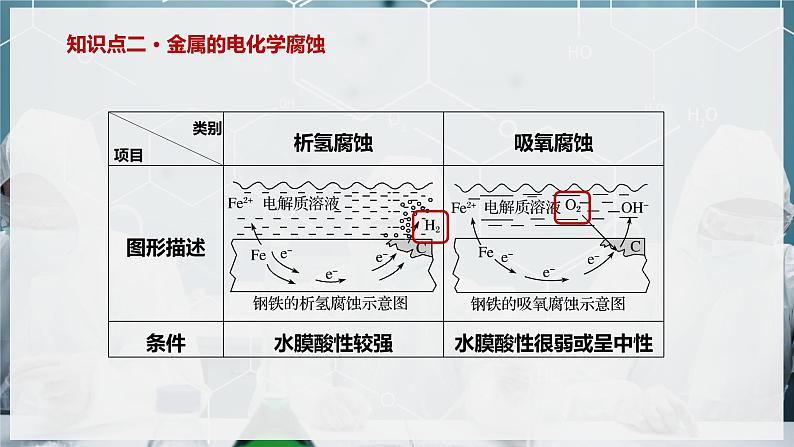
1.活泼金属在酸性较强的电解质溶液中发生析氢腐蚀,在中性或酸性很弱的电解质溶液中发生吸氧腐蚀;
2.金属活动性顺序在氢后面的金属只可能发生吸氧腐蚀。
3.钢铁发生析氢腐蚀或吸氧腐蚀时,负极都是铁,失电子生成Fe2+,而非Fe3+。
2.将铁粉和活性炭的混合物用NaCl溶液湿润后,置于如图所示装置中,进行铁的电化学腐蚀实验。下列有关该实验的说法正确的是( )A.铁被氧化的电极反应式为Fe-3e-==Fe3+B.铁腐蚀过程中化学能全部转化为电能C.活性炭的存在会加速铁的腐蚀D.以水代替NaCl溶液,铁不能发生吸氧腐蚀
知识点三 · 金属的防护方法
金属的防护主要从金属、与金属接触的物质及两者反应的条件等方面来考虑。
1.在金属的表面覆盖保护层2.电化学保护法3.改造金属组成或结构
如在钢铁表面 、 、 等。
1.在金属的表面覆盖保护层
使钢铁与 隔绝,以达到防治钢铁锈蚀的目的。
金属在发生电化学腐蚀时,总是作为原电池 (电解池 )的金属被氧化( )而腐蚀,作为原电池 (电解池 )的金属不被腐蚀。
①利用原电池原理;②利用电解池原理。
(1) 牺牲阳极的阴极保护法:
将被保护金属与比其更活泼的金属连接在一起,更活泼的金属(如镁、锌等)作 在不断被腐蚀后定期更换,而作为 的金属就不易被腐蚀而得到保护。
常用于保护海轮外壳及石油管道等。
将被保护的钢铁设备作为 ,另加惰性电极作为 ,两者都处在电解质溶液(如海水)中,接上外加直流电源。 通电后,电子流 被保护的钢铁设备,在钢铁表面积累了大量的负电荷,从而抑制钢铁失去电子,阻止钢铁被腐蚀。
(2)外加电流的阴极保护法:
用于防止土壤、海水及河水中金属设备的腐蚀。
金属腐蚀快慢的判断方法
电解原理引起的腐蚀 > 原电池原理引起的腐蚀 > 化学腐蚀>防腐措施的腐蚀
③电解原理引起的腐蚀
②原电池原理引起的腐蚀
2.同一种金属在不同介质中:
强电解质溶液>弱电解质溶液>非电解质溶液
3.活泼性不同的两种金属:
活泼性差别越大,腐蚀越快
4.同一种电解质溶液中:
电解质溶液浓度越大,腐蚀越快(钝化除外)
3.如图所示的各容器中均盛有海水,铁在其中被腐蚀时由快到慢的顺序是( )
A.④>②>③>①B.②>①>③>④C.④>②>①>③D.③>②>④>①
如在金属中添加其他元素形成耐蚀合金等。
3.改变金属的组成或结构
如普通钢加入镍、铬制成不锈钢,钛合金不仅具有优异的抗腐蚀性能且具有良好的生物相容性。
1.专题一测试卷,周四上午第一节课后上交2.预习《2.1.1化学反应速率》
高中第三单元 金属的腐蚀与防护完整版ppt课件: 这是一份高中第三单元 金属的腐蚀与防护完整版ppt课件,共12页。PPT课件主要包含了金属的腐蚀,吸氧腐蚀,正极活泼性较弱金属,正极反应物氧气,中性或弱酸性,正极反应物氢离子,析氢腐蚀,酸性较强等内容,欢迎下载使用。
高中化学苏教版 (2019)选择性必修1专题1 化学反应与能量第三单元 金属的腐蚀与防护说课课件ppt: 这是一份高中化学苏教版 (2019)选择性必修1专题1 化学反应与能量第三单元 金属的腐蚀与防护说课课件ppt,共53页。PPT课件主要包含了学习目标,核心素养,新课导入,活动探究,思考交流,知识梳理,名师点拨,巩固练习,吸收水蒸气,3电化学防护法等内容,欢迎下载使用。
高中化学苏教版 (2019)选择性必修1第三单元 金属的腐蚀与防护教学演示课件ppt: 这是一份高中化学苏教版 (2019)选择性必修1第三单元 金属的腐蚀与防护教学演示课件ppt,共41页。PPT课件主要包含了NO1,NO2,NO3,点击右图进入等内容,欢迎下载使用。













