

- 2.1 共价键课件PPT 课件 3 次下载
- 2.2.1 分子结构的测定和多样性 价层电子对互斥模型课件PPT 课件 3 次下载
- 2.3.1 共价键的极性课件PPT 课件 3 次下载
- 3.1 物质的聚集状态与晶体的常识(习题课)课件PPT 课件 3 次下载
- 3.1 物质的聚集状态与晶体的常识课件PPT 课件 3 次下载
高中化学人教版 (2019)选择性必修2第二节 分子的空间结构教学ppt课件
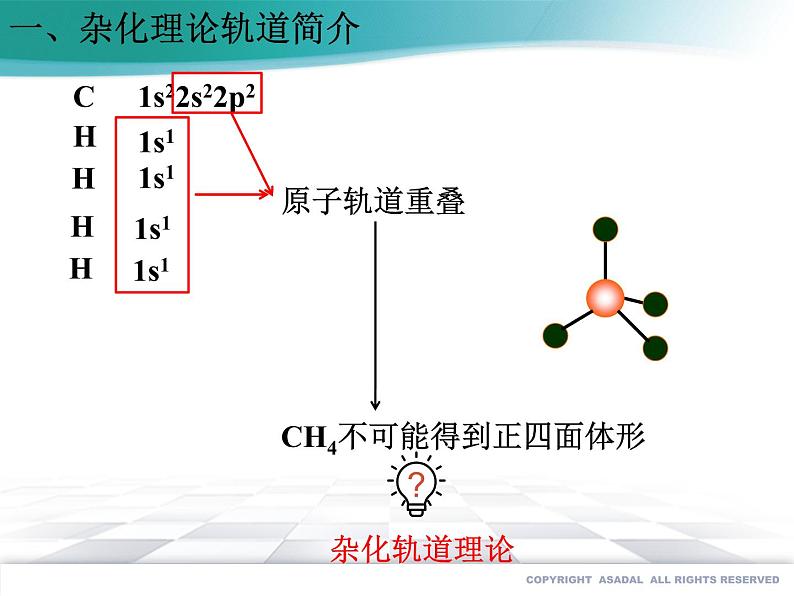
展开CH4不可能得到正四面体形
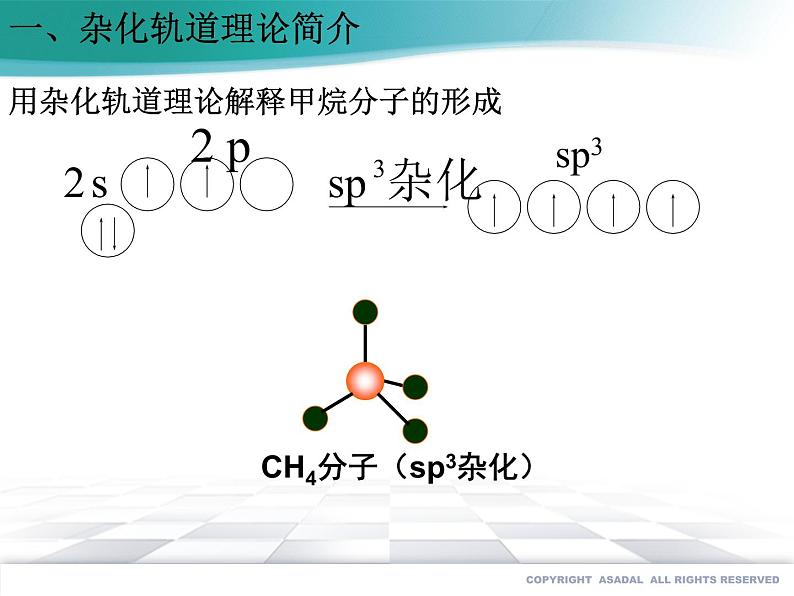
用杂化轨道理论解释甲烷分子的形成
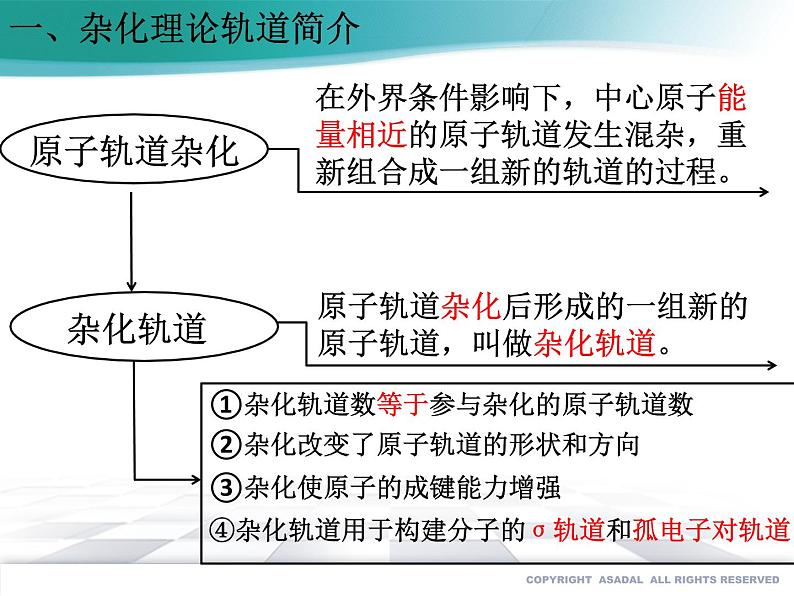
在外界条件影响下,中心原子能量相近的原子轨道发生混杂,重新组合成一组新的轨道的过程。
原子轨道杂化后形成的一组新的原子轨道,叫做杂化轨道。
①杂化轨道数等于参与杂化的原子轨道数
②杂化改变了原子轨道的形状和方向
③杂化使原子的成键能力增强
④杂化轨道用于构建分子的σ轨道和孤电子对轨道
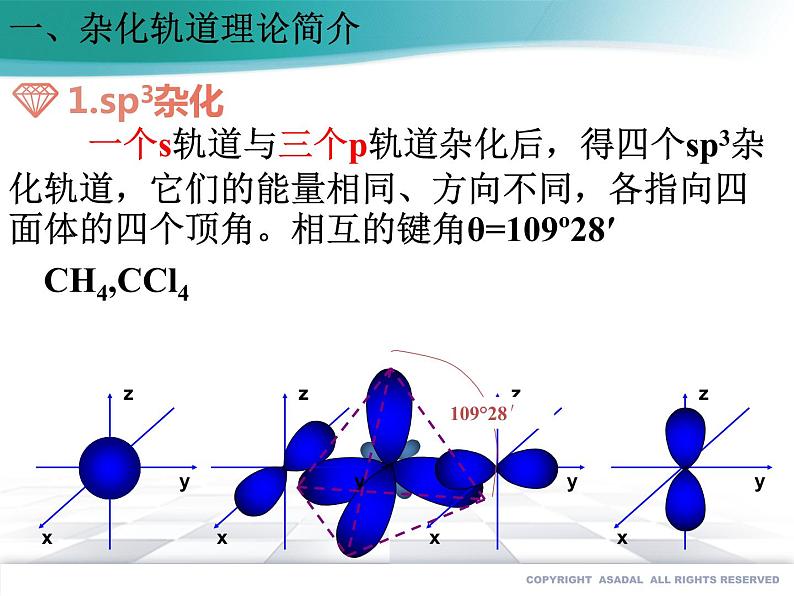
一个s轨道与三个p轨道杂化后,得四个sp3杂化轨道,它们的能量相同、方向不同,各指向四面体的四个顶角。相互的键角θ=109º28′ CH4,CCl4
价层电子对互斥模型
H2O和NH3的VSEPR模型与CH4一样,四面体形
H2O和NH3的中心原子采取sp3的杂化
2个杂化轨道被σ电子对占据2个杂化轨道被孤电子对占据
3个杂化轨道被σ电子对占据1个杂化轨道被孤电子对占据
杂化轨道用于构建分子的σ轨道和孤电子对轨道
一个s轨道与两个p轨道杂化,得三个sp2杂化轨道,三个杂化轨道在空间分布是在同一平面上,互成120ºSO2 BF3
未参与杂化的p轨道可用于形成π键
一个s轨道与一个p轨道杂化后,得两个sp杂化轨道,杂化轨道之间的夹角为180度。 CO2 BeCl2
中心原子孤对电子对数+中心原子结合的原子数
杂化轨道理论解释微粒的立体构型
=中心原子的价层电子对数
高中第二节 分子的空间结构集体备课课件ppt: 这是一份高中第二节 分子的空间结构集体备课课件ppt,共18页。PPT课件主要包含了课前导入,CH4的形成,杂化轨道理论简介,杂化轨道类型,杂化类型判断方法等内容,欢迎下载使用。
化学选择性必修2第二节 分子的空间结构集体备课课件ppt: 这是一份化学选择性必修2第二节 分子的空间结构集体备课课件ppt,共27页。PPT课件主要包含了激发态,杂化轨道,杂化轨道理论,杂化条件,杂化轨道特征,1SP3杂化,孤电子对,σ键单电子,pxpy杂化,π键单电子等内容,欢迎下载使用。
人教版 (2019)选择性必修2第二节 分子的空间结构教课ppt课件: 这是一份人教版 (2019)选择性必修2第二节 分子的空间结构教课ppt课件,共31页。PPT课件主要包含了平面三角形,非极性,sp2,sp3,四面体形,K+和P3-等内容,欢迎下载使用。













