





还剩11页未读,
继续阅读
成套系列资料,整套一键下载
- 人教版 (新课标)选修4 化学反应原理 1.1 化学反应与能量的变化(第1课时 焓变 反应热) 课件 课件 0 次下载
- 人教版 (新课标)选修4 化学反应原理 1.1 化学反应与能量的变化(第2课时 热化学方程式) 课后练习 课件 0 次下载
- 人教版 (新课标)选修4 化学反应原理 1.1 化学反应与能量的变化(第3课时 中和反应的反应热及其测量) 课后练习 课件 0 次下载
- 人教版 (新课标)选修4 化学反应原理 1.1 化学反应与能量的变化(第3课时 中和反应的反应热及其测量) 课件 课件 0 次下载
- 人教版 (新课标)选修4 化学反应原理 2.1 化学反应速率 课后练习 课件 0 次下载
人教版 (新课标)选修4 化学反应原理 1.1 化学反应与能量的变化(第2课时 热化学方程式) 课件
展开
这是一份人教版 (新课标)选修4 化学反应原理 1.1 化学反应与能量的变化(第2课时 热化学方程式) 课件,共19页。
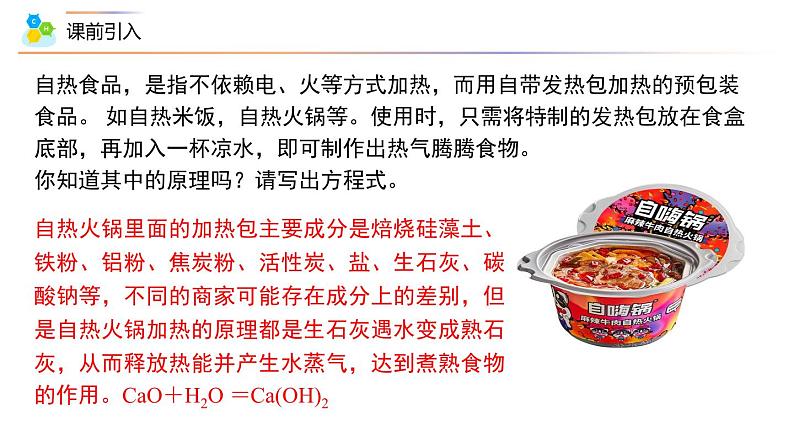
自热食品,是指不依赖电、火等方式加热,而用自带发热包加热的预包装食品。 如自热米饭,自热火锅等。使用时,只需将特制的发热包放在食盒底部,再加入一杯凉水,即可制作出热气腾腾食物。你知道其中的原理吗?请写出方程式。自热火锅里面的加热包主要成分是焙烧硅藻土、铁粉、铝粉、焦炭粉、活性炭、盐、生石灰、碳酸钠等,不同的商家可能存在成分上的差别,但是自热火锅加热的原理都是生石灰遇水变成熟石灰,从而释放热能并产生水蒸气,达到煮熟食物的作用。CaO+H2O =Ca(OH)2 组织建设第一节 化学反应与能量的变化(第2课时 热化学方程式 )第一章 化学反应与能量1.定义:既表示化学反应中的物质变化,又能表示能量变化的化学方程式。 表示1mol气态H2与1mol气态碘完全反应,生成2mol气态HI时,放出14.9kJ的热量。200℃101kPa物质变化能量变化2.意义:既表示化学反应中的物质变化,也表明化学反应中的能量变化。二、热化学方程式 【小试牛刀】下列关于2C4H10(g)+13O2(g)=8CO2(g)+10H2O(l) ΔH=-5 800 kJ·mol-1的叙述错误的是( ) A.该反应的反应热ΔH=-5 800 kJ·mol-1,是放热反应 B.该反应的ΔH与各物质的状态有关,与化学计量数也有关 C.该热化学方程式表示在25 ℃、101 kPa下,2 mol C4H10气体完全燃烧生成CO2气体和液态水时放出热量5 800 kJ D.该反应表明2 mol丁烷燃烧时一定会放出5 800 kJ的热量D深度思考:1.比较①②两个方程式,(1)属于热化学方程式的是____。②(2)热化学方程式与化学方程式相比较,有哪些不同之处?①指明了反应时的温度和压强。②在化学方程式右边注明ΔH的“+”“-”数值和单位。③所有反应物和生成物都用括号注明它们在反应时的状态。(1)正确写出配平的化学方程式;(2)注明反应物和生成物的状态:固(s)、液(l)、气(g)、溶液(aq)、同素异形体用中文注明如:C(s,金刚石);能量高低s<l<g;3.热化学方程式的书写2H2(g)+O2(g) = 2H2O(g) ∆H=-483.2kJ/mol 2H2(g)+O2(g) = 2H2O(l) ∆H=-571.6kJ/mol (4)在等号上注明反应的温度和压强(若不注明则表示在298K(25℃)、101kPa下) (反应条件如:高温、加热、催化剂及“↑和↓”不用注明)(3)方程式右端空一格标明反应的焓变△H(注意单位和+或-,不可省略)2.下面是25 ℃、101 kPa下的四个热化学方程式,对比分析回答下列问题:(1)①②相比,反应热(焓变)数值不同的原因是____________________。(2)②③相比,若化学方程式的计量数扩大一倍,则反应热___________________________。(3)①④相比,可得出的结论是正逆反应的焓变数值_____,符号_____。产物中水的状态不同数值扩大一倍,符号不变相同相反深度思考:4.书写热化学方程式注意事项(1)热化学方程式中各物质的计量数不表示分子或微粒个数,只表示物质的量,因此可以是整数或分数; (2)对于相同物质发生的反应,化学计量数不同时,△H 也不同,即△H 的值与计量数成正比(或△H必须与化学方程式一一对应);(3)若反应逆向进行,其ΔH与正反应ΔH数值相等,符号相反;(4)可逆反应中的△H是指正反应完全进行时的反应热。N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ/mol如果提供 1molN2(g)+3molH2(g) 充分反应,因为生成 NH3(g)________2mol,所以放出的热量________92.4 kJ反应热ΔH -92.4 kJ/mol 例如:小于小于等于一个反应的反应热大小与参与反应物质的“量”、物质的状态有关;ΔH只与书写的方程式有关!1. 1molC与1molH2O(g)反应生成1molCO(g)和1molH2(g),需吸收131.5kJ的热量,该反应的热化学方程式为 ΔH=+131.5 kJ·mol-1C(s)+H2O(g)=CO(g)+H2(g)【小试牛刀】热化学方程式书写练习2. 2mol N2(g) 与适量O2(g) 反应生成NO2 (g),需吸收136kJ的热量;写出热化学方程式。N2(g)+2O2(g)=2NO2 (g) ∆H=+68 kJ/mol2N2(g)+4O2(g)=4NO2 (g) ∆H=+136 kJ/mol3. 1mol Cu(s) 与适量O2(g) 起反应生成CuO (s),放出157kJ的热量;写出热化学方程式。2Cu(s)+O2(g)=2CuO (s) ∆H=-314 kJ/molCu(s)+0.5O2(g)=CuO (s) ∆H=-157 kJ/mol方法指导热化学方程式正误判断的方法25 ℃、101 kPa时,0.5 mol CH4完全燃烧生成CO2气体和液态H2O时,放出455 kJ的热量。判断下列几个热化学方程式的正误,错误的指出错误的原因。①CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-445 kJ·mol-1( )__________________________________②2CH4(g)+4O2(g)===2CO2(g)+4H2O(l) ΔH=+890 kJ·mol-1( )___________________________③CH4+2O2===CO2+2H2O ΔH=-890 kJ·mol-1( )____________________________④CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-890 kJ·mol-1( )××√×反应热的数值与方程式计量数不对应CH4燃烧为放热反应,ΔH<0未注明反应物和生成物的状态【小试牛刀】判断正误,并说明理由。1 . 已知在25℃、101kPa下,1gC8H18(辛烷)燃烧生成二氧化碳和液态水时放出48.40kJ 热量。表示上述反应的热化学方程式正确的是( ) A. C8H18(l)+25/2O2(g)=8CO2(g)+9H2O(g) △H=-48.40kJ·mol-1 B. C8H18(l)+25/2O2(g)=8CO2(g)+9H2O(l) △H=-5518kJ·mol-1 C. C8H18(l)+25/2O2(g)=8CO2(g)+9H2O(l) △H=+5518kJ·mol-1 D. C8H18(l)+25/2O2(g)=8CO2(g)+9H2O(l) △H=-48.40kJ·mol-1B2 . 实验测得:101 kPa时,1 mol H2完全燃烧生成液态水,放出285.8 kJ的热量;1 mol CH4完全燃烧生成液态水和CO2,放出890.3 kJ的热量。下列热化学方程式的书写正确的是( )①CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=+890.3 kJ·mol-1②CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1③CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1④2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1 A.仅有① B.仅有②④ C.仅有② D.全部符合要求B3. 同温、同压下,比较Q1与Q2的大小和△H1与△H2的大小:S(g)+O2(g)=SO2(g); △H1=-Q1 kJ/mol(Q1>0)S(s)+O2(g)=SO2(g); △H2=-Q2 kJ/mol(Q2>0)Q1>Q2;△H1<△H24. 同温、同压下,比较Q1与Q2的大小和△H1与△H2的大小:2H2(g)+O2(g)=2H2O(g); △H1=-Q1 kJ/mol(Q1>0)2H2(g)+O2(g)=2H2O(l); △H2=-Q2 kJ/mol(Q2>0)Q1<Q2;△H1>△H25.根据所给信息,书写对应的热化学方程式(1)已知1 mol C(石墨,s)与适量H2O(g)反应生成CO(g)和H2(g),吸收131.3 kJ热量,请写出该反应的热化学方程式:________________________________________________(2)11.2 L(标准状况)H2在足量Cl2中燃烧生成HCl气体,放出91.5 kJ热量,其热化学方程式:_______________________________________________。(3)已知4.4 g CO2气体与足量H2经催化生成CH3OH气体和水蒸气时放出4.95 kJ的热量,其热化学方程式为:_________________________________________________。 C(石墨,s)+H2O(g)═CO(g)+H2(g);△H=-48.40kJ·mol-1 H2(g)+Cl2(g)═2HCl(g);△H=-183kJ·mol-1 CO2(g)+3H2(g)═CH3OH(g)+H2O(g);△H=-49.5kJ·mol-1更多精彩内容请登录:https://www.zxxk.com/organ/413/本课结束
自热食品,是指不依赖电、火等方式加热,而用自带发热包加热的预包装食品。 如自热米饭,自热火锅等。使用时,只需将特制的发热包放在食盒底部,再加入一杯凉水,即可制作出热气腾腾食物。你知道其中的原理吗?请写出方程式。自热火锅里面的加热包主要成分是焙烧硅藻土、铁粉、铝粉、焦炭粉、活性炭、盐、生石灰、碳酸钠等,不同的商家可能存在成分上的差别,但是自热火锅加热的原理都是生石灰遇水变成熟石灰,从而释放热能并产生水蒸气,达到煮熟食物的作用。CaO+H2O =Ca(OH)2 组织建设第一节 化学反应与能量的变化(第2课时 热化学方程式 )第一章 化学反应与能量1.定义:既表示化学反应中的物质变化,又能表示能量变化的化学方程式。 表示1mol气态H2与1mol气态碘完全反应,生成2mol气态HI时,放出14.9kJ的热量。200℃101kPa物质变化能量变化2.意义:既表示化学反应中的物质变化,也表明化学反应中的能量变化。二、热化学方程式 【小试牛刀】下列关于2C4H10(g)+13O2(g)=8CO2(g)+10H2O(l) ΔH=-5 800 kJ·mol-1的叙述错误的是( ) A.该反应的反应热ΔH=-5 800 kJ·mol-1,是放热反应 B.该反应的ΔH与各物质的状态有关,与化学计量数也有关 C.该热化学方程式表示在25 ℃、101 kPa下,2 mol C4H10气体完全燃烧生成CO2气体和液态水时放出热量5 800 kJ D.该反应表明2 mol丁烷燃烧时一定会放出5 800 kJ的热量D深度思考:1.比较①②两个方程式,(1)属于热化学方程式的是____。②(2)热化学方程式与化学方程式相比较,有哪些不同之处?①指明了反应时的温度和压强。②在化学方程式右边注明ΔH的“+”“-”数值和单位。③所有反应物和生成物都用括号注明它们在反应时的状态。(1)正确写出配平的化学方程式;(2)注明反应物和生成物的状态:固(s)、液(l)、气(g)、溶液(aq)、同素异形体用中文注明如:C(s,金刚石);能量高低s<l<g;3.热化学方程式的书写2H2(g)+O2(g) = 2H2O(g) ∆H=-483.2kJ/mol 2H2(g)+O2(g) = 2H2O(l) ∆H=-571.6kJ/mol (4)在等号上注明反应的温度和压强(若不注明则表示在298K(25℃)、101kPa下) (反应条件如:高温、加热、催化剂及“↑和↓”不用注明)(3)方程式右端空一格标明反应的焓变△H(注意单位和+或-,不可省略)2.下面是25 ℃、101 kPa下的四个热化学方程式,对比分析回答下列问题:(1)①②相比,反应热(焓变)数值不同的原因是____________________。(2)②③相比,若化学方程式的计量数扩大一倍,则反应热___________________________。(3)①④相比,可得出的结论是正逆反应的焓变数值_____,符号_____。产物中水的状态不同数值扩大一倍,符号不变相同相反深度思考:4.书写热化学方程式注意事项(1)热化学方程式中各物质的计量数不表示分子或微粒个数,只表示物质的量,因此可以是整数或分数; (2)对于相同物质发生的反应,化学计量数不同时,△H 也不同,即△H 的值与计量数成正比(或△H必须与化学方程式一一对应);(3)若反应逆向进行,其ΔH与正反应ΔH数值相等,符号相反;(4)可逆反应中的△H是指正反应完全进行时的反应热。N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ/mol如果提供 1molN2(g)+3molH2(g) 充分反应,因为生成 NH3(g)________2mol,所以放出的热量________92.4 kJ反应热ΔH -92.4 kJ/mol 例如:小于小于等于一个反应的反应热大小与参与反应物质的“量”、物质的状态有关;ΔH只与书写的方程式有关!1. 1molC与1molH2O(g)反应生成1molCO(g)和1molH2(g),需吸收131.5kJ的热量,该反应的热化学方程式为 ΔH=+131.5 kJ·mol-1C(s)+H2O(g)=CO(g)+H2(g)【小试牛刀】热化学方程式书写练习2. 2mol N2(g) 与适量O2(g) 反应生成NO2 (g),需吸收136kJ的热量;写出热化学方程式。N2(g)+2O2(g)=2NO2 (g) ∆H=+68 kJ/mol2N2(g)+4O2(g)=4NO2 (g) ∆H=+136 kJ/mol3. 1mol Cu(s) 与适量O2(g) 起反应生成CuO (s),放出157kJ的热量;写出热化学方程式。2Cu(s)+O2(g)=2CuO (s) ∆H=-314 kJ/molCu(s)+0.5O2(g)=CuO (s) ∆H=-157 kJ/mol方法指导热化学方程式正误判断的方法25 ℃、101 kPa时,0.5 mol CH4完全燃烧生成CO2气体和液态H2O时,放出455 kJ的热量。判断下列几个热化学方程式的正误,错误的指出错误的原因。①CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-445 kJ·mol-1( )__________________________________②2CH4(g)+4O2(g)===2CO2(g)+4H2O(l) ΔH=+890 kJ·mol-1( )___________________________③CH4+2O2===CO2+2H2O ΔH=-890 kJ·mol-1( )____________________________④CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-890 kJ·mol-1( )××√×反应热的数值与方程式计量数不对应CH4燃烧为放热反应,ΔH<0未注明反应物和生成物的状态【小试牛刀】判断正误,并说明理由。1 . 已知在25℃、101kPa下,1gC8H18(辛烷)燃烧生成二氧化碳和液态水时放出48.40kJ 热量。表示上述反应的热化学方程式正确的是( ) A. C8H18(l)+25/2O2(g)=8CO2(g)+9H2O(g) △H=-48.40kJ·mol-1 B. C8H18(l)+25/2O2(g)=8CO2(g)+9H2O(l) △H=-5518kJ·mol-1 C. C8H18(l)+25/2O2(g)=8CO2(g)+9H2O(l) △H=+5518kJ·mol-1 D. C8H18(l)+25/2O2(g)=8CO2(g)+9H2O(l) △H=-48.40kJ·mol-1B2 . 实验测得:101 kPa时,1 mol H2完全燃烧生成液态水,放出285.8 kJ的热量;1 mol CH4完全燃烧生成液态水和CO2,放出890.3 kJ的热量。下列热化学方程式的书写正确的是( )①CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=+890.3 kJ·mol-1②CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1③CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1④2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1 A.仅有① B.仅有②④ C.仅有② D.全部符合要求B3. 同温、同压下,比较Q1与Q2的大小和△H1与△H2的大小:S(g)+O2(g)=SO2(g); △H1=-Q1 kJ/mol(Q1>0)S(s)+O2(g)=SO2(g); △H2=-Q2 kJ/mol(Q2>0)Q1>Q2;△H1<△H24. 同温、同压下,比较Q1与Q2的大小和△H1与△H2的大小:2H2(g)+O2(g)=2H2O(g); △H1=-Q1 kJ/mol(Q1>0)2H2(g)+O2(g)=2H2O(l); △H2=-Q2 kJ/mol(Q2>0)Q1<Q2;△H1>△H25.根据所给信息,书写对应的热化学方程式(1)已知1 mol C(石墨,s)与适量H2O(g)反应生成CO(g)和H2(g),吸收131.3 kJ热量,请写出该反应的热化学方程式:________________________________________________(2)11.2 L(标准状况)H2在足量Cl2中燃烧生成HCl气体,放出91.5 kJ热量,其热化学方程式:_______________________________________________。(3)已知4.4 g CO2气体与足量H2经催化生成CH3OH气体和水蒸气时放出4.95 kJ的热量,其热化学方程式为:_________________________________________________。 C(石墨,s)+H2O(g)═CO(g)+H2(g);△H=-48.40kJ·mol-1 H2(g)+Cl2(g)═2HCl(g);△H=-183kJ·mol-1 CO2(g)+3H2(g)═CH3OH(g)+H2O(g);△H=-49.5kJ·mol-1更多精彩内容请登录:https://www.zxxk.com/organ/413/本课结束
相关资料
更多









