





还剩13页未读,
继续阅读
成套系列资料,整套一键下载
人教版 (新课标)选修4 化学反应原理 第一章 化学反应与能量(章末复习PPT)
展开
这是一份人教版 (新课标)选修4 化学反应原理 第一章 化学反应与能量(章末复习PPT),共21页。
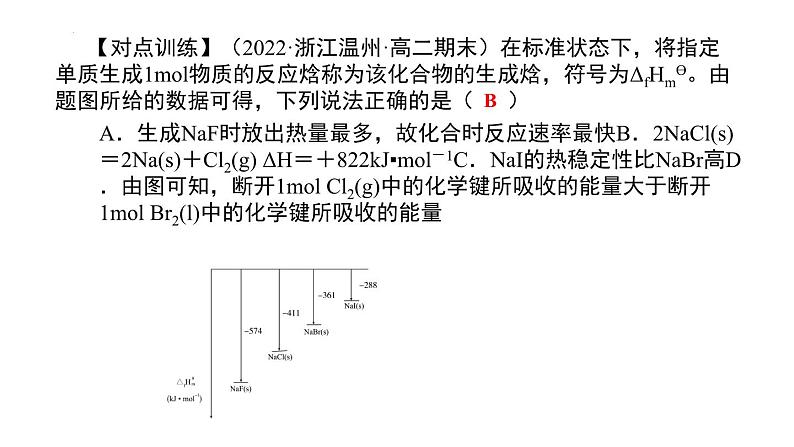
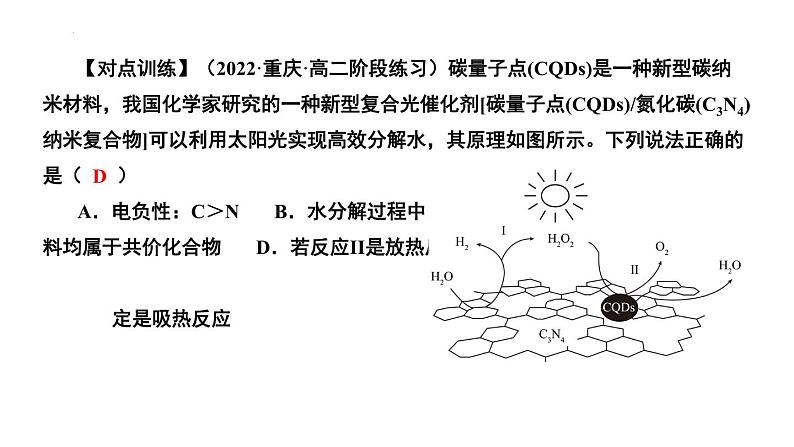
组织建设第一章 化学反应与能量章末归纳与整理知识网络体系重点知识探究一、化学反应的热效应和键能的关系 在化学反应中,从反应物分子变为生成物分子,各原子间结合方式发生了改变。在这个过程中,反应物分子中的化学键部分或全部遭到破坏,生成物分子中的新化学键形成了。在破坏旧化学键时,需要能量来克服原子间的相互作用。在形成新化学键时,由于原子间的相互作用而放出能量。化学反应的热效应来源于反应过程中断裂旧化学键并形成新化学键时的能量变化。 化学键键能的大小可粗略计算化学反应的热效应:ΔH=反应物的键能总和-生成物的键能总和。【例题1】根据如图能量关系示意图,下列说法正确的是( ) A.1molC(s)与1molO2(g)的能量之和为393.5kJ B.反应2CO(g)+O2(g)=2CO2(g)中,生成物的总能量大于反应物的总能量 C.由C(s)→CO(g)的热化学方程式为:2C(s)+O2(g)=2CO(g) ΔH=-221.2kJ·mol-1 D.热值指一定条件下单位质量的物质完全燃烧所放出热量,则CO热值ΔH=-10.1kJ·mol-1 C 【对点训练】(2022·浙江温州·高二期末)在标准状态下,将指定单质生成1mol物质的反应焓称为该化合物的生成焓,符号为ΔfHmϴ。由题图所给的数据可得,下列说法正确的是( )A.生成NaF时放出热量最多,故化合时反应速率最快B.2NaCl(s)=2Na(s)+Cl2(g) ΔH=+822kJ▪mol-1C.NaI的热稳定性比NaBr高D.由图可知,断开1mol Cl2(g)中的化学键所吸收的能量大于断开1mol Br2(l)中的化学键所吸收的能量 B 【对点训练】(2022·重庆·高二阶段练习)碳量子点(CQDs)是一种新型碳纳米材料,我国化学家研究的一种新型复合光催化剂[碳量子点(CQDs)/氮化碳(C3N4)纳米复合物]可以利用太阳光实现高效分解水,其原理如图所示。下列说法正确的是( ) A.电负性:C>N B.水分解过程中,H2O2作催化剂 C.两种纳米材料均属于共价化合物 D.若反应II是放热反应,则反应I一 定是吸热反应D二、热化学方程式的正误判断 热化学方程式是表示参加反应物质的量与反应热的关系的化学方程式。热化学方程式的书写除了遵循书写化学方程式的要求外,应侧重从以下几个方面予以检查。 (1)检查ΔH符号的正误:放热反应的ΔH为“-”或“<0”,吸热反应的ΔH为“+”或“>0”,单位是kJ·mol-1,逆反应的ΔH与正反应的ΔH数值相同,符号相反。 (2)检查是否注明物质的聚集状态:必须注明每种反应物和生成物的聚集状态,同一个化学反应,物质的聚集状态不同,ΔH数值不同。二、热化学方程式的正误判断 热化学方程式是表示参加反应物质的量与反应热的关系的化学方程式。热化学方程式的书写除了遵循书写化学方程式的要求外,应侧重从以下几个方面予以检查。 (3)检查ΔH的数值与化学计量数是否对应:ΔH的大小与反应物的物质的量的多少有关,相同的反应,化学计量数不同时,ΔH不同。 (4)特殊反应热:①书写表示燃烧热的热化学方程式时,可燃物的化学计量数为1;产物应为完全燃烧生成稳定的氧化物,如C燃烧应生成CO2而不是CO,H2燃烧生成的是H2O(l),而不是H2O(g)。②书写表示中和热的热化学方程式时,H2O的化学计量数为1,并以此配平其余物质的化学计量数 【例题2】(2022·浙江宁波·高二期末)在25℃和101kPa下,1gH2燃烧生成液态水放出akJ(a>0)的热量,则下列热化学方程式书写正确的是( )C 【对点训练】(2021·重庆实验外国语学校高二阶段练习)下列有关热化学方程式的评价合理的是( )D 【对点训练】(2022·广西·钦州一中高二期中)实验测得:101 kPa时,1 mol H2完全燃烧生成液态水,放出285.8 kJ的热量;1 mol CH4完全燃烧生成液态水和CO2,放出890.3 kJ的热量。下列热化学方程式书写正确的是( ) A.2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1 B.CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890.3 kJ C.CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1 D.CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=890.3 kJ·mol-1 A三、盖斯定律在反应热计算中的应用 化学反应的反应热只与反应的始态(各反应物)和终态(各生成物)有关,而与反应的途径无关。即如果一个反应可以分步进行,则各分步反应的反应热之和与该反应一步完成时的反应热是相同的。如: ΔH=ΔH1+ΔH2 。 【注意】求总反应的反应热,不能不假思索地将各步反应的反应热简单相加。不论一步进行还是分步进行,始态和终态完全一致,盖斯定律才成立。某些物质只是在分步反应中暂时出现,最后应该恰好消耗完。 【例题4】(2022·辽宁·高二阶段练习)用H2O2和H2SO4的混合溶液可溶出废旧印刷电路板上的铜。已知: ①Cu(s)+2H+(aq)=Cu2+(aq)+H2(g) △H1=+64.3kJ·mol-1 ②2H2O2(l)=2H2O(l)+O2(g) △H2=-196.1kJ·mol-1 ③H2(g)+O2(g)=H2O(l) △H3=-285.8kJ·mol-1 在H2SO4溶液中,1molCu(s)与H2O2(l)反应生成Cu2+(aq)和H2O(l)的反应热△H等于( ) A.+546.7kJ·mol-1 B.-17.9kJ·mol-1 C.-118.5kJ·mol-1 D.-319.55kJ·mol-1D 【对点训练】(2022·浙江·乐清市知临中学高二期中)CaO和BaO的能量关系如图所示(M=Ca、Ba); 已知:离子电荷相同时,半径越小,离子键越强。下列说法正确的是( )DC四、反应热大小的比较 比较反应热的大小,一般从以下几个方面考虑: (1)比较“反应热”或ΔH的大小时,必须带“+”“-”符号;比较“燃烧热”“中和热”时,只需比较数值大小即可。 (2)参加反应的物质的量不同,则反应热的数值也会发生相应的变化,如1 mol H2完全燃烧生成液态水时放出285.8 kJ的热量,2 mol H2完全燃烧生成液态水时则放出571.6 kJ的热量。 (3)对于可逆反应,如3H2(g)+N2(g) 2NH3(g)ΔH=-92.4 kJ·mol-1,是指生成2 mol NH3时放出92.4 kJ的热量,而不是3 mol H2和1 mol N2混合,在一定条件下反应就可放出92.4 kJ的热量,实际3 mol H2和1 mol N2混合,在一定条件下反应放出的热量小于92.4 kJ,因为该反应的反应物不能完全转化为生成物。 比较反应热的大小,一般从以下几个方面考虑: (4)同一反应中物质的聚集状态不同,反应热数值大小也不同。例如,S(g)+O2(g)=SO2(g) ΔH1=-Q1 kJ·mol-1;S(s)+O2(g)=SO2(g) ΔH2=-Q2 kJ·mol-1可以理解成固态硫变成气态硫后再发生变化,而由固态到气态是需要吸收能量的,所以Q1>Q2、ΔH1<ΔH2,故当同一反应中只由于聚集状态不同比较反应热的大小时,反应物为固态时放出的热量少,当生成物为固态时放出的热量多。 (5)中和热为稀溶液中强酸和强碱生成1 mol H2O时的反应热。若酸为浓硫酸时,由于浓硫酸溶解放热,此时生成1 mol H2O放出热量大于57.3 kJ。若为弱酸或弱碱时,因为电离过程吸热,此时生成1 mol H2O放出的热量小于57.3 kJ。四、反应热大小的比较 【例题4】(2022·浙江·效实中学高二期中)已知强酸与强碱在稀溶液里反应的中和热可表示为H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ·mol-1。现有下列反应:NH3·H2O(aq)+HCl(aq)=NH4Cl(aq)+H2O(l) ΔH10.5H2SO4(浓)+NaOH(aq)=0.5Na2SO4(aq)+H2O(l) ΔH2HNO3(aq)+NaOH(aq)=NaNO3(aq)+H2O(l) ΔH3 上述反应均在溶液中进行,则下列ΔH1、ΔH2、ΔH3的关系正确的是( ) A.ΔH2>ΔH3>ΔH1 B.ΔH1>ΔH3>ΔH2 C.ΔH1=ΔH2=ΔH3 D.ΔH2=ΔH3>ΔH1 B 【对点训练】(2022·全国·高三专题练习)MgCO3和CaCO3的能量关系如图所示(M=Ca、Mg): 已知:离子电荷相同时,半径越小,离子键越强。下列说法不正确的是( ) A.ΔH1(MgCO3)>ΔH1(CaCO3)>0 B.ΔH2(MgCO3)=ΔH2(CaCO3)>0 C.ΔH1(CaCO3)-ΔH1(MgCO3)=ΔH3(CaO)-ΔH3(MgO) D.对于MgCO3和CaCO3,ΔH1+ΔH2>ΔH3 C 【对点训练】强酸和强碱稀溶液的中和热可表示为H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1, 已知: ①HCl(aq)+NH3·H2O(aq)=NH4Cl(aq)+H2O(l) ΔH=-a kJ·mol-1 ②HCl(aq)+NaOH(s)=NaCl(aq)+H2O(l) ΔH=-b kJ·mol-1 ③HNO3(aq)+KOH(aq)=KNO3(aq)+H2O(l) ΔH=-c kJ·mol-1则a、b、c三者的大小关系为( ) A.a>b>c B.b>c>a C.a=b=c D.无法比较 B
组织建设第一章 化学反应与能量章末归纳与整理知识网络体系重点知识探究一、化学反应的热效应和键能的关系 在化学反应中,从反应物分子变为生成物分子,各原子间结合方式发生了改变。在这个过程中,反应物分子中的化学键部分或全部遭到破坏,生成物分子中的新化学键形成了。在破坏旧化学键时,需要能量来克服原子间的相互作用。在形成新化学键时,由于原子间的相互作用而放出能量。化学反应的热效应来源于反应过程中断裂旧化学键并形成新化学键时的能量变化。 化学键键能的大小可粗略计算化学反应的热效应:ΔH=反应物的键能总和-生成物的键能总和。【例题1】根据如图能量关系示意图,下列说法正确的是( ) A.1molC(s)与1molO2(g)的能量之和为393.5kJ B.反应2CO(g)+O2(g)=2CO2(g)中,生成物的总能量大于反应物的总能量 C.由C(s)→CO(g)的热化学方程式为:2C(s)+O2(g)=2CO(g) ΔH=-221.2kJ·mol-1 D.热值指一定条件下单位质量的物质完全燃烧所放出热量,则CO热值ΔH=-10.1kJ·mol-1 C 【对点训练】(2022·浙江温州·高二期末)在标准状态下,将指定单质生成1mol物质的反应焓称为该化合物的生成焓,符号为ΔfHmϴ。由题图所给的数据可得,下列说法正确的是( )A.生成NaF时放出热量最多,故化合时反应速率最快B.2NaCl(s)=2Na(s)+Cl2(g) ΔH=+822kJ▪mol-1C.NaI的热稳定性比NaBr高D.由图可知,断开1mol Cl2(g)中的化学键所吸收的能量大于断开1mol Br2(l)中的化学键所吸收的能量 B 【对点训练】(2022·重庆·高二阶段练习)碳量子点(CQDs)是一种新型碳纳米材料,我国化学家研究的一种新型复合光催化剂[碳量子点(CQDs)/氮化碳(C3N4)纳米复合物]可以利用太阳光实现高效分解水,其原理如图所示。下列说法正确的是( ) A.电负性:C>N B.水分解过程中,H2O2作催化剂 C.两种纳米材料均属于共价化合物 D.若反应II是放热反应,则反应I一 定是吸热反应D二、热化学方程式的正误判断 热化学方程式是表示参加反应物质的量与反应热的关系的化学方程式。热化学方程式的书写除了遵循书写化学方程式的要求外,应侧重从以下几个方面予以检查。 (1)检查ΔH符号的正误:放热反应的ΔH为“-”或“<0”,吸热反应的ΔH为“+”或“>0”,单位是kJ·mol-1,逆反应的ΔH与正反应的ΔH数值相同,符号相反。 (2)检查是否注明物质的聚集状态:必须注明每种反应物和生成物的聚集状态,同一个化学反应,物质的聚集状态不同,ΔH数值不同。二、热化学方程式的正误判断 热化学方程式是表示参加反应物质的量与反应热的关系的化学方程式。热化学方程式的书写除了遵循书写化学方程式的要求外,应侧重从以下几个方面予以检查。 (3)检查ΔH的数值与化学计量数是否对应:ΔH的大小与反应物的物质的量的多少有关,相同的反应,化学计量数不同时,ΔH不同。 (4)特殊反应热:①书写表示燃烧热的热化学方程式时,可燃物的化学计量数为1;产物应为完全燃烧生成稳定的氧化物,如C燃烧应生成CO2而不是CO,H2燃烧生成的是H2O(l),而不是H2O(g)。②书写表示中和热的热化学方程式时,H2O的化学计量数为1,并以此配平其余物质的化学计量数 【例题2】(2022·浙江宁波·高二期末)在25℃和101kPa下,1gH2燃烧生成液态水放出akJ(a>0)的热量,则下列热化学方程式书写正确的是( )C 【对点训练】(2021·重庆实验外国语学校高二阶段练习)下列有关热化学方程式的评价合理的是( )D 【对点训练】(2022·广西·钦州一中高二期中)实验测得:101 kPa时,1 mol H2完全燃烧生成液态水,放出285.8 kJ的热量;1 mol CH4完全燃烧生成液态水和CO2,放出890.3 kJ的热量。下列热化学方程式书写正确的是( ) A.2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1 B.CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890.3 kJ C.CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1 D.CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=890.3 kJ·mol-1 A三、盖斯定律在反应热计算中的应用 化学反应的反应热只与反应的始态(各反应物)和终态(各生成物)有关,而与反应的途径无关。即如果一个反应可以分步进行,则各分步反应的反应热之和与该反应一步完成时的反应热是相同的。如: ΔH=ΔH1+ΔH2 。 【注意】求总反应的反应热,不能不假思索地将各步反应的反应热简单相加。不论一步进行还是分步进行,始态和终态完全一致,盖斯定律才成立。某些物质只是在分步反应中暂时出现,最后应该恰好消耗完。 【例题4】(2022·辽宁·高二阶段练习)用H2O2和H2SO4的混合溶液可溶出废旧印刷电路板上的铜。已知: ①Cu(s)+2H+(aq)=Cu2+(aq)+H2(g) △H1=+64.3kJ·mol-1 ②2H2O2(l)=2H2O(l)+O2(g) △H2=-196.1kJ·mol-1 ③H2(g)+O2(g)=H2O(l) △H3=-285.8kJ·mol-1 在H2SO4溶液中,1molCu(s)与H2O2(l)反应生成Cu2+(aq)和H2O(l)的反应热△H等于( ) A.+546.7kJ·mol-1 B.-17.9kJ·mol-1 C.-118.5kJ·mol-1 D.-319.55kJ·mol-1D 【对点训练】(2022·浙江·乐清市知临中学高二期中)CaO和BaO的能量关系如图所示(M=Ca、Ba); 已知:离子电荷相同时,半径越小,离子键越强。下列说法正确的是( )DC四、反应热大小的比较 比较反应热的大小,一般从以下几个方面考虑: (1)比较“反应热”或ΔH的大小时,必须带“+”“-”符号;比较“燃烧热”“中和热”时,只需比较数值大小即可。 (2)参加反应的物质的量不同,则反应热的数值也会发生相应的变化,如1 mol H2完全燃烧生成液态水时放出285.8 kJ的热量,2 mol H2完全燃烧生成液态水时则放出571.6 kJ的热量。 (3)对于可逆反应,如3H2(g)+N2(g) 2NH3(g)ΔH=-92.4 kJ·mol-1,是指生成2 mol NH3时放出92.4 kJ的热量,而不是3 mol H2和1 mol N2混合,在一定条件下反应就可放出92.4 kJ的热量,实际3 mol H2和1 mol N2混合,在一定条件下反应放出的热量小于92.4 kJ,因为该反应的反应物不能完全转化为生成物。 比较反应热的大小,一般从以下几个方面考虑: (4)同一反应中物质的聚集状态不同,反应热数值大小也不同。例如,S(g)+O2(g)=SO2(g) ΔH1=-Q1 kJ·mol-1;S(s)+O2(g)=SO2(g) ΔH2=-Q2 kJ·mol-1可以理解成固态硫变成气态硫后再发生变化,而由固态到气态是需要吸收能量的,所以Q1>Q2、ΔH1<ΔH2,故当同一反应中只由于聚集状态不同比较反应热的大小时,反应物为固态时放出的热量少,当生成物为固态时放出的热量多。 (5)中和热为稀溶液中强酸和强碱生成1 mol H2O时的反应热。若酸为浓硫酸时,由于浓硫酸溶解放热,此时生成1 mol H2O放出热量大于57.3 kJ。若为弱酸或弱碱时,因为电离过程吸热,此时生成1 mol H2O放出的热量小于57.3 kJ。四、反应热大小的比较 【例题4】(2022·浙江·效实中学高二期中)已知强酸与强碱在稀溶液里反应的中和热可表示为H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ·mol-1。现有下列反应:NH3·H2O(aq)+HCl(aq)=NH4Cl(aq)+H2O(l) ΔH10.5H2SO4(浓)+NaOH(aq)=0.5Na2SO4(aq)+H2O(l) ΔH2HNO3(aq)+NaOH(aq)=NaNO3(aq)+H2O(l) ΔH3 上述反应均在溶液中进行,则下列ΔH1、ΔH2、ΔH3的关系正确的是( ) A.ΔH2>ΔH3>ΔH1 B.ΔH1>ΔH3>ΔH2 C.ΔH1=ΔH2=ΔH3 D.ΔH2=ΔH3>ΔH1 B 【对点训练】(2022·全国·高三专题练习)MgCO3和CaCO3的能量关系如图所示(M=Ca、Mg): 已知:离子电荷相同时,半径越小,离子键越强。下列说法不正确的是( ) A.ΔH1(MgCO3)>ΔH1(CaCO3)>0 B.ΔH2(MgCO3)=ΔH2(CaCO3)>0 C.ΔH1(CaCO3)-ΔH1(MgCO3)=ΔH3(CaO)-ΔH3(MgO) D.对于MgCO3和CaCO3,ΔH1+ΔH2>ΔH3 C 【对点训练】强酸和强碱稀溶液的中和热可表示为H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1, 已知: ①HCl(aq)+NH3·H2O(aq)=NH4Cl(aq)+H2O(l) ΔH=-a kJ·mol-1 ②HCl(aq)+NaOH(s)=NaCl(aq)+H2O(l) ΔH=-b kJ·mol-1 ③HNO3(aq)+KOH(aq)=KNO3(aq)+H2O(l) ΔH=-c kJ·mol-1则a、b、c三者的大小关系为( ) A.a>b>c B.b>c>a C.a=b=c D.无法比较 B
相关资料
更多









